Сандостатин ЛАР – эффективный и безопасный подход к терапии акромегалии
- Аннотация
- Статья
- Ссылки
В XX веке данные виды патологий не стали новыми формами неизвестного заболевания. Известные факты истории говорят нам о реальных гигантах и акромегалах прошлых веков. Среди гигантов наиболее широкую популярность получили ирландец Корнелиус Магран, Патрик О'Брайн (2,46 м), Чарльз Берн (2,30 м) и нынешние гиганты Александр Сизоненко (2,40 м), Леонид Стадник (2,55 м) [1]. Среди акромегалов прошлых веков хотелось бы выделить особенности облика египетского фараона Эхнатона X из XVIII династии (1372–1354 г. до н. э.). Судя по изображениям, фараон явно имел признаки заболевания. В истории древнего Рима есть упоминание об императоре Гае Юлии Вере Максимин. Исторические факты утверждают, что его рост составлял 2,60 м, а на сохранившихся монетах с его изображениями выделяются грубые черты лица [1]. История изучения акромегалии уходит своими корнями далеко в прошлое. С появлением новых представлений о строении человеческого тела (16 век н. э.), о гистоморфологических особенностях строения тканей, о строении органов внутренней секреции и изучении выделяемых ими биологически активных веществ изменялись представления и о данной патологии. Характерный симптомокомплекс уже четко описывался с 1772 года, но определение и название эта болезнь получила от Пьера Мари только в 1886 году [2].
Действительно, научный прорыв в изучении акромегалии произошел на рубеже XIX–XX веков, когда было доказано наличие гипофизарных гормонов. Дальнейшие исследования гипофиза и его влияния сводились к точному соотношению его патологии с акромегалией, а затем и к нахождению путей лечения выявленной причины данной нозологии. Поиск оптимального лечения всегда оставался одной из первоочередных задач изучения акромегалии.
Классификация и дефиниция
Причиной акромегалии в 95% случаев является избыточная секреция СТГ (соматотропного гормона) аденомой гипофиза, не ассоциированной с генетическими заболеваниями эндокринной системы. Гистоморфологически данная аденома может быть соматотропиномой, соматопролактиномой, маммосоматотропиномой или карциномой из соматотрофов. Гиперсекреция СТГ возникает вследствие генных мутаций на уровне α-субъединиц G-белка, под влиянием которого происходит пролиферация опухолевых клеток и повышение секреторной активности. В остальных 5% случаев акромегалия является одним из проявлений наследственных генетически опосредованных заболеваний в рамках следующих нозологий: 1) МЭН-1 синдром; 2) синдром Мак-Кьюна-Олбрайта; 3) Карни комплекс.
С появлением в арсенале МРТ технологий были предложены современные классификации аденом по размеру и расположению относительно турецкого седла.
Классификация по размеру опухоли: микроаденомы менее 10 мм, макроаденомы более 10 мм, гигантские аденомы более 40 мм.
На основании особенностей расположения в гипофизе используется классификация Hardy:
- 0 степень: эндоселлярная аденома;
- I степень: интраселлярная аденома с локальным разрушением турецкого седла;
- II степень: макроаденома, полностью заполняющая турецкое седло;
- III степень: макроаденома с локальной деструкцией дна турецкого седла и инвазией сфеноидального и кавернозного синусов;
- IV степень: макроаденома с тотальным разрушением турецкого седла и локальной инвазией.
Клинические и диагностические особенности акромегалии
Диагностика акромегалии в современной медицине не представляет особых трудностей. Для уточнения диагноза врачу достаточно оценить клиническую картину с подтверждением специфических лабораторных данных и картины инструментальных исследований [2].
Клиническая картина представляет собой характерный симптомокомплекс. Жалобы пациента на изменение внешности ассоциированы в первую очередь со снижением качества жизни. Характерные изменения внешности, особенно увеличение кистей и стоп, можно заметить даже при незначительном повышении СТГ. Тем не менее, в связи с медленно прогрессирующим течением заболевания, «тихим» появлением разных симптомов, не вызывающих на ранних стадиях дискомфорт у пациентов, болезнь часто остается нераспознанной: диагноз устанавливают только через 8–9 лет после появления первых признаков заболевания.
Основные субъективные и объективные признаки акромегалии и частота их встречаемости представлены в таблице 1.
Причиной инвалидизации пациентов чаще всего становятся осложнения со стороны сердечно-сосудистой системы (сердечная недостаточность, кардиомиопатии, нарушения проводимости), костной системы (деформации костей и суставов), дерматопатии, метаболические нарушения (сахарный диабет, гиперпролактинемия, снижение фертильности, либидо и потенции), патология нервной системы.
Основные специфические параметры для диагностики акромегалии включают определение СТГ и инсулинподобного ростового фактора – 1 (ИРФ-I) натощак или в любое время в течение дня. Важное значение ИРФ-I в патогенезе акромегалии и его корреляцию соответственно тяжести клинической картины установили еще в 1979 году.
Известно, что СТГ стимулирует выработку множества ростовых факторов (соматомединов), в том числе соматомедина С (а именно ИРФ-I), который вырабатывается в печени, а также других периферических ростовых факторов, особенно в костях и хрящевой ткани, под действием которых происходит пролиферация указанных тканей, гиперпродукция коллагена, что объясняет в конечном итоге клиническую картину заболевания.
Сегодня диагностика акромегалии часто осуществляется на амбулаторном этапе, где достаточно ограничены возможности проведения функциональных проб и практически невыполнимы многократные заборы крови. Часто не совсем корректным – однократным – определением уровня СТГ врач-эндокринолог отдаляет диагностику заболевания на несколько лет. Однократное определение уровня СТГ не обладает диагностической ценностью ввиду его импульсной секреции, короткого периода полужизни, перекрестных концентраций СТГ у больных и здоровых людей. Наибольшего уровня концентрация СТГ в крови достигает во время сна, особенно в течение III–IV стадий. У здоровых пациентов в течение дня концентрация СТГ очень низка. У больных акромегалией уровень СТГ выше за счет того, что выбросы гормона происходят чаще, поэтому концентрация в течение дня колеблется от 1 до 100 нг/мл и, в отличие от здоровых пациентов, не снижается днем. Как правило, уровень СТГ у больных натощак повышен, однако в 30–50% случаев это повышение незначительно, при этом у 17% больных уровень СТГ остается в норме [3].
Оптимальным является частое определение СТГ с разницей в 20 минут в течение 24 часов, что позволяет четко дифференцировать здоровых от больных пациентов. Однако, как было отмечено ранее, практически это трудновыполнимо [3].
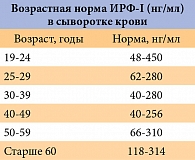
Поскольку уровень ИРФ-I повышен почти у всех больных и он коррелирует между средней суточной секрецией СТГ, измерение этого показателя является идеальным в качестве метода предварительной диагностики. В качестве подтверждения в некоторых случаях на фоне стабильно низкого уровня СТГ ИРФ-I оказался высоким. Циркадный ритм ИРФ-I незначительный, в связи с чем забор крови можно проводить практически в любое время суток. Поскольку ИРФ-I является стабильным белком, сыворотка крови пациента остается пригодной для определения ИРФ-I в течение недели. Показатель ИРФ-I определяется соответственно полу и возрасту (таб. 2).
В настоящее время надежным альтернативным методом диагностики является проведение функциональной пробы с глюкозой –
оральный глюкозотолерантный тест (ОГТТ) – при отсутствии в анамнезе у пациента сахарного диабета. В норме в ответ на гипергликемию отмечается снижение уровня СТГ. При акромегалии уровень СТГ не снижается ниже 1 нг/мл, более того в активной фазе отмечается «парадоксальный» выброс СТГ в ответ на нагрузку глюкозой. Другие ранее используемые функциональные пробы с соматолиберином и тиролиберином носят противоречивый характер, поэтому для диагностики используются крайне редко, а вернее сказать, с появлением точного определения ИРФ-I не используются [3].
Итак, основные диагностические критерии акромегалии:
- повышенный уровень ИРФ-I по отношению к данному полу и возрасту;
- базальный уровень СТГ более 0,4 нг/мл;
- минимальный уровень СТГ на фоне ОГТТ более 1 нг/мл.
Среди инструментальных методов исследования в арсенале врача сегодня присутствуют визуализирующие исследования для проведения топической диагностики: компьютерная томография (КТ), магнитно-резонансная томография (МРТ) головного мозга и прицельно области гипофиза с обязательным контрастированием. Указанные методы позволяют точно локализовать процесс, выявлять микроаденомы, а также определять соотношение аденомы гипофиза с окружающими тканями при вовлечении в процесс латероселлярных структур.
Рентгенография черепа в боковой проекции остается актуальной на ранних этапах диагностики при подозрении на патологический процесс. Она позволяет выявлять грубые костные изменения при опухолевом процессе, увеличение размеров турецкого седла, его двухконтурность.
Подтверждающим акромегалию фактором является определение толщины мягких тканей стопы, величина которой выражено коррелирует с уровнем СТГ. Данный показатель определяется как толщина мягких тканей стопы (ТМТС), в норме у женщин он не превышает 20 мм, у мужчин 21 мм.
При подозрении на макроаденому с экстраселлярным ростом необходимо дополнительно провести оценку состояния глазного дна и области перекреста зрительных нервов с определением полей зрения.
Поиски оптимального лечения
На сегодняшний день актуальным остается поиск оптимальной схемы комбинированного лечения. Согласно эпидемиологическим данным, наиболее значимыми предвестниками ранней инвалидизации и резистентности к лечению у больных с акромегалией являются:
- большие размеры опухоли гипофиза с экстраселлярным распространением и инвазивным ростом;
- длительность активной стадии;
- сохраняющиеся высокие уровни СТГ и ИРФ-I.
Целью лечения акромегалии, как и ранее, остается ликвидация (или блокирование) избыточной продукции СТГ, нормализация секреции СТГ и ИРФ-I, устранение клинических симптомов заболевания и улучшение качества жизни больного. Основными факторами, определяющими выбор метода лечения, являются размер и характер роста аденомы, состояние зрительных функций, уровни СТГ и ИРФ-I, возраст больного, наличие сопутствующей патологии, а также желание пациента выполнять предписания врача [3].
Существуют три метода лечения акромегалии (хирургический, лучевой и медикаментозный).
В настоящее время хирургический метод занимает лидирующие позиции в лечении акромегалии благодаря разработке технологии селективной аденомэктомии транс-назально-транссфеноидальным доступом с применением эндоскопической техники. Эндоскопический видеомониторинг, нейронавигация, МРТ-мониторинг дают возможность дифференцировать опухоль от нормальной ткани гипофиза и определять характер взаимоотношений аденомы с окружающими структурами. В случае радикального удаления опухоли у больных акромегалией очень быстро нормализуется уровень гормона роста и ИРФ-I, что сопровождается существенным улучшением их самочувствия и регрессом клинических проявлений. Результаты операции зависят от размеров опухоли и характера ее распространения (при эндоселлярной ремиссия наступает в 88%, при экстраселлярной – 45%). Недостатками хирургического лечения остаются общие проблемы, связанные с инвазивными методами лечения: риск осложнений после анестезии, повреждение сосудов и структур головного мозга, ликворея, возможное нарушение зрения, развитие гипопитуитаризма. И, конечно же, главным фактором успешного лечения всегда остается квалифицированность хирурга, выполняющего операцию.
Другой метод лечения – облучение области гипофиза гамма-частицами (гамма-нож), протонным пучком, электронным пучком.
Чаще всего данный метод лечения используется в качестве вспомогательного лечения после операции. Эффект лучевой терапии развивается в течение нескольких лет, через 5 лет уровень гормона снижается на 75% по сравнению с исходным показателем. В последнее время распространение получил метод стереотаксической радиохирургии, при котором однократно направляют луч очень большой дозы на четко ограниченную зону [2]. Хотя противопоказаний для лучевой терапии почти нет, однако показания к ней в настоящее время ограничены. Сохраняется риск потери фертильности при условии лечения молодого поколения, развития гипопитуитаризма, неврологических нарушений, лучевых некрозов, постлучевой энцефалопатии.
Разработанные в последние десятилетия высокоспецифичные препараты, избирательно подавляющие секрецию или действие СТГ, значительно облегчили ведение больных со стойкой секрецией СТГ.
Для медикаментозной терапии акромегалии в настоящее время используются три класса перспективных препаратов: агонисты дофамина, антагонисты рецепторов гормона роста и длительно действующие аналоги соматостатина.
Среди стимуляторов дофаминергических рецепторов наибольшую известность получил полусинтетический алкалоид спорыньи – бромокриптин (парлодел), вызывающий парадоксальное снижение уровня гормона роста примерно у 20% больных и менее чем у 10% снижение ИФР-1. Эффективная терапевтическая доза препарата составляла 10–20 мг/сут., однако препарат был эффективен только у 30% больных, поэтому в настоящее время в мировой практике практически не применяется, особенно в качестве монотерапии [4].
В настоящее время на смену парлоделу пришли селективные и пролонгированные Д2‑агонисты дофамина – квинаголид (Норпролак) и каберголин (Достинекс). Благодаря селективному действию и отсутствию стимуляции Д1‑дофаминовых рецепторов они отличаются более выраженным клиническим эффектом и меньшими побочными свойствами. Квинаголид в суточной дозе 0,3 мг способен нормализовать уровни СТГ и ИРФ-I примерно у 40% больных. Каберголин отличается более продолжительным действием (до 72 ч.) и еще меньшим количеством побочных эффектов. В дозе от 1 мг до 3,5 мг в неделю эффективность каберголина подтверждена в 28–50% случаев [2].
Среди побочных эффектов Д2‑ агонистов дофамина – желудочно-кишечные расстройства, нарушения сна, ортостатическая гипотония, аритмии, периферический вазоспазм. Основное применение агонисты дофамина получили при смешанной аденоме гипофиза (соматопролактинома) с умеренной функциональной активностью, то есть при сочетании повышенных уровней СТГ и пролактина.
В последнее время широкое распространение в терапевтической практике получили синтетические аналоги соматостатина. Соматостатин является одним из самых главных ингибиторов гормональной активности, подавляет базальную и стимулированную секрецию гормона роста, а также в меньшей степени – ТТГ, ингибирует секрецию глюкагона, инсулина, гастрина, секретина, холецистокинина. Многочисленные эффекты соматостатина опосредуются через специфические рецепторы, расположенные в головном мозге, передней доле гипофиза, эндокринной и экзокринной частях поджелудочной железы, в серозной оболочке желудочно-кишечного тракта, легких, в органах иммунной системы.
Выделяют 5 подтипов специфических рецепторов, локализованных в различных тканях организма и функционально связанных посредством G-белка с системой внутриклеточных мессенджеров:
- подтип 1 располагается в ЦНС, легких, желудочно-кишечном тракте;
- подтип 2 – в ЦНС, гипофизе и желудочно-кишечном тракте;
- подтип 3 – в ЦНС и поджелудочной железе;
- подтип 4 – в ЦНС и легких;
- подтип 5 – только в гипофизе [4].
В 81% случаев СТГ-продуцирую-щая аденома гипофиза экспрессирует на своей поверхности пятый подтип соматостатиновых рецепторов [2]. Свойство соматостатина ингибировать функциональную и пролиферативную активность клеток в дальнейшем было использовано при разработке его лекарственных форм. Использование нативного соматостатина оказалось невозможно ввиду его короткого периода полужизни (< 3 мин.). В результате появились селективные аналоги природного соматостатина. Октреотид (Cандостатин) – первый аналог соматостатина, используется в практике с 1984 года, подавляет секрецию гормона роста в 45 раз сильнее нативного соматостатина. Препарат имеет высокое сродство ко 2‑му подтипу рецепторов и вовсе не связывается с 1‑м и 4‑м подтипами соматостатиновых рецепторов. Продолжительность его действия – 8 часов, поэтому препарат вводится 3 раза в сутки подкожно. Обычно разовая доза Сандостатина равняется 100–200 мкг на одну инъекцию. Как показали исследования, Сандостатин дает быстрый и стойкий клинический эффект в 50–100% случаев (уменьшение степени проявления клинических симптомов).
В связи с необходимостью ежедневных многократных инъекций Сандостатина были сделаны вполне успешные попытки улучшить фармакологические свойства препарата, а именно создать препарат с большей продолжительностью действия.
Пролонгированная форма октреотида – Сандостатин ЛАР – была создана в 1994 году. Субстанция октреотида (10, 20, 30 мг), смешанная с полимерным матриксом (DL-лактитко-гликолид + стерильный маннитол), заключена на поверхности и внутри микросферы. После внутримышечного введения происходит постепенное высвобождение активного вещества из микросфер с последующей деградацией полимерной основы. Благодаря высвобождению с поверхности микросфер происходит быстрое нарастание концентрации препарата с последующим снижением и вновь нарастанием концентрации через 7 дней за счет выделения активного вещества из центральной части микросферы. Таким образом, препарат контролирует процессы секреции гормона роста в течение 28–32 дней после однократной инъекции. На сегодняшний день Сандостатин ЛАР является наиболее широко используемым в мире препаратом для лечения больных акромегалией [8].
По данным проведенных исследований, терапия Сандостатином ЛАР приводит к полному исчезновению симптомов в 47–81% случаев, нормализация ИРФ-I была выявлена в 66–88% случаев. У всех пациентов наблюдалось улучшение самочувствия и качества жизни. Терапия Сандостатином ЛАР приводила к обратному развитию нарушений со стороны сердечно-сосудистой системы: снижению артериальной гипертензии, регрессу кардиомиопатии, уменьшению ночных апноэ. Достижение стабильно нормального уровня ИРФ-I в течение 1 года приводит к практически полному восстановлению миокарда левого желудочка. Одним из основных свойств данной группы препаратов является способность вызывать уменьшение размеров аденомы за счет подавления пролиферативных процессов через соматостатиновые рецепторы. Были отмечены результаты, что в 97,8% случаев отмечен надежный уверенный контроль над размером опухоли [2]. При этом при терапии Cандостатином ЛАР был отмечен максимальный эффект: уменьшение размеров опухоли у 80% больных в группе первичной терапии, у 28% больных в группе дополнительной терапии. Для сравнения при терапии ланреотидом в группе первичной терапии эффект был достигнут у 31%, при терапии октреотидом эффект был получен в 51% случаев также в группе первичной терапии.
Также на фоне терапии Сандостатином ЛАР обеспечивается стабильный гормональный контроль. На фоне нескольких лет постоянной терапии Сандостатином ЛАР уровень ИРФ-I снижается до нормальных значений в 75% случаев. По данным клинических исследований через 12 месяцев терапии количество больных с нормальным уровнем ИРФ-I составляет 60%, а через 36 месяцев – 79%. Данные цифры отражали динамику стабилизации гормонального фона на том же уровне, что и после радикального хирургического вмешательства в случае эндоселлярных аденом [9].
Побочное действие аналогов соматостатина сводится к незначительной брадикардии, преходящим болям в животе, тошноте, метеоризму, стеаторее. Оно наиболее выражено после 1‑й инъекции и нивелируется при продолжении лечения. Также возможно появление камней в желчном пузыре с необходимой оценкой УЗ-картины.
Таким образом, синтетические аналоги соматостатина эффективны в качестве первичного метода лечения, особенно при противопоказаниях к операции или отказе от нее, а также у больных пожилого возраста. Учитывая, что более чем у 80% больных на фоне длительной терапии Сандостатином ЛАР происходила нормализация уровней СТГ и ИРФ-I и уменьшение опухоли, были расширены показания для данного вида терапии и открыта возможность применять его в качестве предоперационной подготовки с целью уменьшения размеров опухоли для проведения операции не транскраниальным, а более щадящим трансназальным доступом и уменьшить тем самым число возможных послеоперационных осложнений.
Кроме того, Сандостатин ЛАР назначается больным, перенесшим лучевую терапию, на период, необходимый для наступления положительного эффекта облучения [6].
В настоящее время принята следующая схема лечения акромегалии Сандостатином ЛАР:
- для оценки эффективности и индивидуальной переносимости препарата первоначально в течение 2 недель назначается октреотид (Сандостатин) подкожно по 100–200 мкг 3 раза в день;
- при положительном эффекте и отсутствии выраженных побочных реакций Сандостатин ЛАР вводится в дозе 20 мг внутримышечно 1 раз в 28 дней в течение 3 месяцев;
- через 3 месяца осуществляется оценка основных показателей (СТГ и ИРФ-I);
- если отмечается положительный клинический эффект наряду со значительным снижением уровня СТГ (< 1 нг/мл) и нормализацией содержания ИРФ-I – дозу препарата снижают до 10 мг/28 дней;
- если уровень СТГ под влиянием препарата снижается < 5 нг/мл, но остается > 1 нг/мл, дозу препарата оставляют прежней (20 мг/28 дней);
- если отсутствует нормализация СТГ и ИРФ-I – дозу препарата увеличивают до 30–40 мг/28 дней;
- если в течение 3–6 месяцев не достигнута положительная динамика – решается вопрос об оперативном лечении.
В дальнейшем проводят регулярный контроль клинических и биохимических показателей, включая определение уровней СТГ и ИРФ-I, для оперативной коррекции дозы и возможной смены тактики лечения, а также контроль МРТ для оценки динамики уменьшения аденомы.
Убедительно доказано, что применение аналогов соматостатина достоверно увеличивает продолжительность и улучшает качество жизни пациентов с акромегалией независимо от степени тяжести заболевания.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.