Штаммоспецифичность пробиотиков. XVIII Съезд педиатров России с международным участием «Актуальные проблемы педиатрии». Встреча с профессором
- Аннотация
- Статья
- Ссылки
Заведующая кафедрой педиатрии Российской медицинской академии непрерывного профессионального образования (РМАНПО), профессор, д.м.н., заслуженный врач РФ, главный педиатр Центрального федерального округа РФ Ирина Николаевна ЗАХАРОВА, опираясь на широкую доказательную базу, осветила современные представления о микробиоте, обозначила критерии выбора оптимального пробиотика, изложила концепцию мультиштаммовости пробиотиков и перспективы развития данного направления в коррекции нарушений кишечной микробиоты и других состояний.
Заведующая консультативно-диагностическим отделением детской городской поликлиники № 133, доцент кафедры педиатрии РМАНПО, к.м.н. Нарине Григорьевна СУГЯН представила результаты исследования эффективности мультиштаммового пробиотика Бак-Сет Беби при функциональных нарушениях желудочно-кишечного тракта и влияния на метаболическую активность кишечной микрофлоры у детей раннего возраста.
Заведующая кафедрой педиатрии Российской медицинской академии непрерывного профессионального образования (РМАНПО), профессор, д.м.н., заслуженный врач РФ, главный педиатр Центрального федерального округа РФ Ирина Николаевна ЗАХАРОВА, опираясь на широкую доказательную базу, осветила современные представления о микробиоте, обозначила критерии выбора оптимального пробиотика, изложила концепцию мультиштаммовости пробиотиков и перспективы развития данного направления в коррекции нарушений кишечной микробиоты и других состояний.
Заведующая консультативно-диагностическим отделением детской городской поликлиники № 133, доцент кафедры педиатрии РМАНПО, к.м.н. Нарине Григорьевна СУГЯН представила результаты исследования эффективности мультиштаммового пробиотика Бак-Сет Беби при функциональных нарушениях желудочно-кишечного тракта и влияния на метаболическую активность кишечной микрофлоры у детей раннего возраста.


Штаммоспецифичность пробиотиков: кому, какие, сколько
Профессор И.Н. Захарова начала свое выступление с небольшого экскурса в историю изучения кишечной микробиоты, насчитывающую более трех столетий.
Эволюция представлений о микроорганизмах берет свое начало с создания ученым Антони ван Левенгуком микроскопа, позволившего визуализировать микроорганизмы в разных биологических жидкостях. Впоследствии Генрих Герман Роберт Кох изобрел твердые питательные среды – основу для развития микробиологии XIX в. На современном этапе широкое распространение получили серологические методы диагностики, основанные на идентификации антигенов и антител в сыворотке крови, а также тканях организма. Начало новой эпохи представлений о микробиоте связано с развитием молекулярно-генетических методов исследования, базирующихся на изучении метагеномики и анализе ДНК.
Интерес к микробиому и использованию для его восстановления пробиотиков не ослабевает, что подтверждается ростом числа публикаций. Данной теме посвящены многочисленные научные исследования и статьи не только в области гастроэнтерологии, но и дерматологии, стоматологии, психиатрии, аллергологии, кардиологии, ревматологии. С каждым годом перечень специальностей расширяется, поскольку с нарушенной микрофлорой кишечника ассоциируется широкий спектр заболеваний.
Функции нормальной микрофлоры кишечника разнообразны: защитная, пищеварительная, детоксикационная, антиканцерогенная, регуляторная. Кишечная микробиота, будучи генетическим банком, обменивается генетическим материалом с клетками человека путем фагоцитоза. Кроме того, как главный орган иммунной системы кишечная микробиота осуществляет иммуногенную функцию. Последняя считается одной из основных функций пробиотиков.
Пробиотики оказывают положительный эффект на организм человека. В клинической практике обычно используются три группы пробиотиков: Bifidobacterium, Lactobacillus и Saccharomyces boulardii. Вместе с тем необходимо помнить, что все эффекты пробиотиков штаммоспецифичны. Применяемые в педиатрической практике штаммы должны отвечать ряду требований, важнейшим из которых является безопасность.
Производственные штаммы должны быть:
- непатогенными;
- иметь человеческое происхождение;
- обладать антагонистической активностью по отношению к патогенным и условно патогенным микроорганизмам;
- отличаться жизнеспособностью, обусловленной устойчивостью к действию кислот и ферментов желудочно-кишечного тракта (ЖКТ);
- иметь стабильные генетические характеристики, в частности отсутствие R-плазмид;
- прочно адгезироваться на слизистой оболочке кишечника (например, ребенку в первый месяц жизни не рекомендуется давать Lactobacillus rhamnosus GG (LGG), поскольку доказано, что LGG плохо адгезируются на слизистой оболочке кишечника новорожденного).
Пробиотики работают на уровне собственной пластинки, расположенной над эпителием, а также на уровне эпителия и ниже эпителиального слоя. Пробиотики оказывают трехуровневый эффект – люминальный, эпителиальный, иммунный1.
Люминальный эффект предполагает конкурентное ингибирование адгезии патогенов, антимикробное действие, продукцию органических кислот, синтез перекиси водорода, продукцию бактериоцинов, а также влияние на рН кишечного содержимого.
Эпителиальный эффект обеспечивают барьерная функция, синтез муцина слизи, секреция секреторного иммуноглобулина (Ig) класса A, а также инактивация токсинов к рецепторам.
Иммунный эффект достигается за счет модуляции выработки различных цитокинов (фактора некроза опухоли (ФНО) альфа, интерферона гамма, интерлейкина (ИЛ) 12, нормативных ИЛ-4, ИЛ-10), стимуляции врожденного иммунитета, модуляции дендритных клеток и моноцитов.
В настоящее время продолжаются исследования применения определенных штаммов при конкретной болезни. В протокол ведения детей с острым гастроэнтеритом Европейского общества педиатров, гастроэнтерологов, гепатологов и детских нутрициологов в 2014 г. были включены два штамма микроорганизмов – S. boulardii и L. rhamnosus GG, а в 2015 г. – L. reuteri и L. acidophilus LB.
На фоне приема пробиотиков наблюдается повышение параметров Т- и В-клеточного иммунитета, увеличение авидности антител крови к связыванию антигенов патогенных микробов и их токсинов, устранение дисбаланса синтеза провоспалительных и противовоспалительных цитокинов.
Свойства штаммов различны. Так, L. casei стимулирует синтез ИЛ-12, ФНО-бета, L. rhamnosus GG – синтез ИЛ-10, что очень важно для реабилитации часто болеющих детей, а также снижает концентрацию ФНО-альфа, что крайне важно при лечении пищевой аллергии, Bifidobacterium longum снижает синтез IgЕ.
Безусловно, выбор пробиотика должен основываться на принципах доказательной медицины. Согласно Рекомендациям по применению пробиотиков (Recommendations for Probiotic Use), штаммы LGG, B. lactis, L. acidophilus, L. plantarum, L. johnsonii характеризуются уровнем доказательности А при лечении и профилактике аллергии, B. infantis – уровнем доказательности В при лечении детей с синдромом раздраженного кишечника, LGG, L. reuteri, S. boulardii, L. casei – уровнем доказательности А при лечении инфекционной диареи у детей.
Доказана эффективность пробиотиков при инфекционной диарее (подтвержденный эффект), антибиотик-ассоциированной диарее (скорее всего превентивный эффект, неподтвержденный терапевтический эффект), непереносимости лактозы (подтвержденный эффект), воспалительных заболеваниях толстой кишки (возможный эффект), аллергии (возможный превентивный эффект, возможный терапевтический эффект).
Раннее необоснованное назначение антибиотикотерапии значительно травмирует состояние микробиоты ребенка, вызывая долгосрочные нежелательные последствия в виде нарушения ее баланса. «Сегодня в мире стараются не использовать антибиотики для лечения кишечных инфекций. При назначении антибиотиков все дети до достижения пятилетнего возраста должны получать пробиотики», – уточнила профессор И.Н. Захарова.
Мультиштаммовые пробиотические препараты, оказывающие комплексное воздействие, считаются препаратами выбора при функциональных нарушениях ЖКТ у детей раннего возраста. Одним из представителей мультиштаммовых пробиотиков является Бак-Сет Беби. Это пробиотик нового поколения, созданный в Великобритании и зарегистрированный в России. В его состав входят L. casei, L. rhamnosus, L. acidophilus, B. breve, B. infantis, B. longum, Streptococcus thermophilus, а также фруктоолигосахариды (ФОС) в качестве пребиотиков. Именно поэтому Бак-Сет Беби можно рассматривать как синбиотик. Все штаммы имеют оригинальное происхождение и хранятся в банке культур Соединенного Королевства.
Эффективность применения мультиштаммового пробиотика Бак-Сет Беби у детей младшего возраста подтверждена собственным опытом докладчика и результатами ряда международных клинических исследований.
В рандомизированном исследовании оценивали эффективность и безопасность применения Бак-Сет Беби в лечении запора у детей2. Через неделю приема улучшение наблюдалось в обеих группах пациентов, однако статистически значимо в группе терапии препаратом Бак-Сет Беби. Данная тенденция сохранялась в течение четырех недель лечения в отношении как частоты (р = 0,042), так и консистенции (р = 0,049) стула. У пациентов, принимавших Бак-Сет Беби, наблюдалось уменьшение боли в животе (р = 0,017) и недержания кала (р = 0,03). Нежелательных явлений и побочных эффектов не зарегистрировано.
В исследовании E.T. Yala показана клиническая эффективность мультипробиотика Бак-Сет Беби в лечении острого гастроэнтерита у детей в возрасте от двух месяцев до двух лет. В группе детей, получавших мультипробиотик, частота диареи снижалась уже на третий день лечения3.
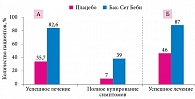
В рандомизированном плацебоконтролируемом исследовании сравнивали эффективность Бак-Сет Беби и плацебо при младенческих коликах. Согласно полученным данным, эффективность лечения на седьмой день в группе Бак-Сет Беби была значительно выше, чем в группе плацебо, – 82,7 и 35,7% соответственно (р < 0,005) (рис. 1).
Кроме того, купирование симптомов также значительно чаще отмечалось в группе мультипробиотика (39 против 7%; р < 0,03). Разница в эффективности терапии сохранялась в течение месяца и к 30-му дню лечения в группе Бак-Сет Беби была в два раза выше, чем в группе плацебо (87 против 46%). Побочные эффекты отсутствовали.
Иранскими исследователями была предпринята попытка использовать английский мультипробиотик в дополнение к стандартной терапии инфекции, вызванной Helicobacter pylori, у детей4. Скорость элиминации H. pylori была достоверно выше (р = 0,04) в группе терапии с дополнительным применением мультипробиотика (90 против 69%). У детей, получавших вместе со стандартной терапией Бак-Сет Беби, отмечался более низкий уровень тошноты и рвоты (р = 0,02) и диареи (р = 0,039) в отсутствие серьезных нежелательных явлений.
В турецком исследовании изучалось влияние мультиштаммового пробиотика на уровень фекального кальпротектина у детей с кистозным фиброзом. Этот уровень был повышен у 2/3 пациентов5. Согласно полученным данным, уровень кальпротектина существенно снизился (< 50 мг/г) у 29 детей: у 21 пациента из группы мультипробиотика и только у 8 пациентов из группы плацебо.
Доказано, что назначение мультиштаммового пробиотика повлияло на уменьшение концентрации кальпротектина и степени воспаления кишечника у пациентов с кистозным фиброзом.
Результаты проведенного исследования подтверждают обоснованность дальнейших клинических испытаний по использованию пробиотиков для улучшения контроля абдоминальных симптомов, связанных с кистозным фиброзом.
Оценке влияния мультипробиотика Бак-Сет в составе комплексной терапии на инсулинорезистентность и липидный профиль у лиц с метаболическим синдромом (МС) было посвящено рандомизированное двойное слепое плацебоконтролируемое исследование с участием 38 взрослых пациентов6. Участники исследования составили две равнозначные группы – мультипробиотика и плацебо.
Как показали результаты, пробиотические добавки усиливают эффекты от модификации образа жизни в лечении МС частично через ослабление инсулинорезистентности и улучшение уровня сывороточных липидов. Различия между двумя группами были статистически значимы (р < 0,001).
В другом исследовании изучали возможности мультипробиотика Бак-Сет Беби в качестве вспомогательного средства при лечении неалкогольной жировой дистрофии печени (НАЖДП)7. 52 пациента с НАЖДП были рандомизированы на две равнозначные группы – мультипробиотика и плацебо. У пациентов обеих групп отмечалось улучшение уровня аланинаминотрансферазы (АЛТ), но в группе мультипробиотика среднее снижение уровня АЛТ было более значимым, чем в группе плацебо. Аналогичные результаты получены и в отношении снижения уровня аспартатаминотрансферазы (АСТ). Причем тенденция сохранялась до конца 28-недельного периода оценки результатов.
Полученные данные показали, что использование пробиотических добавок в дополнение к изменению образа жизни и диете при НАЖДП способствует более существенному улучшению некоторых функциональных параметров со стороны печени, по крайней мере за счет ослабления воспалительных маркеров в организме.
Еще одно исследование было посвящено оценке эффективности пробиотика Бак-Сет Беби в сочетании с метформином при неалкогольном стеатогепатите (НАСГ)8. Продемонстрировано преимущество комплексного лечения НАСГ метформином с мультипробиотиком перед монотерапией метформином в отношении снижения уровней АЛТ, АСТ, признаков стеатоза. Исследователи сделали вывод, что мультиштаммовый пробиотик позволяет повысить эффективность терапии НАСГ, влияя на потерю веса.
Клинические и иммунологические эффекты Бак-Сет Беби изучали у младенцев и детей с атопическим дерматитом9. В группе Бак-Сет Беби имело место более значимое снижение индекса SCORAD, а средняя разница в уровнях IgE между двумя группами не была статистически значимой. Бак-Сет Беби клинически уменьшает остроту атопического дерматита у детей раннего возраста. Однако необходимы дальнейшие исследования, чтобы подтвердить влияние пробиотиков на иммунную систему.
На сегодняшний день уже имеются результаты исследований, доказывающие способность пробиотиков повышать эффективность стандартного лечения бактериального вагиноза. Комбинация метронидазола с пробиотиками продемонстрировала статистически (р = 0,032) более значимую эффективность в лечении бактериального вагиноза по сравнению с монотерапией метронидазолом (87,5 против 67,5%).
В заключение профессор И.Н. Захарова отметила, что мультипробиотик нового поколения Бак-Сет Беби может быть рекомендован в качестве эффективного и безопасного средства для коррекции функциональных нарушений ЖКТ у детей первого года жизни.
Применение Бак-Сет Беби у детей грудного возраста с функциональными нарушениями ЖКТ: данные клинического исследования
На амбулаторной клинической базе кафедры педиатрии РМАНПО было проведено рандомизированное плацебоконтролируемое исследование клинической эффективности мультиштаммового пробиотика Бак-Сет Беби при функциональных нарушениях ЖКТ и его влияния на метаболическую активность кишечной микрофлоры у детей раннего возраста. Прежде чем ознакомить аудиторию с результатами исследования, Н.Г. Сугян отметила уникальность препарата Бак-Сет Беби: семь видов живых пробиотических бактерий и пребиотик ФОС, входящие в его состав, делают его мультивидовым синбиотиком.
Бак-Сет Беби – единственный мультивидовый синбиотик, предназначенный для использования у детей с первых дней жизни. Докладчик отметила, что мультиштаммовые пробиотики представляют собой не случайную смесь штаммов, а закономерное конструирование сложной, взаимозависимой, многозвеньевой микробной иерархии со специфическими правилами взаимодействия между отдельными звеньями, что придает экосистеме стабильность и биологическую мощность. Если в состав пробиотического препарата входит один бактериальный штамм, то вряд ли он способен выполнить основные функции, присущие множеству нормальных кишечных бактерий. Мультивидовые пробиотики имеют явное преимущество перед одноштаммовыми и даже мультиштаммовыми, поскольку способны воспроизводить сложную экосистему в просвете кишечника и воздействовать на всех уровнях в различных биотопах ЖКТ.
Клиническая эффективность мультивидового препарата Бак-Сет Беби в купировании функциональных нарушений ЖКТ и его благоприятное влияние на метаболическую активность собственной кишечной микрофлоры у детей раннего возраста подтверждены результатами исследования, проведенного на амбулаторной клинической базе кафедры педиатрии РМАНПО. В исследование были включены 45 детей от рождения до года с функциональными нарушениями ЖКТ, возникшими при переходе на искусственное вскармливание или введении прикорма.
Основную группу составили 30 детей, которые получали Бак-Сет Беби по одному саше один раз в день за 15 минут до еды в течение 14 дней. В группу плацебо вошли 15 детей, которые получали мальтодекстрин по аналогичной схеме. Длительность наблюдения составила 21–30 дней.
Эффективность мультиштаммового пробиотика оценивали на основании анализа динамики клинической симптоматики функциональных нарушений ЖКТ и показателей метаболической активности кишечной микрофлоры, определяемых методом газожидкостной хроматографии кала. Этот метод оценки состояния микробиоты кишечника основан на изучении метаболитов микроорганизмов, в частности короткоцепочечных жирных кислот (КЖК) в кале.
В процессе пищеварения при участии кишечной микрофлоры образуются новые низкомолекулярные метаболиты – циклические нуклеотиды, аминокислоты, дикарбоновые кислоты, оксикислоты. Среди них большое физиологическое значение имеют КЖК: уксусная, пропионовая и масляная.
КЖК у новорожденных практически отсутствуют, поскольку у них окончательно не сформирована кишечная микрофлора. У здоровых детей концентрация КЖК резко возрастает к 20–30-му дню до 70–80 ммоль/л и к двум годам достигает значений взрослого человека: в проксимальных отделах – 70–140 ммоль/л, дистальных – 20–70 ммоль/л.
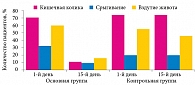
Исследование продемонстрировало хорошую клиническую эффективность мультиштаммового пробиотика Бак-Сет Беби в купировании функциональных нарушений ЖКТ у детей раннего возраста. Оценка динамики симптомов функциональных нарушений ЖКТ до и после коррекции препаратом Бак-Сет Беби показала, что в основной группе проявления кишечных колик были купированы у 86% детей, срыгивания – у 70%, метеоризм – у 78%. В группе плацебо положительная динамика симптомов была незначительной (рис. 2).
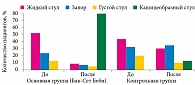
Были изучены характерные особенности стула в группах до и после коррекции функциональных нарушений ЖКТ. В начале наблюдения более чем у половины детей основной группы стул был жидкий и водянистый, у 26% самостоятельный стул вовсе отсутствовал. Через две недели от начала приема пробиотика Бак-Сет Беби у 80% детей основной группы стул стал кашицеобразным. В группе плацебо нарушения характера стула сохранялись у большинства детей (рис. 3).
Оценка состояния микробиоты кишечника, динамики лабораторных показателей на основании общего содержания КЖК продемонстрировала наличие резкой активизации анаэробных микроорганизмов, продуцирующих пропионовую и масляную кислоты (1-й тип), активизацию аэробных микроорганизмов, продуцирующих в основном уксусную кислоту, представителей факультативной микрофлоры (2-й тип).
После курса коррекции у пациентов группы мультипробиотика Бак-Сет Беби восстановилась метаболическая активность кишечной микрофлоры, уровень КЖК приблизился к норме. Наиболее значимые результаты отмечались у детей, у которых отмечалась активизация анаэробных микроорганизмов до пробиотикотерапии.
Продуцентом уксусной кислоты является облигатная микрофлора – бифидобактерии, лактобактерии, руминококки. По словам доцента Н.Г. Сугян, снижение уровня уксусной кислоты указывает на рост аэробной (кокковой) флоры и угнетение сахаролитической анаэробной микрофлоры. Снижение уровня пропионовой кислоты предполагает гиперколонизацию анаэробной микрофлоры с пропионовокислым брожением, угнетение основных продуцентов, дефицит пектинов в пищевом рационе. Снижение уровня масляной кислоты связано с гиперколонизацией анаэробной микрофлоры с преобладающим маслянокислым брожением, дефицитом в рационе питания пищевых волокон или преобладанием гнилостных процессов, энергодефицитом колоноцита. Уменьшение содержания масляной кислоты может косвенно указывать и на ферментативную недостаточность поджелудочной железы.
В группе плацебо изначально отмечалось увеличение уровня уксусной кислоты и снижение уровня пропионовой и масляной кислот. После курса коррекции положительных изменений не наблюдалось.
Важным показателем внутрикишечных изменений считается анаэробный индекс. Согласно полученным данным, прием препарата Бак-Сет Беби способствовал нормализации уровня анаэробного индекса, что предполагает создание внутрикишечной среды, благоприятной для роста собственной облигатной микрофлоры.
Полученные в ходе исследования результаты позволили сделать следующие выводы.
Мультиштаммовый (мультивидовый) пробиотик Бак-Сет Беби, показавший высокую клиническую эффективность, безопасность и хорошую переносимость, может быть рекомендован для коррекции функциональных нарушений ЖКТ у детей первого года жизни, возникающих на фоне введения прикорма, перевода на искусственное или смешанное вскармливание.
Бак-Сет Беби нормализует метаболическую активность облигатной кишечной микрофлоры у детей раннего возраста.
Заключение
Расширение представлений о функциях микробиоты способствует развитию новых направлений клинического применения мультипробиотиков, состав и биологические свойства которых приближены к таковым облигатной микрофлоры человеческого организма.
Представителем мультипробиотиков нового поколения с доказанной клинической эффективностью является препарат Бак-Сет Беби. Мультивидовый синбиотик Бак-Сет Беби признан эффективным средством в коррекции нарушений кишечной микробиоты и функциональных нарушений ЖКТ у детей первого года жизни, возникающих на фоне введения прикорма или перевода на искусственное/смешанное вскармливание. Мультипробиотик Бак-Сет Беби характеризуется хорошим профилем безопасности: на фоне его применения не зарегистрировано нежелательных явлений или признаков непереносимости.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.