Снижение риска сердечно-сосудистых катастроф у коморбидного пациента с болезнью мелких сосудов и метаболическим синдромом: внимание к деталям. III Национальный конгресс «Кардионеврология». Симпозиум компании «Берлин-Хеми/А. Менарини»
- Аннотация
- Статья
- Ссылки




Взгляд кардиолога на ведение пациента с сердечно-сосудистыми заболеваниями и метаболическим синдромом: от общего к частному
Метаболический синдром характеризуется увеличением массы висцерального жира, снижением чувствительности периферических тканей к инсулину и гиперинсулинемией, которые вызывают нарушения углеводного, липидного, пуринового обменов и артериальную гипертензию. По данным, которые привела профессор Московского государственного медико-стоматологического университета им. А.И. Евдокимова, вице-президент Российского медицинского общества по артериальной гипертонии, д.м.н., профессор Ольга Дмитриевна ОСТРОУМОВА, распространенность метаболического синдрома в среднем составляет 25% и с возрастом увеличивается1.
Установлено, что у людей с метаболическим синдромом выше риск инсульта и инфаркта миокарда2. При этом метаболический синдром считается более сильным предиктором сердечно-сосудистых событий по сравнению с его компонентами (ожирением, дислипидемией, артериальной гипертензией, микроальбуминурией, инсулинорезистентностью)3. Особого внимания заслуживает нарушение толерантности к глюкозе, которое является маркером развития макрососудистых осложнений: инсульта, коронарной болезни сердца и других сердечно-сосудистых событий4.
Почему у пациентов, страдающих метаболическим синдромом, столь высок риск сердечно-сосудистых осложнений? Во-первых, это связано с трудностями контроля артериального давления. Не случайно у таких пациентов нередко наблюдается резистентная артериальная гипертензия. Во-вторых, у пациентов с метаболическим синдромом в два-три раза чаще возникает гипертрофия левого желудочка5, в три раза выше величина толщины комплекса «интима – медиа»6, что существенно увеличивает риск цереброваскулярных осложнений. Свой вклад вносит и часто обнаруживаемая у пациентов с метаболическим синдромом и артериальной гипертензией микроальбуминурия, которая в полтора раза повышает риск развития инсульта7.
Таким образом, метаболический синдром с его сложными патогенетическими механизмами увеличивает риск развития сердечно-сосудистых осложнений у пациента с артериальной гипертензией. Это диктует необходимость выбора рациональных антигипертензивных препаратов. Помимо того что препарат должен обладать высокой антигипертензивной эффективностью, снижать вариабельность артериального давления, он должен быть метаболически нейтральным (положительно влиять на углеводный, липидный обмены и уровень мочевой кислоты). Еще одно первоочередное требование к препарату – наличие у него органопротективных свойств, поскольку у пациентов с метаболическим синдромом часто поражены органы-мишени (сердце, почки, сосуды). Наконец, необходимо, чтобы прием препарата не сопровождался развитием серьезных нежелательных явлений.
В европейских рекомендациях и действующих российских руководствах для коррекции артериальной гипертензии, развившейся на фоне метаболического синдрома, рекомендованы три класса препаратов: блокаторы рецепторов ангиотензина II (сартаны), ингибиторы ангиотензинпревращающего фермента, антагонисты кальция8. Все эти препараты метаболически нейтральны, а также благоприятно влияют на некоторые обменные процессы, например блокаторы рецепторов ангиотензина II – на углеводный обмен. Кстати, немаловажно, что блокаторы рецепторов ангиотензина II отлично переносятся, а частота побочных эффектов на фоне их приема сравнима с таковой плацебо. Кроме того, их можно назначать в комбинации с тиазидными диуретиками или антагонистами кальция.
Эволюционное развитие класса блокаторов рецепторов ангиотензина II привело к созданию препаратов с более выраженным пролонгированным эффектом, представителем которых является олмесартан (Кардосал). Кардосал имеет оптимальные фармакодинамические и фармакокинетические характеристики. Олмесартан – мощный специфический антагонист рецепторов ангиотензина II (типа АТ1). Предполагается, что олмесартан блокирует все эффекты ангиотензина II, опосредованные АТ1-рецепторами, независимо от источника и пути синтеза ангиотензина II. Прием Кардосала один раз в сутки обеспечивает эффективное и мягкое снижение артериального давления в течение 24 часов с защитой в «проблемные» утренние часы. Гипотензивное действие наступает, как правило, уже через две недели, а максимальный эффект развивается приблизительно через восемь недель после начала терапии. В целом ряде исследований было продемонстрировано церебропротективное действие олмесартана. Установлено, что олмесартан улучшает показатели мозговой гемодинамики при артериальной гипертензии и полностью восстанавливает скорость мозгового кровотока. Кроме того, было показано, что олмесартан положительно влияет на когнитивные функции за счет уменьшения накопления бета-амилоида в головном мозге (причины деменции)9.
Патогенетические нарушения, вызванные метаболическим синдромом, затрагивают почти все звенья сердечно-сосудистой системы, вызывая болезни крупных и мелких сосудов, крови, сердца, а также тромбофилию. По словам профессора О.Д. Остроумовой, именно болезнь мелких перфорирующих артерий и артериол, венул и капилляров, которые обеспечивают кровоснабжение глубоких структур головного мозга, лежит в основе тех изменений, которые можно наблюдать в рутинной практике. Среди главных структурных проявлений болезни мелких сосудов лакунарный инсульт, гиперинтенсивность белого вещества, микрокровоизлияния, расширение периваскулярных пространств Вихрова – Робена.
Центральное место в терапии болезни мелких сосудов занимают антиагреганты, которые влияют на микроциркуляторное русло и агрегацию тромбоцитов. Из антиагрегантов докладчик выделила дипиридамол (Курантил), который угнетает активацию и адгезию тромбоцитов, уменьшает тромбообразование, увеличивает уровень аденозина, подавляет фосфодиэстеразу в гладкомышечных клетках сосудистой стенки. Оказывая антиагрегантное, сосудорасширяющее, противовоспалительное и антиоксидантное действие, Курантил комплексно воздействует на разные точки микроциркуляторного патологического каскада10. Препарат показан к применению в составе комплексной терапии при нарушениях микроциркуляции любого генеза.
«Результаты целого ряда исследований позволяют говорить о том, что использование Курантила у пациентов с метаболическим синдромом и сердечно-сосудистыми заболеваниями способствует улучшению их состояния и предупреждает развитие серьезных осложнений», – констатировала профессор О.Д. Остроумова в заключение.
Церебральная микроангиопатия/болезнь мелких сосудов: исследования в России и за рубежом
Более подробно вопросы патогенеза болезни мелких сосудов, или церебральной микроангиопатии (ЦМА), рассмотрела руководитель третьего неврологического отделения Научного центра неврологии, д.м.н. Лариса Анатольевна ДОБРЫНИНА. Под ЦМА понимают синдромокомплекс клинических, нейровизуализационных и морфологических признаков, обусловленных поражением мелких церебральных сосудов. Уже к началу XXI в. стало очевидно, что патология мелких сосудов крайне гетерогенна, и в 2014 г. ведущий специалист в данной области L. Pantoni предложил патогенетическую классификацию ЦМА11:
- тип 1 – атеросклероз (возраст-зависимая и ассоциированная с сосудистыми факторами риска ЦМА);
- тип 2 – спорадическая и наследственная ЦМА;
- тип 3 – наследственная или генетическая ЦМА, отличная от церебральной амилоидной ангиопатии;
- тип 4 – воспалительная и иммуноопосредованная ЦМА;
- тип 5 – венозный коллагеноз;
- тип 6 – другие формы ЦМА.
Согласно тенденции, которая наметилась в последние годы, именно первый тип, который выраженно доминирует среди других форм, стали обозначать как ЦМА, или болезнь мелких сосудов.
Российские и зарубежные исследователи расходятся в видении роли артериальной гипертензии в развитии ЦМА. В нашей стране артериальная гипертензия считается причиной ангиоэнцефалопатии и чаще всего обозначается как гипертоническая дисциркуляторная энцефалопатия. За границей артериальная гипертензия признана ведущим, но не единственным фактором риска ЦМА.
Огромный вклад в изучение гипертонической ангиоэнцефалопатии внес Научный центр неврологии (ранее Научно-исследовательский институт неврологии). Его специалисты описали характерные ангиопатические изменения, главные из которых связаны с высокой проницаемостью сосудистой стенки, поражением соединительнотканной основы сосуда, что может стать причиной формирования аневризм – источника первичных кровоизлияний. Дальнейшие репаративные процессы могут приводить к склерозированию сосудов и зачастую атеросклерозу. Кроме того, были установлены очаговые и диффузные механизмы поражения головного мозга. Не менее интересны работы по экспериментальной патофизиологии. Было продемонстрировано, что главным механизмом повреждения мозга является первичное, не связанное с ишемией, нарушение проницаемости гематоэнцефалического барьера на протяжении всего микроциркуляторного русла. А повреждение сосудов инициирует срыв ауторегуляции, зависящий от степени прироста, а не от цифр артериального давления. В это же время были описаны ведущие нейровизуализационные проявления: лакунарные инфаркты, диффузные повреждения белого вещества/лейкоареоз, клинические симптомы ЦМА, связанные с артериальной гипертензией. Оказалось, что гемореологические нарушения могут быть причиной малых глубинных гипертонических инфарктов, а эндотелиальная дисфункция – наиболее ранний и универсальный фактор цереброваскулярного поражения, приводящий к потере артериальной эластичности, что в свою очередь признано предиктором прогрессирующего поражения головного мозга.
Таким образом, к концу XX в. в России сложилась цельная интерпретация гипертонической ангиоэнцефалопатии. Она была закреплена в качестве нозологии в классификации сосудистых болезней головного мозга, что стало, с одной стороны, огромным достижением отечественной науки, а с другой – фактором сдерживания дальнейшего изучения этого заболевания, поскольку концепция одной причины поражения мелких сосудов не предполагала иных причин и факторов риска. За рубежом, где использовался термин ЦМА, продолжился поиск факторов риска и механизмов на основе общности проявлений патологии. Велись исследования по уточнению возможного патоморфоза ЦМА, связанной с артериальной гипертензией, изучению неишемических механизмов повреждения головного мозга. Было показано, что прямая связь между тяжестью артериальной гипертензии и поражением мозга отсутствует. Значительное число случаев ЦМА протекает без повышения артериального давления, а диффузность белого вещества, будучи признаком поражения мелких сосудов, имеет место и у больных-нормотоников. Так был выделен главный принцип: артериальная гипертензия является ведущим фактором риска ЦМА, но не тождественна гипертонической ангиоэнцефалопатии12, 13.
В морфологических исследованиях были получены свидетельства гетерогенности факторов риска поражения мелких сосудов. G. Lammie продемонстрировал снижение роли артериальной гипертензии в развитии ЦМА до 69%, редкость фибриноидного некроза и четких милиарных аневризм, а также наличие лакунарных инфарктов с одинаковой частотой при артериальной гипертензии и без нее. Был сделан вывод о том, что у пациентов с артериальной гипертензией и без нее высокая проницаемость сосудистой стенки является универсальным механизмом повреждения микрососудов14. Примерно в то же время H. Tommimoto представил иммуногистохимические свидетельства нейровоспаления, связанного с активацией эндотелия, экстравазацией плазмы и клеток через гематоэнцефалический барьер, отеком и повреждением паренхимы, активацией периваскулярных макрофагов и микроглии15.
Главная сложность изучения ЦМА заключается в том, что прижизненная визуализация мелких сосудов невозможна. В настоящее время диагностирование ЦМА проводится по МРТ-признакам поражения паренхимы мозга, связанным с поражением мелких сосудов. В 2013 г. были опубликованы критерии исследования мелких сосудов при старении и нейродегенерации16. Первый критерий предусматривает наличие малых субкортикальных инфарктов в бассейне одной перфорирующей артериолы, не более 20 мм, клинические или МРТ-проявления которых указывают на развитие в течение последних недель. Субкортикальные инфаркты могут переходить в лакуны (полости, которые остались после субкортикального инфаркта в бассейне перфорирующей артерии или кровоизлияния), гиперинтенсивность белого вещества или исчезать.
Медикаментозное лечение ЦМА в первую очередь предполагает контроль сосудистых факторов риска в соответствии со стандартами17. Фармакотерапия когнитивных расстройств проводится ингибиторами ацетилхолинэстеразы, антагонистами NMDA-рецепторов, а также нейрометаболическими препаратами. Безусловно, важным этапом является назначение антиагрегантов и антикоагулянтов, поскольку ЦМА может проявляться и ишемическими, и геморрагическими осложнениями. В этой связи особенно привлекательным выглядит дипиридамол (Курантил) – препарат, который одновременно оказывает антиагрегантный противовоспалительный и антиоксидантный эффект, также демонстрирует метаболическую и нейропротективную активность, положительно влияя на неоангиогенез. «Иначе говоря, он воздействует на все механизмы, задействованные при ЦМА», – отметила Л.А. Добрынина в заключение.
Взгляд невролога на ведение пациентов с болезнью мелких сосудов на фоне метаболического синдрома: внимание на воспаление
По словам профессора кафедры неврологии Российского национального исследовательского медицинского университета им. Н.И. Пирогова, д.м.н. Марины Викторовны ПУТИЛИНОЙ, болезнь мелких сосудов – спорадическое состояние, которое включает в себя ряд патогенетически объединенных синдромов с различной клинической симптоматикой, представленных пятью основными типами. Их трудно дифференцировать на первом этапе, как трудно выявить и само латентное течение болезни мелких сосудов, особенно у больных молодого и среднего возраста без выраженных признаков сердечно-сосудистых заболеваний. По этой причине заболевания мелких сосудов нередко рассматривают отдельно по поражению сердца, почек и даже других органов.
На сегодняшний день именно клинические реалии заставляют по-другому посмотреть на эту проблему. Забывчивость и утомляемость у пациентов молодого возраста многие воспринимают как естественное следствие переутомления, а излишнюю жировую прослойку в области талии ассоциируют исключительно с недостатком физической нагрузки и неправильным питанием. Однако все эти симптомы, зачастую вместе с повышенным артериальным давлением и инсулинорезистентностью, могут быть признаками метаболического синдрома.
Согласно выводам экспертов Всемирной организации здравоохранения (2013), метаболический синдром – это комплекс состояний, в результате которых происходит изменение всех органов на фоне генетической предрасположенности и поведенческих факторов18. Следствием метаболического синдрома становятся артериальная гипертензия, дислипидемия, воспаление и усиленное тромбообразование. На современном этапе эту «предболезнь» можно лабораторно диагностировать с помощью показателей воспаления (интерлейкинов 1 и 6, фактора некроза опухоли альфа), которое играет существенную роль и в генезе болезни мелких сосудов, и в генезе метаболического синдрома. Дело в том, что практически всегда изменения мелких сосудов, кроме перфузии головного мозга, приводят к нарушению гематоэнцефалического барьера с миграцией протеинов через поврежденную сосудистую стенку и циркуляции межклеточной жидкости в периваскулярных пространствах, а также активации макрофагов с развитием местного воспаления.
В последние годы определены стандартизированные подходы к диагностике и интерпретации маркеров болезни мелких сосудов: множественных лакунарных инфарктов в глубинных отделах мозга, видимых расширений периваскулярных пространств (криблюр), диффузного поражения белого вещества (лейкоареоза), микроинфарктов, церебральных микрокровоизлияний, церебральной атрофии. Однако в связи с ростом распространенности новых факторов риска (антифосфолипидного синдрома, врожденных дисплазий, тромбофилии, последствий вирусной инфекции, длительного болевого синдрома) появилась необходимость в использовании более специфических маркеров болезни мелких сосудов. Учитывая одну из ведущих ролей в патогенезе болезни мелких сосудов эндотелиальной дисфункции и системного воспаления, рекомендуется определение C-реактивного белка и некоторых других показателей, например асимметричного диметиларгинина.
Симптомы болезни мелких сосудов выходят за рамки явных острых синдромов, она может проявляться депрессией, атаксией, падениями у пожилых людей, кратковременной потерей памяти, вегетативной дисфункцией. Кроме того, болезнь мелких сосудов – самая распространенная причина «немых» инсультов.
Клинические фенотипы болезни мелких сосудов головного мозга можно объединить в несколько групп, причем в одних случаях прослеживается прямая связь с изменениями артериального давления, что позволило ввести новый термин «гипертоническая болезнь мелких сосудов», в других случаях такая связь отсутствует. Первыми по значимости являются психопатологические фенотипы. Психопатологические синдромы (астенические расстройства, апатия, депрессия и нарушение исполнительной функции) могут обнаруживаться при самых разных расстройствах, даже у здоровых людей. В этой связи основным критерием для связи психопатологических синдромов и болезни мелких сосудов является нейровизуализационное подтверждение заболевания мелких сосудов. Вторые по значимости – наследственные заболевания, в генезе которых важную роль играет повреждение мелких сосудов: церебральная аутосомно-доминантная артериопатия с субкортикальными инфарктами и лейкоэнцефалопатией, церебральная аутосомно-рецессивная артериопатия с субкортикальными инфарктами и лейкоэнцефалопатией, болезнь Фабри, наследственная ангиопатия с нефропатией, аневризмами и мышечными спазмами, аутосомно-доминантная васкулопатия сетчатки с церебральной лейкодистрофией, ретинальная васкулопатия с церебральной лейкодистрофией.
Далее профессор М.В. Путилина акцентировала внимание на стратегии ведения пациентов с болезнью мелких сосудов, отметив такие направления лечения, как коррекция сопутствующих заболеваний, патогенетическое лечение и купирование симптомов.
В терапии болезни мелких сосудов особая роль отводится ингибиторам фосфодиэстеразы, которые используются для снижения сосудистого тонуса и пролиферации гладкой мускулатуры, подавления активности провоспалительных клеток, улучшения реологических свойств крови и восстановления чувствительности к нитратам19. Основным ингибитором фосфодиэстеразы клинического значения для инсульта считается дипиридамол – универсальный препарат для профилактики и лечения болезни мелких сосудов. Установлено, что применение Курантила (дипиридамола) статистически значимо повышает эффективность реабилитации пациентов после инсульта, улучшая степень восстановления их когнитивных функций20.
«Важно понимать, что включение дипиридамола в базовую схему лечения болезни мелких сосудов позволяет эффективно и безопасно воздействовать на системное воспаление, а также на когнитивный потенциал», – отметила профессор М.В. Путилина, завершая выступление.
Расширение возможностей антитромботической терапии
Научный сотрудник Научного центра неврологии, к.м.н. Антон Алексеевич РАСКУРАЖЕВ напомнил, что в основе всех типов ишемических нарушений мозгового кровообращения лежат разнонаправленные изменения гемореологии и гемостаза. При атеротромботическом инсульте происходят изменения противосвертывающей системы крови, а также выраженные изменения всех звеньев атромбогенной активности сосудистой стенки. При кардиоэмболическом инсульте обнаруживается гиперкоагуляция на фоне умеренных сдвигов гемореологических показателей в сочетании со снижением атромбогенных свойств сосудистой стенки. Эти фундаментальные научные данные позволяют осуществлять персонифицированный подход к лечению.
Следует отметить, что главной причиной ишемических нарушений мозгового кровообращения является атеросклероз и его наиболее грозное осложнение – атеротромбоз, который характеризуется внезапным разрушением бляшки и активацией тромбоцитарно-сосудистого гемостаза. Тромбоциты запускают образование тромба на поверхности поврежденной атеросклеротической бляшки, и эти изменения представляют собой потенциальную мишень антиагрегантной или антитромбоцитарной терапии.
Важнейшая цель антиагрегантной терапии – прекращение тромбообразования на стадии формирования тромбоцитарных агрегантов. Однако используемые в клинической практике антигрегантные препараты отличаются по механизму действия:
- ацетилсалициловая кислота блокирует циклооксигеназу, предотвращая образование тромбоксана А2;
- дипиридамол влияет на концентрацию циклических нуклеотидов, аденозиндифосфата, тромбина, арахидоновой кислоты;
- тиенопиридины (клопидогрел и тиклопидин) подавляют аденозиндифосфат-индуцированную агрегацию тромбоцитов;
- антагонисты и блокаторы гликопротеиновых рецепторов тромбоцитов IIb/IIIa (абциксимаб, эптифибатид и др.) воздействуют на конечный этап формирования тромбоцитарного агрегата.
По мнению экспертов Американской ассоциации сердца и Американской ассоциации инсульта, пациентам с некардиоэмболическим инсультом после транзиторной ишемической атаки/ишемического инсульта показано назначение ацетилсалициловой кислоты (50–325 мг/сут) в качестве стартовой терапии (класс I, уровень доказательности А) или комбинации ацетилсалициловой кислоты 25 мг и дипиридамола замедленного высвобождения 200 мг (два раза в сутки) в качестве вторичной профилактики нарушений мозгового кровообращения (класс I, уровень доказательности В)21. Данная рекомендация представляется особенно актуальной с учетом современных реалий клинической практики и обозначенной в современных руководствах необходимости индивидуализировать выбор антиагрегантных препаратов на основе профиля факторов риска пациента, стоимости и относительной эффективности препарата, а также других клинических характеристик.
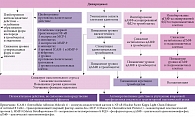
Почему, несмотря на доказанную эффективность первичной и вторичной профилактики различных нарушений мозгового кровообращения, сохраняется высокая частота сосудистых катастроф? В числе прочих причин одной из немаловажных считается резистентность к антиагрегантной терапии. Она может быть клинической (развитие на фоне приема антиагреганта атеротромботических событий) или лабораторной (недостаточное блокирование реактивности тромбоцитов, несмотря на продолжающееся использование антиагреганта). Установлено, что резистентность к ацетилсалициловой кислоте варьируется от 5 до 60%. Проведенные в Научном центре неврологии исследования также подтвердили высокую распространенность аспиринорезистентности, особенно среди пациентов с прогрессирующим атеросклерозом. Был идентифицирован один из факторов развития резистентности к терапии ацетилсалициловой кислотой, который связан с генетической мутацией А842G в гене циклооксигеназы 1. В этой связи возникает необходимость применения других препаратов, обеспечивающих защиту от нарушений на уровне микро- и макроциркуляторного русла. А.А. Раскуражев выделил дипиридамол – антиагрегант с вазодилатирующими свойствами, который хорошо зарекомендовал себя в клинической практике. Дипиридамол снижает агрегацию тромбоцитов за счет увеличения концентрации аденозина в плазме крови и ингибирования фосфодиэстераз тромбоцитов. Кроме того, дипиридамол обладает свойствами, не связанными непосредственно с антиагрегантным эффектом, которые проявляются в ослаблении влияния окислительного стресса, снижении уровня воспаления, улучшении функции эндотелия (рисунок)10.
В клиническом исследовании изучалась эффективность дипиридамола (Курантила) в дозах 75 и 225 мг/сут у пациентов с различными формами хронических цереброваскулярных заболеваний. Было подтверждено антиагрегантное действие Курантила в обеих дозах, однако Курантил в дозе 225 мг/сут был более эффективен по антиагрегационной активности у пациентов с большей длительностью сосудистого процесса и повторными нарушениями мозгового кровообращения. Полученные результаты позволяют рекомендовать длительный курс лечения Курантилом (более двух месяцев) при хронической цереброваскулярной патологии22, 23.
В исследованиях по оценке возможности применения Курантила у пациентов с сахарным диабетом и цереброваскулярными заболеваниями отмечалось улучшение агрегационных характеристик тромбоцитов, антиагрегационной активности эндотелия и деформируемости эритроцитов. На экспериментальной модели дипиридамол вызывал обратное развитие периферической ишемии и стимулировал ангиогенез, а также увеличивал биодоступность оксида азота. Способность дипиридамола улучшать функцию сосудов при ишемии и восстанавливать кровоток может быть полезна при заболеваниях периферических артерий. Кроме того, было показано, что дипиридамол усиливает синтез эндотелиального NO, что приводит к активации атерогенеза и улучшению перфузии при экспериментальной ишемии конечностей10, 23.
Важную роль в развитии и прогрессировании острых и хронических цереброваскулярных заболеваний играют нарушения микроциркуляторного русла. Одной из причин изменений реологических свойств крови и формирования протромбогенного потенциала являются миелопролиферативные заболевания, в частности тромбоцитемия и первичный миелофиброз. Повышенное количество форменных элементов крови и плазмы приводит к изменению их функциональных и морфологических характеристик и тромбозу магистральных артерий головы и сосудов. У больных наряду с тромботическими осложнениями миелопролиферации при развитии экстремально высокого уровня тромбоцитов в десять раз возрастает риск геморрагических осложнений. Дальнейший риск подобных осложнений существенно ограничивает прием традиционных антиагрегантных препаратов (ацетилсалициловой кислоты). В такой ситуации также возможно назначение дипиридамола (Курантила), который при лучшей переносимости продемонстрировал сопоставимый с ацетилсалициловой кислотой профиль влияния на гемореологические и гемостатические показатели, в частности на деформированность эритроцитов, агрегацию тромбоцитов у пациентов с миелопролиферативными заболеваниями24.
Подводя итог выступлению, А.А. Раскуражев уточнил, что расширение возможностей антитромботической терапии в большой степени связано со способностью находить в давно и хорошо известных препаратах новые свойства.
Заключение
Эксперты всесторонне рассмотрели вопросы, связанные с болезнью мелких сосудов, артериальной гипертензии как одной из ее причин у пациентов, страдающих метаболическим синдромом, что позволило по-новому взглянуть на возможности антиагрегантной терапии. В докладах отмечалось, что дипиридамол (Курантил) – универсальный препарат лечения болезни мелких сосудов. Согласно результатам исследований, Курантил комплексно воздействует на разные точки микроциркуляторного патологического каскада, демонстрируя антиоксидантную, противовоспалительную, антиагрегантную, метаболическую, нейропротекторную активность, положительно влияя на неоангиогенез. Применение Курантила у пациентов с дисциркуляторной энцефалопатией, болезнью мелких сосудов, артериальной гипертензией и метаболическим синдромом способствует улучшению их состояния, снижая выраженность клинических симптомов, уменьшая риск серьезных сердечно-сосудистых осложнений и нарушения когнитивных функций.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.