Современная базальная инсулинотерапия у пациентов с сахарным диабетом 2 типа и COVID-19 в амбулаторной практике
- Аннотация
- Статья
- Ссылки
- English
В инфекционных стационарах, как правило, используют человеческие инсулины, которые обладают высокой вариабельностью действия, что может сказаться на эффективности сахароснижающей терапии, способствует возникновению гипогликемических состояний и развитию сердечно-сосудистых событий. К сожалению, в условиях инфекционного стационара пациенты с сахарным диабетом 2 типа не всегда имеют возможность наблюдаться эндокринологом, а врачам другой специальности бывает сложно определиться с титрацией и коррекцией дозы инсулина. При этом особые трудности возникают с титрацией дозы базального инсулина.
Цель исследования – оценить эффективность использования в составе комбинированной сахароснижающей терапии базального аналога инсулина человека деглудек у пациентов с COVID-19 и сахарным диабетом 2 типа.
Материал и методы. На амбулаторном этапе наблюдались 18 больных COVID-19 и сахарным диабетом 2 типа. Восемь были выписаны из инфекционного отделения больницы, где им проводилась инсулинотерапия в базис-болюсном режиме. Десять пациентов с момента возникновения COVID-19 лечились только амбулаторно.
В составе комбинированной терапии использовали метформин и ингибитор натрий-глюкозного котранспортера 2, при необходимости – коррекционный инсулин аспарт.
Результаты. Установлена высокая эффективность инсулина деглудек в составе комбинированной терапии как у выписавшихся из инфекционного стационара, так и у лечившихся только амбулаторно. Во всех анализируемых случаях удалось добиться целевых показателей углеводного обмена без риска развития гипогликемий и увеличения массы тела. При этом не было зафиксировано ни одного сердечно-сосудистого события.
Все пациенты отметили психоэмоциональную устойчивость на фоне проводившегося лечения, удобство использования инсулина деглудек, возможность изменять время его введения, что позволяло вести привычный образ жизни.
В инфекционных стационарах, как правило, используют человеческие инсулины, которые обладают высокой вариабельностью действия, что может сказаться на эффективности сахароснижающей терапии, способствует возникновению гипогликемических состояний и развитию сердечно-сосудистых событий. К сожалению, в условиях инфекционного стационара пациенты с сахарным диабетом 2 типа не всегда имеют возможность наблюдаться эндокринологом, а врачам другой специальности бывает сложно определиться с титрацией и коррекцией дозы инсулина. При этом особые трудности возникают с титрацией дозы базального инсулина.
Цель исследования – оценить эффективность использования в составе комбинированной сахароснижающей терапии базального аналога инсулина человека деглудек у пациентов с COVID-19 и сахарным диабетом 2 типа.
Материал и методы. На амбулаторном этапе наблюдались 18 больных COVID-19 и сахарным диабетом 2 типа. Восемь были выписаны из инфекционного отделения больницы, где им проводилась инсулинотерапия в базис-болюсном режиме. Десять пациентов с момента возникновения COVID-19 лечились только амбулаторно.
В составе комбинированной терапии использовали метформин и ингибитор натрий-глюкозного котранспортера 2, при необходимости – коррекционный инсулин аспарт.
Результаты. Установлена высокая эффективность инсулина деглудек в составе комбинированной терапии как у выписавшихся из инфекционного стационара, так и у лечившихся только амбулаторно. Во всех анализируемых случаях удалось добиться целевых показателей углеводного обмена без риска развития гипогликемий и увеличения массы тела. При этом не было зафиксировано ни одного сердечно-сосудистого события.
Все пациенты отметили психоэмоциональную устойчивость на фоне проводившегося лечения, удобство использования инсулина деглудек, возможность изменять время его введения, что позволяло вести привычный образ жизни.
Введение
В марте 2020 г. эксперты Всемирной организации здравоохранения официально объявили о пандемии новой коронавирусной инфекции, вызванной SARS-CoV-2, – COVID-19.
Большинство инфицированных переносят болезнь в легкой и среднетяжелой форме.
На тяжесть течения и исходы COVID-19 существенно могут влиять некоторые сопутствующие или фоновые заболевания.
Наиболее уязвимыми в отношении развития COVID-19 и его более тяжелого течения признаны пациенты с артериальной гипертензией, ишемической болезнью сердца, сердечной недостаточностью, цереброваскулярными заболеваниями, хронической обструктивной болезнью легких, хронической болезнью почек и конечно же сахарным диабетом (СД) 2 типа.
Особое место в списке фоновых заболеваний отводится СД 2 типа, так как при COVID-19 углеводный обмен выходит из-под контроля, что приводит к прогрессированию метаболических нарушений и повышению риска развития диабетического кетоацидоза [1] со всеми вытекающими из этого последствиями [2]. Ассоциированные с СД 2 типа микрососудистые осложнения, в том числе нарушение микроциркуляции в легких, также могут быть причиной более высокого риска неблагоприятных исходов при COVID-19 [3]. Так, согласно зарубежным данным, у пациентов с сахарным диабетом по сравнению с лицами без диабета частота тяжелого течения COVID-19 и летальных исходов в 1,3–3,9 и 1,5–4,4 раза выше [4]. В России на апрель 2021 г. летальность среди рассматриваемой популяции составила 15,2% [5].
Причин декомпенсации углеводного обмена у больных СД 2 типа на фоне COVID-19 достаточно много – это и психоэмоциональное состояние, и особенности лечения COVID-19, в частности использование высоких доз контринсулиновых гормонов, и особенности иммунного статуса больных диабетом, и высокая активность вируса в условиях гипергликемии, ожирения и коморбидности. Поэтому крайне важно сохранить оптимальный контроль гликемии у таких больных, предупредить развитие кетоацидоза, в связи с чем в большинстве случаев приоритетным направлением лечения становится назначение инсулина [6].
У пациентов с СД 2 типа COVID-19 часто протекает в среднетяжелой и тяжелой формах, поэтому возникает необходимость стационарного лечения. Среднетяжелое и тяжелое течение COVID-19 также требует пересмотра привычной сахароснижающей терапии [4]. Согласно отечественным рекомендациям, в подобной ситуации следует отменить прием пероральных сахароснижающих препаратов, таких как метформин, производные сульфонилмочевины, ингибиторы дипептидилпептидазы 4 (ДПП-4) и натрий-глюкозного котранспортера 2 (НГЛТ-2), агонисты рецепторов глюкагоноподобного пептида 1. В большинстве случаев гликемия превышает 15–20 ммоль/л, имеет место клиника декомпенсации углеводного обмена (жажда, полиурия) и требуется назначение инсулинотерапии, в том числе в базис-болюсном режиме [4]. Следует подчеркнуть, что инсулин должен рассматриваться не только как сахароснижающее средство, поскольку способен оказывать противовоспалительное действие наряду с кортикостероидами, обладает антитромботическим и профибринолитическим эффектами, что потенциально может обеспечить мощное подавление последствий COVID-19 [7].
К сожалению, в условиях инфекционного стационара такие пациенты не всегда имеют возможность эффективно наблюдаться эндокринологом, а врачам другой специализации бывает сложно разобраться со стратегией инсулинотерапии и правильной титрацией дозы инсулина. Преимущественное использование в подобных ситуациях человеческих инсулинов с высокой вариабельностью действия, риском гипогликемических состояний определяет нестабильность гликемии, что в свою очередь существенно влияет на эффективность сахароснижающей терапии и увеличение риска госпитальной смертности [2].
Особенно трудно бывает выбрать стратегию использования и титрации дозы человеческих базальных инсулинов.
Из-за сложностей проведения инсулинотерапии в условиях инфекционного стационара перед выпиской на амбулаторное лечение пациенты с СД 2 типа нередко оказываются в состоянии хронической передозировки инсулином, проявляющейся гипогликемическими состояниями, нестабильной гликемией, увеличением массы тела, что приводит к повышению риска развития сердечно-сосудистых осложнений. Именно поэтому принципиально важно проводить коррекцию сахароснижающей терапии перед или сразу после выписки из больницы с включением в схему комбинированной терапии современных базальных инсулинов с низкой вариабельностью действия и дать рекомендации пациенту для осуществления правильного самоконтроля.
Пациенты с СД 2 типа и нетяжелым течением COVID-19 могут получать лечение в амбулаторных условиях. Однако в силу перечисленных ранее причин им также может потребоваться инсулинотерапия, в том числе в базис-болюсном режиме.
Цель исследования
Целью настоящего исследования стал анализ возможностей современного базального инсулина сверхдлительного действия деглудек в составе комбинированной сахароснижающей терапии на амбулаторном этапе лечения пациентов с СД 2 типа и COVID-19.
Материал и методы
Под наблюдением находилось 18 пациентов с СД 2 типа. Степень тяжести COVID-19 у них определена как средняя: температура тела – выше 38 °С, число дыхательных движений в минуту – более 22, одышка при нагрузке, пневмония, подтвержденная результатами компьютерной томографии, сатурация кислорода (SрО2) – менее 95%.
В исследуемую группу входило восемь женщин и десять мужчин в возрасте от 65 до 75 лет.
Стаж диабета – от трех до семи лет.
До заболевания COVID-19 никто из пациентов не получал инсулин. Им проводилась комбинированная сахароснижающая терапия метформином (1000–2000 мг/сут) в сочетании с гликлазидом (девять пациентов), или ингибитором ДПП-4 (четыре пациента), или ингибитором НГЛТ-2 (пять пациентов). На фоне указанного лечения целевые значения углеводного обмена достигнуты не были, однако признаков выраженной декомпенсации (жажды, полиурии, снижения массы тела) не отмечалось.
На момент начала исследования тяжелых сердечно-сосудистых событий (инфаркт, инсульт и др.) у больных не зафиксировано.
Все пациенты находились на амбулаторном этапе лечения COVID-19 и были разделены на две группы. Первая группа состояла из восьми больных, которые были выписаны из инфекционного отделения больницы, где им проводилась инсулинотерапия в базис-болюсном режиме, вторая – из десяти пациентов, у которых лечение COVID-19 с момента возникновения проходило амбулаторно.
Медицинский контроль эндокринологом осуществлялся ежедневно (иногда несколько раз в день) по телефону, при необходимости врач посещал пациента на дому.
Включенные в первую группу, как правило, имели нестабильную гликемию, большинство (60%) из них отмечали гипогликемические состояния, увеличение массы тела. С начала амбулаторного наблюдения больным была проведена коррекция инсулинотерапии: вместо человеческих инсулинов назначен базальный аналог инсулина человека сверхдлительного действия деглудек в комбинации с аналогом инсулина человека ультракороткого действия аспарт.
Выбор базального аналога инсулина деглудек обусловлен тем, что это единственный в своем роде базальный аналог инсулина человека сверхдлительного действия, который характеризуется наименьшей вариабельностью действия по сравнению с другими базальными инсулинами [8, 9], меньшим риском гипогликемических состояний, особенно ночных [10, 11], в том числе при комбинировании с пероральными сахароснижающими препаратами [12]. Указанные преимущества инсулина деглудек подтвердились и в исследованиях, проведенных в условиях реальной клинической практики [11, 13]. В ряде исследований на фоне терапии инсулином деглудек пациенты отмечали улучшение психологического и физического состояния [14, 15], качества жизни [16]. Кроме того, больные указывали на удобство использования этого инсулина в повседневной жизни [15].
Доза инсулина деглудек определялась исходя из клинической ситуации: если имели место признаки передозировки инсулина (повышенный аппетит, гипогликемические состояния, повышение массы тела), стартовая доза уменьшалась на 25% по отношению к дозе базального человеческого инсулина. В отсутствие признаков передозировки инсулина доза деглудека соответствовала дозе базального человеческого инсулина. Титрация дозы инсулина деглудек проводилась каждые четыре-пять дней по результатам самоконтроля.
Доза инсулина аспарт определялась индивидуально в зависимости от особенностей питания пациента в домашних условиях, количества потребляемых хлебных единиц.
При исчезновении симптомов дыхательной недостаточности, при SрО2 более 95% болюсные инъекции инсулина аспарт отменялись, в состав комбинированной терапии возвращались меформин в дозе 2000 мг/сут и ингибитор НГЛТ-2.
Решение о как можно более быстром возвращении к лечению метформином основывалось на последних данных о преимуществах препарата при эпидемии COVID-19 [6, 17]. Так, метаанализ 17 исследований с участием 20 719 пациентов с COVID-19 и СД показал, что применение метформина было связано со значительным снижением тяжести течения патологии и частоты смертей [18].
Включение в состав комбинированной сахароснижающей терапии ингибитора НГЛТ-2 обусловлено его потенциальными противовоспалительными [6], кардио- и нефропротективными свойствами [19], а также возможностью использовать одновременно с инсулином ультракороткого действия [20].
Во второй группе коррекция сахароснижающей терапии проводилась с момента выявления COVID-19. У всех пациентов был отменен прием пероральных сахароснижающих препаратов и назначена базис-болюсная инсулинотерапия, включавшая аналог инсулина человека сверхдлительного действия деглудек и аналог инсулина человека ультракороткого действия аспарт. Общая суточная доза инсулина определялась индивидуально на основании оценки гликемии и массы тела больного. Стартовая доза инсулина деглудек составляла от 12 до 16 ЕД п/к вечером. Титрация дозы деглудека проводилась каждые четыре-пять дней исходя из результатов самоконтроля. Доза инсулина аспарт также определялась индивидуально и зависела от особенностей питания, количества потребляемых хлебных единиц, уровня гликемии. При необходимости с коррекционной целью дополнительно выполнялись инъекции инсулина аспарт в дозе 4–6 ЕД между приемами пищи.
В обеих группах установлен целевой уровень гликированного гемоглобина (HbA1c) менее 7%, глюкозы в крови натощак ниже 7 ммоль/л, постпрандиальной глюкозы в крови ниже 9 ммоль/л.
Лечение COVID-19 проводилось соответствующими специалистами, его коррекция нами не осуществлялась.
Длительность наблюдения за пациентами обеих групп составила шесть месяцев.
Результаты
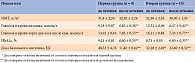
Согласно полученным результатам, эффективность инсулина деглудек в составе комбинированной сахароснижающей терапии на амбулаторном этапе лечения пациентов с СД 2 типа и COVID-19 была высокой (таблица). Кроме того, на фоне выздоровления наблюдалась динамика суточной дозы инсулина деглудек в сторону уменьшения.
Так, до начала исследования обе группы имели сопоставимые показатели индекса массы тела (ИМТ), глюкозы в крови натощак и через два часа после еды, HbA1c. Однако доза базального инсулина в первой группе была достоверно выше. Это могло быть связано с использованием на стационарном этапе как человеческих инсулинов с высокой вариабельностью действия, что создавало определенные сложности с титрацией доз базальных инсулинов, так и более высоких доз кортикостероидов. Во второй группе с самого начала возникновения COVID-19 стали применять инсулин деглудек, титрация дозы проводилась опытными эндокринологами.
Через шесть месяцев наблюдения ИМТ в обеих группах достоверно не изменился. Кроме того, у всех пациентов на фоне излечения от COVID-19 удалось добиться существенного снижения средних значений глюкозы в крови как натощак, так и через два часа после приема пищи, а также HbA1c. Значительно уменьшилась доза инсулина деглудек.
На фоне проводившейся терапии в 100% случаев были достигнуты целевые показатели углеводного обмена без риска развития гипогликемий, увеличения массы тела.
Немаловажно, что за весь период исследования не было зафиксировано ни одного сердечно-сосудистого события.
Следует обратить внимание, что титрация дозы инсулина деглудек в первой группе отличалась от титрации дозы во второй группе. В частности, в первой группе по мере выздоровления и возвращения пациентов к привычному образу жизни потребность в инсулинотерапии постепенно уменьшалась. В первые одну-две недели после выписки из стационара происходила нормализация уровня SрО2 (> 95%), отменялся инсулин аспарт (болюсный и коррекционный) и к продолжавшейся терапии инсулином деглудек в схему лечения добавлялись метформин в дозе 2000 мг/сут и дапаглифлозин в дозе 10 мг/сут. В дальнейшем каждые пять – семь дней на основании данных самоконтроля доза инсулина деглудек сокращалась на 2 ЕД, и в течение 8–12 недель она достигла минимальных значений – 10–12 ЕД/сут. В двух случаях удалось полностью отменить инсулин деглудек, при этом целевые показатели глюкозы в крови сохранились. В двух случаях пациенты отказались от отмены инсулина, аргументируя это тем, что до COVID-19 показатели гликемии были хуже. Кроме того, введение инсулина деглудек в режиме один раз в день не вызывало у них каких-либо сложностей или неудобств. Остальные пациенты продолжали инъекции инсулина деглудек в минимальной дозе (10–12 ЕД/сут).
В качестве примера приведем клинический случай пациента К., 68 лет.
Диагноз: сахарный диабет 2 типа, целевой уровень HbA1c < 7%.
Сопутствующие заболевания: гипертоническая болезнь второй стадии, компенсированная артериальная гипертензия, риск 4, хроническая сердечная недостаточность 0.
Из анамнеза: СД 2 типа диагностирован четыре года назад. В течение трех лет коррекция углеводного обмена проводилась с помощью низкокалорийной диеты, дозированной физической активности, а также с помощью метформина в дозе 2000 мг/сут и дапаглифлозина в дозе 10 мг/сут утром. В основном сахароснижающая терапия поддерживала целевые значения глюкозы в крови натощак (< 7 ммоль/л) и через два часа после приема пищи (< 9 ммоль/л), однако при погрешностях в питании постпрандиальная гликемия повышалась до 10–12 ммоль/л.
Уровень HbA1c в июне 2020 г. составлял 7,3%.
В сентябре и октябре 2020 г. в течение 39 дней больной находился на лечении в инфекционном отделении областной клинической больницы № 1 Ростовской области по поводу COVID-19.
Диагностирован COVID-19 средней степени тяжести: максимальная температура тела – 38,6 °С, SрО2 – 84%, одышка при физической нагрузке.
На фоне психоэмоционального стресса, высоких доз кортикостероидов глюкоза в крови достигала 15–25 ммоль/л, беспокоили сухость во рту, жажда. Коррекция углеводного обмена проводилась человеческими инсулинами, вводимыми в базис-болюсном режиме. Максимальная доза базального человеческого инсулина – 48 ЕД/сут, болюсного – 38 ЕД. Пациент отмечал повышенный аппетит, колебания глюкозы в крови от 8 до 18 ммоль/л.
Перед выпиской из стационара фиксировали гипогликемические состояния, в том числе ночью.
Доза базального инсулина была снижена до 36 ЕД/сут в двух инъекциях, доза инсулина аспарт – до 26 ЕД/сут.
Рост больного – 176 см, масса тела – 87 кг.
После выписки из стационара проведена коррекция сахароснижающей терапии: вместо человеческих инсулинов назначены инсулины деглудек и аспарт в базис-болюсном режиме. Учитывая клинические признаки передозировки инсулина, дозу инсулина деглудек уменьшили на 25% от дозы базального человеческого инсулина – до 26 ЕД/сут. Инсулин вводили п/к вечером. Доза инсулина аспарт с учетом особенностей питания пациента составила 28 ЕД/сут.
Показатели глюкозы в крови натощак и через два часа после еды соответствовали целевым значениям.
Через десять дней на фоне прекращения одышки, нормализации SрО2 (96%) принято решение об отмене инсулина аспарт и добавлении к инсулину деглудек метформина в дозе 2000 мг/сут и дапаглифлозина в дозе 10 мг/сут утром.
В дальнейшем каждые пять – семь дней доза инсулина деглудек уменьшалась на 2 ЕД и в течение полутора месяцев достигла минимальной (10 ЕД/сут п/к вечером).
Показатели гликемии соответствовали целевым. Уровень глюкозы в крови натощак снизился до 6,0–6,5 ммоль/л, постпрандиальной – менее 8 ммоль/л. От предложения отменить инсулин деглудек пациент отказался, ссылаясь на хорошие показатели гликемии и возможность иногда нарушать рекомендации по диете, а также на отсутствие каких-либо трудностей с введением препарата и влияния лечения на привычный образ жизни.
Во второй группе с учетом средней тяжести течения COVID-19, одышки, уровня SрО2 менее 95% и высоких показателей глюкозы в крови как натощак, так и через два часа после приема пищи сразу было принято решение об отмене пероральных сахароснижающих препаратов и назначении для коррекции нарушений углеводного обмена базис-болюсного режима инсулинотерапии с использованием аналога инсулина человека сверхдлительного действия деглудек и аналога инсулина человека ультракороткого действия аспарт. Следует отметить, что все пациенты второй группы были с сохранными когнитивными функциями, хорошо ориентированы в вопросах инсулинотерапии и имели возможность круглосуточного контроля со стороны родственников.
Стартовая доза инсулина деглудек в среднем составляла 12–16 ЕД/сут п/к вечером, максимальная доза не превышала 36 ЕД/сут. Во второй группе доза инсулина деглудек на первом этапе лечения COVID-19 возрастала. Доза инсулина деглудек увеличивалась каждые четыре-пять дней на 2–4 ЕД в зависимости от уровня гликемии. Доза инсулина аспарт изменялась ежедневно в зависимости от показателей гликемии, количества съедаемых хлебных единиц. Иногда, особенно в первые дни лечения COVID-19, инсулин аспарт вводился и как коррекционный препарат один-два раза в день между приемами пищи в дозе 4–6 ЕД с учетом гликемии.
В дни активного течения COVID-19 с помощью инсулинов деглудек и аспарт удавалось поддерживать суточный уровень глюкозы в крови ниже 10 ммоль/л.
Через 10–12 дней добились стабилизации течения COVID-19 и показателей глюкозы в крови, однако базис-болюсный режим инсулинотерапии продолжался до трех-четырех недель.
На втором этапе лечения пациентов второй группы на фоне стабилизации клинической картины COVID-19, нормализации уровня SрО2 потребность в инсулине стала уменьшаться. Сначала отменили инсулин аспарт (коррекционный и болюсный) и к продолжавшейся терапии инсулином деглудек снова были назначены метформин в дозе 2000 мг/сут и дапаглифлозин в дозе 10 мг/сут утром.
По мере выздоровления потребность в инсулине продолжала снижаться. Каждые пять – семь дней доза инсулина деглудек уменьшалась на 2 ЕД и в течение 8–12 недель достигла минимальной (10–12 ЕД п/к вечером). При этом уровень глюкозы в крови натощак составлял менее 7 ммоль/л, глюкозы в крови через два часа после еды – менее 9 ммоль/л. За период наблюдения не было зафиксировано ни одного случая гипогликемии, существенного увеличения массы тела.
У одного больного удалось полностью отменить инсулин деглудек, остальные продолжили его применение в дозе 10–12 ЕД/сут вечером.
Во второй группе наблюдалось существенное улучшение показателей гликемии по сравнению с доковидным периодом.
Все пациенты отмечали удобство использования инсулина деглудек, возможность изменять время инъекции, что позволяло вести привычный образ жизни.
Далее более подробно рассмотрим клинический случай одного из пациентов второй группы.
Пациент С., 73 лет. Диагноз: сахарный диабет 2 типа, целевой уровень HbA1c < 7%.
Из анамнеза: наблюдался по поводу СД 2 типа в течение семи лет. С целью коррекции углеводного обмена принимал метформин в дозе 1000 мг/сут и гликлазид модифицированного высвобождения. Однако целевые значения HbA1c так и не были достигнуты. Глюкоза в крови натощак составляла 7,5–8,0 ммоль/л. Уровень глюкозы в крови через два часа после еды контролировал редко.
Больной соблюдал низкокалорийную диету, был физически активен, дозированно занимался спортом.
Уровень HbA1c в апреле 2021 г. – 8,3%.
В июле 2021 г. заболел COVID-19 средней степени тяжести: температура тела – 39 °С, одышка при небольшой физической нагрузке, уровень SрО2 – 85%. Появилось ощущение жажды, глюкоза в крови натощак повысилась до 15 ммоль/л, глюкоза в крови через два часа после еды – более 20 ммоль/л.
С учетом степени тяжести COVID-19, выраженной декомпенсации углеводного обмена принято решение отменить метформин и гликлазид, назначить в базис-болюсном режиме инсулин деглудек в сочетании с инсулином аспарт. Стартовая доза инсулина деглудек составила 12 ЕД п/к вечером, инсулина аспарт – 6–8 ЕД перед основными приемами пищи, при необходимости с коррекционной целью и между приемами пищи – 4–6 ЕД. Титрация дозы инсулина деглудек проводилась каждые четыре-пять дней и увеличивалась на 2–4 ЕД. Доза инсулина аспарт титровалась ежедневно на основании показателей гликемии, чтобы поддерживать в течение суток уровень глюкозы в крови менее 10 ммоль/л.
За две недели удалось стабилизировать клинические проявления COVID-19 и уровень глюкозы в крови.
Максимальная доза инсулина деглудек составила 24 ЕД/сут п/к вечером, инсулина аспарт – 20–22 ЕД/сут перед основными приемами пищи. Иногда с целью коррекции глюкозы в крови больному дополнительно вводили инсулин аспарт 4–6 ЕД один-два раза в день между приемами пищи.
В течение последующих двух недель постепенно нормализовалась температура тела, уменьшилась одышка, улучшились показатели SрО2.
На этом фоне стала уменьшаться потребность в инсулине: исчезла необходимость во введении инсулина аспарт между приемами пищи, доза инсулина аспарт перед приемами пищи снизилась до 4–6 ЕД.
Проведенное лечение способствовало достижению и поддержанию целевого уровня глюкозы в крови. Так, значения глюкозы в крови натощак снизились менее 7 ммоль/л, постпрандиальной глюкозы – менее 9 ммоль/л.
После нормализации SрО2 отменен прандиальный инсулин аспарт и к продолженной терапии инсулином деглудек назначены метформин в дозе 2000 мг/сут и дапаглифлозин в дозе 10 мг утром.
В дальнейшем на фоне регрессии клинических проявлений COVID-19, уменьшения дозы кортикостероидов потребность в инсулине деглудек стала уменьшаться. Это позволило каждые пять – семь дней снижать дозу на 2 ЕД. Через шесть недель она достигла минимальных значений – 10 ЕД/сут п/к вечером.
Пациент наблюдался на протяжении шести месяцев. Общее состояние было хорошим. Глюкоза в крови соответствовала целевым значениям, масса тела не увеличилась, гипогликемические состояния не развивались.
Заключение
Результаты проведенного исследования свидетельствуют, что базальный аналог инсулина человека сверхдлительного действия деглудек эффективен при амбулаторном лечении пациентов с СД 2 типа и COVID-19 средней степени тяжести, в том числе выписанных из инфекционного стационара.
У всех больных удалось добиться целевых показателей углеводного обмена и регрессии клинических проявлений COVID-19 без повышения риска развития сердечно-сосудистых событий. Необходимо подчеркнуть, что при использовании инсулина деглудек требовалась сравнительно небольшая доза (в нашем исследовании максимальная доза препарата составляла 36 ЕД). Как следствие, не было зафиксировано ни одного эпизода гипогликемии, увеличения массы тела. Кроме того, терапия инсулином деглудек способствовала повышению психоэмоциональной стабильности пациентов.
Больные также отмечали удобство использования инсулина деглудек, возможность маневрировать временем выполнения инъекции, что в свою очередь позволяло вести привычный образ жизни.
V.I. Kudinov, PhD, E.V. Salaichuk, M.S. Lankinа, PhD, E.V. Pashchenko, PhD
Rostov State Medical University
Rostov Regional Clinical Hospital
Contact person: Vladimir I. Kudinov, endo-kudinov@mail.ru
Type 2 diabetes mellitus can significantly affect the course and outcome of COVID-19, since carbohydrate metabolism is significantly out of control and insulin therapy may be required both in hospital and outpatient treatment.
In the conditions of infectious hospitals, more often human insulins are used, which have a high variability of action, which significantly reduces the effectiveness of antihyperglycemic therapy, contributes to the occurrence of hypoglycemic conditions, the development of cardiovascular events. Unfortunately, in the conditions of an infectious hospital, patients with type 2 diabetes mellitus do not always have the opportunity to be effectively monitored by an endocrinologist, and it can be difficult for doctors of another specialty to determine the titration and correction of insulin therapy. At the same time, it is especially difficult to determine the titration of the dose of basal insulin.
The objective of this study is to evaluate the effectiveness of the use of the basal analogue of human insulin degludec in combination with COVID-19 and type 2 diabetes mellitus as part of combined antihyperglycemic therapy.
Material and methods. At the outpatient stage, we observed 18 patients with COVID-19 in combination with type 2 diabetes mellitus, 8 were realized from the infectious department, where insulin therapy was carried out in the basal-bolus regimen, 10 patients were treated on an outpatient since the onset of COVID-19.
As part of the combination therapy, metformin and inhibitor sodium-dependent glucose cotransporters 2 were used, if necessary, insulin aspart was administered for correction.
Results. The results of the study showed high efficacy of insulin degludec as part of combination therapy both after realized from an infectious hospital and in the treatment of COVID-19 at the outpatient stage. In all the analyzed cases, it was possible to achieve the glycemic targets without the risk of hypoglycemia, weight gain, and not a single cardiovascular event was recorded.
All patients noted psychoemotional stability, the convenience of using insulin degludec, flexibility of dosing time, to lead a normal routine daily life.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.