Вариабельность ритма сердца и артериального давления при разных вариантах инсулинотерапии у пациентов с сахарным диабетом 2 типа и ишемической болезнью сердца
- Аннотация
- Статья
- Ссылки
- English
Аналоги инсулина человека характеризуются низким риском развития гипогликемий и, возможно, меньшим риском развития и прогрессирования автономной нейропатии. В связи с этим особый интерес может представлять первый и единственный на сегодняшний день комбинированный препарат аналогов инсулина человека – инсулина деглудек и инсулина аспарт.
Цель исследования – сравнить изменение вариабельности сердечного ритма и артериального давления у пациентов с сахарным диабетом 2 типа и ишемической болезнью сердца на фоне использования фиксированной комбинации инсулина деглудек и инсулина аспарт и человеческих генно-инженерных инсулинов в базис-болюсном режиме.
Материал и методы. Обследовано 56 пациентов с сахарным диабетом 2 типа и ишемической болезнью сердца, у которых имела место нарушенная вариабельность ритма сердца и артериального давления при нормальных значениях классических кардиоваскулярных тестов.
Первую группу составили 27 больных, продолживших получать в базис-болюсном режиме человеческие генно-инженерные инсулины, вторую группу – 29 человек, переведенных на комбинацию инсулина деглудек и инсулина аспарт. Режим применения комбинации инсулинов – перед завтраком и ужином, инсулина аспарт – перед обедом.
Для больных обеих групп были разработаны индивидуальные режимы питания и физической активности, назначен метформин в дозе 1700–2500 мг/сут.
Через 24 недели анализировали показатели углеводного обмена, инсулинорезистентность, частоту гипогликемических состояний, массу тела, а также вариабельность ритма сердца и артериального давления по данным холтеровского мониторирования электрокардиографии и суточного мониторирования артериального давления.
Результаты. Применение комбинации инсулина деглудек и инсулина аспарт способствовало уменьшению уровня гликированного гемоглобина на 1,4%. При этом 68,9% пациентов достигли его целевого значения при минимальном риске развития гипогликемических состояний. Кроме того, улучшились показатели вариабельности сердечного ритма и артериального давления.
Аналоги инсулина человека характеризуются низким риском развития гипогликемий и, возможно, меньшим риском развития и прогрессирования автономной нейропатии. В связи с этим особый интерес может представлять первый и единственный на сегодняшний день комбинированный препарат аналогов инсулина человека – инсулина деглудек и инсулина аспарт.
Цель исследования – сравнить изменение вариабельности сердечного ритма и артериального давления у пациентов с сахарным диабетом 2 типа и ишемической болезнью сердца на фоне использования фиксированной комбинации инсулина деглудек и инсулина аспарт и человеческих генно-инженерных инсулинов в базис-болюсном режиме.
Материал и методы. Обследовано 56 пациентов с сахарным диабетом 2 типа и ишемической болезнью сердца, у которых имела место нарушенная вариабельность ритма сердца и артериального давления при нормальных значениях классических кардиоваскулярных тестов.
Первую группу составили 27 больных, продолживших получать в базис-болюсном режиме человеческие генно-инженерные инсулины, вторую группу – 29 человек, переведенных на комбинацию инсулина деглудек и инсулина аспарт. Режим применения комбинации инсулинов – перед завтраком и ужином, инсулина аспарт – перед обедом.
Для больных обеих групп были разработаны индивидуальные режимы питания и физической активности, назначен метформин в дозе 1700–2500 мг/сут.
Через 24 недели анализировали показатели углеводного обмена, инсулинорезистентность, частоту гипогликемических состояний, массу тела, а также вариабельность ритма сердца и артериального давления по данным холтеровского мониторирования электрокардиографии и суточного мониторирования артериального давления.
Результаты. Применение комбинации инсулина деглудек и инсулина аспарт способствовало уменьшению уровня гликированного гемоглобина на 1,4%. При этом 68,9% пациентов достигли его целевого значения при минимальном риске развития гипогликемических состояний. Кроме того, улучшились показатели вариабельности сердечного ритма и артериального давления.




Введение
Несмотря на появление новых пероральных сахароснижающих препаратов, количество пациентов с сахарным диабетом (СД) 2 типа, достигающих целевых показателей гликированного гемоглобина (HbA1c), существенно не увеличивается. Так, только 50% достигают уровня HbA1c менее 7% [1]. Как следствие, прогрессирование дисфункции β-клеток островков Лангерганса, необходимость перевода на инсулинотерапию, повышение частоты случаев развития ишемической болезни сердца (ИБС) [2].
Поражение сердечно-сосудистой системы у больных СД 2 типа реализуется за счет различных механизмов, среди которых одним из наиболее серьезных признано прогрессирование нарушений функции вегетативной нервной системы с развитием кардиоваскулярной автономной нейропатии (КАН).
Кардиоваскулярная автономная нейропатия является независимым фактором риска прогрессирования сердечно-сосудистых осложнений у пациентов с СД 2 типа и ассоциируется с пятикратным увеличением риска смерти [3].
Некоторые авторы указывают на то, что КАН может встречаться у 25% больных СД 2 типа [4]. Согласно нашим данным, при наличии клинических проявлений ИБС ее распространенность увеличивается до 43% [5].
Для выявления КАН в клинической практике используют кардиоваскулярные тесты по D. Ewing (1975 г.), так называемые классические кардиоваскулярные тесты. Однако этот метод характеризуется невысокой чувствительностью и специфичностью. Он позволяет диагностировать КАН только при наличии явных признаков. Для диагностики КАН на ранней, доклинической стадии целесообразна оценка вариабельности ритма сердца (ВРС) и вариабельности артериального давления (ВАД) с использованием холтеровского мониторирования электрокардиографии (ХМЭКГ) и суточного мониторирования АД (СМАД) [1].
С целью коррекции нарушений углеводного обмена таким коморбидным больным часто требуется назначение инсулинотерапии в базис-болюсном режиме. В практическом здравоохранении в подобных случаях чаще используют человеческие генно-инженерные инсулины (инсулины растворимые и изофан-инсулины), для которых характерны выраженная вариабельность действия, значительные интра- и межиндивидуальные различия в фармакодинамике, что обусловливает высокий риск возникновения гипогликемических состояний и невозможность достижения стойкой и постоянной концентрации инсулина в плазме, аналогичной физиологической [6, 7]. В результате создаются условия для возникновения и прогрессирования изменений вегетативной нервной системы и увеличивается риск сердечно-сосудистых событий [8].
В этой связи особый интерес представляют аналоги инсулина человека, у которых в отличие от человеческих генно-инженерных инсулинов более низкая вариабельность действия и соответственно меньше риск возникновения гипогликемических состояний и, возможно, развития и прогрессирования изменений вегетативной нервной системы. Фармакодинамика аналогов человеческого инсулина позволяет моделировать профиль выработки инсулина, максимально приближенный к физиологическому режиму, то есть так, как это происходит в здоровом организме. Кроме того, аналоги человеческого инсулина не имеют ограничений для применения по возрасту больных, клинической ситуации. Их можно назначать коморбидным пациентам с сердечно-сосудистой патологией [9, 10].
Особый интерес представляет комбинация инсулина деглудек и инсулина аспарт (ИДегАсп) (компания «Ново Нордиск», Дания). Это первый и единственный комбинированный препарат инсулинов, содержащий в одной шприц-ручке 70% инсулина сверхдлительного действия деглудек и 30% инсулина ультракороткого действия аспарт и обеспечивающий потребность как в базальном, так и в прандиальном инсулине [11].
В доступной нам литературе не обнаружено исследований влияния аналогов человеческого инсулина, в том числе ИДегАсп, на функциональное состояние вегетативной нервной системы, нарушенные ВРС и ВАД, что позволило бы оценить возможность их использования для предупреждения прогрессирования КАН у больных с СД 2 типа.
Цель исследования
Целью настоящего исследования стал анализ динамики ВРС и ВАД по результатам ХМЭКГ и СМАД у больных СД 2 типа и ИБС, получавших ИДегАсп для предупреждения прогрессирования КАН.
Материал и методы
Исследование выполнено на базе Ростовской областной клинической больницы (ГБУ РО «РОКБ»).
Для реализации поставленной цели обследовано 56 пациентов с СД 2 типа и ИБС, находившихся на лечении в кардиологическом отделении ГБУ РО «РОКБ».
Во время пребывания в стационаре все пациенты получали инсулинотерапию в базис-болюсном режиме. Для этого использовали генно-инженерные препараты инсулина (растворимый и изофан-инсулин человеческий).
У всех пациентов имели место нарушения ВРС и ВАД: циркадный индекс (ЦИ) < 1,24, вариабельность систолического АД в дневные (САДд) и ночные (САДн) часы – более 15 мм рт. ст., вариабельность диастолического АД в дневные (ДАДд) и ночные (ДАДн) часы – более 14 и 12 мм рт. ст. соответственно, сумма баллов по классическим кардиоваскулярным тестам – менее 4,0. Последнее свидетельствовало об отсутствии клинической стадии КАН.
Больные были сопоставимы по возрасту (61,4 ± 0,8 года), длительности СД 2 типа (12,8 ± 3,5 года) и длительности ИБС (11,6 ± 3,1 года).
Все включенные в исследование получали лечение по поводу ИБС: статины, ацетилсалициловая кислота, ингибиторы ангиотензинпревращающего фермента или антагонисты рецепторов ангиотензина II, селективные β-адреноблокаторы, дигидропиридиновые блокаторы медленных кальциевых каналов. При этом в течение всего периода наблюдения терапия ИБС не корректировалась.
После выписки из стационара в указанной когорте были выделены две группы. Первая группа (n = 27) продолжила получать инсулинотерапию в базис-болюсном режиме – растворимые человеческие генно-инженерные инсулины в виде прандиальных инъекций и человеческий изофан-инсулин, вводимый в 22.00 и 8.00. Вторая группа (n = 29) была переведена на аналоги человеческого инсулина – инсулин аспарт (компания «Ново Нордиск», Дания), вводимый однократно перед обедом, и комбинированный ИДегАсп, вводимый перед завтраком с 8.00 до 10.00 и перед ужином с 18.00 до 20.00. Время приема пищи определял сам пациент [12].
Для обеих групп был разработан индивидуальный режим питания с расчетом хлебных единиц. Рекомендованы ежедневные дозированные пешие прогулки от 30 минут до одного часа.
С целью воздействия на инсулинорезистентность в обеих группах использовался метформин в индивидуально подобранной дозе от 1700 до 2500 мг/сут.
С учетом того что после выписки из стационара потребность в инсулине может уменьшаться, суточная доза инсулина была сокращена на 20–30%. В дальнейшем с целью достижения значений HbA1c < 7% дозы вводимых инсулинов корректировались ежемесячно.
Длительность динамического наблюдения составила 24 недели.
На этапе включения в исследование и через 24 недели лечения все больные заполняли специально разработанную анкету, позволявшую анализировать показатели самоконтроля гликемии, частоту гипогликемических состояний, динамику массы тела.
Кроме того, проводили биохимические исследования для оценки уровня HbA1с, С-пептида, иммунореактивного инсулина (ИРИ) и рассчитывали индекс инсулинорезистентности (HOMA-IR).
Инструментальные методы исследования включали ХМЭКГ с определением средней частоты сердечных сокращений (ЧСС) в сутки, ЦИ, временных характеристик ВРС: средняя длительность интервала RR (RRNN, мс), стандартное отклонение всех RR-интервалов (SDNN), квадратный корень суммы разностей последовательных RR-интервалов (RMSSD), процентная представленность эпизодов различия последовательных интервалов более чем на 50 мс (pNN50), вегетативный показатель ритма (ВПР), индекс вегетативного равновесия (ИВР), показатель адекватности процессов регуляции (ПАПР), индекс напряжения регуляторных систем (ИН), вариационный размах (ВР) и СМАД с расчетом вариабельности САДд и САДн, ДАДд и ДАДн.
В исследование не включали пациентов с перенесенным инфарктом миокарда или инсультом менее чем за три месяца до начала исследования, с выраженной патологией печени и почек, онкологическими заболеваниями, хронической сердечной недостаточностью третьей стадии и/или четвертого функционального класса, эпизодом тяжелого гипогликемического состояния, потребовавшим помощи другого лица, с потерей сознания или без нее, за три месяца до исследования.
Статистическая обработка данных проводилась с помощью программы STATISTICA 10.0 (Stat Soft Inc., США). Рассчитывали среднее значение (М), ошибку среднего (m) и стандартное отклонение (SD). Результаты представляли в виде М ± m. Достоверность различий средних величин выборок оценивали с помощью параметрического критерия Стьюдента, если распределение показателей подчинялось нормальному закону, и с помощью критерия Манна – Уитни, если распределение значений не подчинялось нормальному закону. Достоверность различий величин до и после лечения оценивали с помощью парного критерия Вилкоксона. При сравнении выраженных в процентах значений использовали критерий согласия Пирсона, или критерий согласия χ² (хи-квадрат). Для оценки связи между показателями вычисляли парные коэффициенты корреляции Пирсона. Различия считали статистически значимыми при р < 0,05.
Результаты
Динамика показателей углеводного обмена, инсулинорезистентности, общей суточной дозы инсулина и массы тела представлена в табл. 1.
В обеих группах углеводный обмен улучшился. Однако если в первой группе лишь наметилась тенденция к снижению уровня HbA1c (p = 0,07), то во второй – он достоверно уменьшился в среднем на 1,4% (p = 0,000001).
Целевых значений HbA1c в первой группе достигли 11,1% пациентов, во второй – 68,9%.
Трудности в достижении целевых показателей углеводного обмена могли быть связаны с разной частотой гипогликемических состояний.
Дозы инсулина и распространенность гипогликемических состояний представлены на рис. 1 и 2.
У пациентов второй группы достижение целевых значений HbA1c сопровождалось достоверным уменьшением числа эпизодов гипогликемий (см. рис. 2). Они были зарегистрированы у 10,3% и только в дневные часы. У пациентов первой группы существенного снижения частоты гипогликемических состояний не зафиксировано. Их отмечали 74,0% пациентов (p < 0,05). При этом в первой группе доза инсулина увеличилась с 67,32 ± 1,44 до 78,24 ± 1,24 ЕД/сут (p < 0,05) (см. рис. 1). Во второй группе общая суточная доза инсулина не изменилась.
Как следствие, в первой группе индекс массы тела (ИМТ) оказался выше, чем во второй группе (p = 0,04).
Через 24 недели у пациентов обеих групп показатели С-пептида и ИРИ существенно не изменились. Однако во второй группе отмечено статистически значимое уменьшение HOMA-IR (p = 0,0002). Данный факт можно объяснить достоверно меньшей частотой ночных гипогликемий при использовании ИДегАсп. Это позволило добиться более значимого снижения глюкозы плазмы натощак (ГПН) – с 10,34 ± 0,46 до 7,28 ± 0,19 ммоль/л (p < 0,000001). В отличие от второй группы в первой разница показателей ГПН оказалась несущественной (p = 0,08).
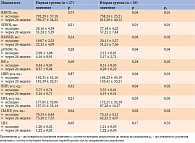
Особый интерес представляла динамика ВРС и ВАД, так как данные показатели в большей степени позволяют оценить состояние вегетативной нервной системы [1, 3, 4]. Через 24 недели во второй группе наблюдалось существенное увеличение таких показателей ВРС, как SDNN – c 27,14 ± 4,22 до 57,21 ± 7,44 мс (р = 0,01), pNN50 – с 2,12 ± 0,81 до 5,17 ± 2,71% (р = 0,04), RMSSD – с 20,11 ± 5,27 до 31,21 ± 7,56 мс (р = 0,04) (табл. 2). Это свидетельствовало о повышении активности парасимпатической нервной системы. Важно отметить, что у пациентов данной группы также достоверно уменьшились показатели ИВР – с 194,23 ± 43,19 до 135,41 ± 33,21 усл. ед. (р = 0,04), ВПР – с 5,55 ± 0,61 до 4,19 ± 0,41 усл. ед. (р = 0,04), ИН – с 172,21 ± 32,19 до 87,28 ± 14,17 (р = 0,03), ПАПР – с 75,13 ± 5,21 до 62,22 ± 4,07 усл. ед. (р = 0,02), что подтверждало снижение активности симпатического отдела вегетативной нервной системы. Следует подчеркнуть, что в первой группе не наблюдалось достоверной динамики показателей ВРС. Следовательно, у больных сохранялась повышенная активность симпатоадреналовой системы, а значит, был высокий риск прогрессирования дисфункции вегетативной нервной системы и КАН.
Таким образом, ИДегАсп способствовали улучшению показателей не только углеводного обмена, но и ВРС.
Поскольку выраженный симпатоадреналовый ответ на гипогликемию может оказывать серьезное влияние на АД, важное место в исследовании отводилось оценке динамики показателей ВАД (табл. 3). У пациентов первой группы, у которых не удалось добиться существенного уменьшения эпизодов гипогликемии, показатели ВАД как в дневное, так и в ночное время существенно не улучшились. В то же время у больных второй группы благодаря значимому улучшению показателей углеводного обмена и низкому риску гипогликемий показатели ВАД улучшались. В частности, отмечено достоверное снижение вариабельности САДд и САДн – с 17,7 ± 0,9 до 14,3 ± 0,8 мм рт. ст. (р = 0,04) и с 16,7 ± 0,8 до 13,6 ± 0,7 мм рт. ст. (р = 0,04) соответственно. При этом существенной динамики вариабельности ДАДд и ДАДн не продемонстрировано.
Выводы
Полученные результаты позволяют сделать следующие выводы.
- Использование ИДегАсп у лиц с СД 2 типа и ИБС способствует снижению уровня HbA1c на 1,4% и достижению целевых значений HbA1c в 68,9% случаев.
- При использовании ИДегАсп благодаря улучшению показателей углеводного обмена, снижению риска развития гипогликемических состояний улучшаются показатели ВРС и ВАД.
- Улучшение показателей ВРС и ВАД может свидетельствовать о регрессе нарушений функции вегетативной нервной системы и предупреждении прогрессирования КАН.
V.I. Kudinov, PhD, E.V. Salaichuk, M.S. Lankina, PhD, A.V. Kotskaya, V.P. Terentyev, PhD, E.V. Pashchenko, PhD, N.A. Korsun, PhD
Rostov State Medical University
Rostov Regional Clinical Hospital
Contact person: Vladimir I. Kudinov, endo-kudinov@mail.ru
Early onset of the cardiovascular autonomic neuropathy are disordered heart rate variability and blood pressure variability this is contributed to by frequent hypoglycemic conditions.
Human insulin analogues have a low risk of hypoglycemia and, possibly, a lower risk of developing and progressing diabetic autonomic neuropathy. Of particular interest is insulin degludec/insulin aspart (IDegAsp) is the first soluble co-formulation of the basal analog insulin degludec and the rapid-acting prandial insulin aspart in a single injection.
The aim of the study was to analyze the dynamics of changes in heart rate variability and blood pressure variability in patients with type 2 diabetes in combination with coronary heart disease against the background of the use of IDegAsp in the basal bolus regimen compared with human insulins.
Material and methods. 56 patients with type 2 diabetes and coronary heart disease were examined, who had impaired heart rate variability and blood pressure variability at normal values of the sum of the scores of classical cardiovascular tests.
Group 1 – 27 patients received human insulins in the basal bolus regimen, group 2 – 29 patients were transferred to IDegAsp before breakfast and dinner, insulin aspart before lunch.
Individual dietary and physical activity regimens were developed for patients of both groups, metformin was prescribed at a dose of 1700–2500 mg/day. After 24 weeks, the indicators of carbohydrate metabolism, insulin resistance, the frequency of hypoglycemic conditions, body weight, as well as heart rate variability and blood pressure variability were analyzed according to Holter ECG monitoring and daily blood pressure monitoring.
Results. Compared to group 1 patients, in group 2, against the background of using IDegAsp, the level of glycated hemoglobin decreased by 1.4%, 68.9% of patients reached the target value of glycated hemoglobin with minimal risk of hypoglycemic conditions. The indicators of heart rate variability and blood pressure improved.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.