Современные аспекты последовательной таргетной терапии метастатического почечно-клеточного рака. Конференция «Лучшее по материалам международных конференций и симпозиумов – 2015: Запад». Сателлитный симпозиум компании Pfizer
- Аннотация
- Статья
- Ссылки
без прогрессирования, общей выживаемости и частоты объективного ответа на терапию.
Проблема лечения почечно-клеточного рака занимает особое место в клинической онкологии.
На симпозиуме, организованном при поддержке компании Pfizer (Сочи, 4 июля 2015 г.), эксперты обсудили вопросы эффективности и безопасности применения первой и второй линий таргетной терапии у пациентов с метастатическим почечно-клеточным раком.
без прогрессирования, общей выживаемости и частоты объективного ответа на терапию.
Проблема лечения почечно-клеточного рака занимает особое место в клинической онкологии.
На симпозиуме, организованном при поддержке компании Pfizer (Сочи, 4 июля 2015 г.), эксперты обсудили вопросы эффективности и безопасности применения первой и второй линий таргетной терапии у пациентов с метастатическим почечно-клеточным раком.



Дифференцированный подход к таргетной терапии в первой линии в зависимости от прогноза заболевания
Директор Бюро по изучению рака почки, исполнительный директор Российского общества клинической онкологии (Москва) Илья Валерьевич ТИМОФЕЕВ в начале своего выступления затронул проблему распространенности почечно-клеточного рака (ПКР) в Российской Федерации.
По эпидемиологическим данным, в мире ежегодно регистрируется около 338 000 новых случаев заболевания. По темпам прироста заболеваемости рак почки занимает лидирующие позиции1. В России в течение последних лет наблюдается рост распространенности этого заболевания. В 2014 г. в нашей стране рак почки выявлен у 21 394 человек. Причем в 20,4% случаев заболевание было впервые выявлено на 4-й стадии, в 19,1% – на 3-й стадии. Следует отметить, что именно на 4-й стадии у пациентов развивается метастазирование опухоли, и они нуждаются в системной терапии.
Согласно программе SEER (Surveillance, Epidemiology and End Results Program – течение, распространенность и исходы злокачественных новообразований) Национального института рака (National Cancer Institute), пятилетняя выживаемость больных раком почки в 2002 г. составила 67,6%, а в 2014 г. – 72,4%. Отмечается тенденция к росту пятилетней выживаемости, что скорее всего обусловлено не только ранней диагностикой, но и появлением в клинической практике новых эффективных методов фармакотерапии онкологических заболеваний.
В настоящее время таргетная терапия вносит существенный вклад в увеличение пятилетней выживаемости пациентов с метастатическим ПКР (мПКР).
В ряде крупных метаанализов показано, что последовательная таргетная терапия мПКР с использованием как одной, так и нескольких линий позволяет улучшить показатели продолжительности жизни2, 3.
И.В. Тимофеев отметил, что необходимо адекватно планировать лечение. Ни один таргетный препарат не является универсальным и одинаково эффективным у всех больных раком почки. Именно поэтому следует четко идентифицировать группу прогноза пациентов.
В рамках отечественного наблюдательного исследования с участием 289 больных мПКР оценивали количество пациентов в разных прогностических группах. Благоприятный прогноз зафиксирован у 41% пациентов, промежуточный – у 20%, неблагоприятный – у 39%. Таким образом, выявлено значительное количество пациентов с промежуточным и неблагоприятным прогнозом, что требует назначения адекватной терапии.
По словам докладчика, важен поиск факторов, определяющих выбор препарата4.
На сегодняшний день прогноз заболевания при мПКР определяется на основании нескольких прогностических моделей. В эпоху применявшейся ранее неспецифической иммунотерапии были разработаны критерии MSKСС (Memorial Sloan-Kettering Cancer Center – Мемориальный онкологический центр им. Слоуна – Кеттеринга, США): статус по шкале Карновского ≤ 80%, увеличение уровня лактатдегидрогеназы > 1,5 раза по сравнению с нормой, высокий уровень скорректированного кальция в сыворотке (> 10 мг/дл), низкий уровень гемоглобина (< 130 г/л), время до начала системной терапии – менее года. Пациенты, у которых отсутствовали перечисленные факторы риска, относились к группе благоприятного или хорошего прогноза, больные с двумя-тремя факторами – к группе промежуточного прогноза, с тремя и более факторами риска – к группе неблагоприятного прогноза5. Данные критерии в настоящее время не утратили актуальности, хотя и были разработаны для иммунотерапии.
С появлением в клинической практике таргетных препаратов, таких как ингибиторы mTOR (mammalian target of rapamycin), в частности темсиролимуса, G. Hudes и соавт. предложили прогностическую модель, включающую пять прогностических факторов MSKСС и дополнительный фактор – количество метастатических очагов в органах ≥ 26.
D. Heng и соавт. (2009) выделили шесть неблагоприятных факторов, которые коррелируют с худшей выживаемостью:
-
уровень гемоглобина ниже нижней границы нормы;
-
уровень скорректированного кальция крови выше верхней границы нормы;
-
общее состояние больного по шкале Карновского < 80%;
-
время от постановки диагноза до начала системной терапии менее одного года;
-
уровень нейтрофилов выше верхней границы нормы;
-
количество тромбоцитов выше верхней границы нормы.
Эти прогностические факторы были использованы для определения трех групп риска: группы низкого риска (ноль факторов), группы промежуточного риска (один-два фактора) и группы высокого риска (три – шесть факторов)7.
В связи с изложенным возникает вопрос: по какой шкале следует оценивать прогноз заболевания пациента перед назначением таргетной терапии?
Согласно последним рекомендациям NCCN (National Comprehensive Cancer Network – Национальная всеобщая онкологическая сеть), оптимальной считается оценка прогноза по критериям G. Hudes и соавт., поскольку эти критерии подразумевают распределение больных мПКР на две группы – группу благоприятного/промежуточного прогноза (от нуля до двух факторов риска) и группу неблагоприятного прогноза (три фактора риска и более). Такое разделение необходимо для оптимизации терапии у пациентов группы неблагоприятного прогноза.
В ряде работ отмечается влияние неблагоприятных факторов на общую выживаемость больных мПКР. При наличии трех и более неблагоприятных прогностических факторов значительно снижается медиана общей выживаемости8. Докладчик подчеркнул, что прогноз и общее состояние пациента – не одно и то же. Оценка общего состояния и сопутствующих заболеваний необходима для определения соотношения потенциальной пользы терапии и риска развития осложнений. Оценка общего состояния пациента в онкологии осуществляется по шкале ECOG (Eastern Cooperative Oncology Group – Восточная кооперативная группа исследования рака). Если у пациента с мПКР статус по шкале ECOG > 2, что является неблагоприятным прогностическим фактором, это не означает принадлежность больного к группе неблагоприятного прогноза. Для объективной прогностической оценки важно учитывать индивидуальные особенности пациента и следовать критериям определения прогноза.
Затем докладчик перешел к обсуждению выбора терапии в зависимости от группы прогноза. Сунитиниб, бевацизумаб + интерферон-альфа (ИФН) и пазопаниб включены в рекомендации NCCN как препараты первой линии при диссеминированном светлоклеточном ПКР у пациентов с благоприятным и промежуточным прогнозом. Рекомендации основаны на результатах сравнительных исследований, продемонстрировавших эффективность таргетных препаратов у пациентов названных прогностических групп.
Темсиролимус также применяется в терапии первой линии диссеминированного светлоклеточного и несветлоклеточного ПКР – у больных группы неблагоприятного прогноза9.
Ингибитор mTOR темсиролимус признан единственным стандартом для лечения больных группы неблагоприятного прогноза.
В международном исследовании с участием 626 пациентов с ПКР, ранее не получавших лечения, с неблагоприятным прогнозом заболевания сравнивали эффективность темсиролимуса, ИФН-альфа и комбинации темсиролимуса с ИФН-альфа. В группе монотерапии темсиролимусом отмечалось значительное увеличение медианы общей выживаемости по сравнению с группой ИФН-альфа и группой комбинированного лечения6.
Кроме того, согласно результатам данного исследования, темсиролимус продемонстрировал эффективность у пациентов с несветлоклеточным ПКР.
Таким образом, темсиролимус – единственный препарат первой линии терапии диссеминированного светлоклеточного и несветлоклеточного ПКР у пациентов с неблагоприятным прогнозом.
В заключение И.В. Тимофеев еще раз подчеркнул, что, согласно результатам крупных рандомизированных исследований и международным рекомендациям, оценка прогноза принципиальна при выборе терапии. Назначение таргетных препаратов без предварительной оценки прогноза может привести к неэффективности лечения и потере времени.
Таргетная терапия второй линии: идеальный пациент для терапии акситинибом
Старший научный сотрудник отделения онкоурологии Московского научно-исследовательского онкологического института им. П.А. Герцена, к.м.н. Алексей Сергеевич КАЛПИНСКИЙ посвятил свой доклад вопросам таргетной терапии второй линии, применяемой у больных мПКР.
В последние годы подходы к фармакотерапии рака почки претерпели значительные изменения. По сравнению с эрой иммунотерапии с использованием ИФН-альфа и интерлейкина 2 сегодня лидирующие позиции занимает таргетная терапия. После завершения крупных многоцентровых клинических исследований одобрено семь препаратов для лечения мПКР: в первой линии – сунитиниб, пазопаниб и комбинация бевацизумаба с ИФН-альфа, во второй линии – акситиниб, сорафениб и эверолимус.
По данным исследований, у больных мПКР, получающих первую линию таргетной терапии, улучшаются показатели выживаемости без прогрессирования (ВБП) и общей выживаемости10, 11. Но, к сожалению, в большинстве случаев это не приводит к полному излечению. Частота полных ремиссий составляет 0–3%. Стабилизацию заболевания регистрируют у 38–74% больных12, 13. Прогрессирование мПКР наступает через 5–11 месяцев после начала таргетной терапии.
Практически у всех пациентов с мПКР со временем развивается резистентность к антиангиогенной терапии. В 25% случаев наблюдается первичная резистентность к таргетной терапии независимо от локализации опухоли. Изучение молекулярных механизмов развития приобретенной лекарственной резистентности показало ее многофакторную этиологию. Именно поэтому целесообразно использовать алгоритмы последовательной таргетной терапии.
В настоящее время в мире распространенным методом лечения пациентов с мПКР признана последовательная терапия. В первой линии таргетной терапии мПКР применяют ингибиторы тирозинкиназ (ИТК). Для терапии второй линии традиционно используют две группы таргетных препаратов – ИТК либо ингибиторы mTOR.
Международное многоцентровое рандомизированное исследование фазы III RECORD-1 с участием 416 больных мПКР после прогрессирования на фоне таргетной терапии ИТК было посвящено оценке эффективности ингибитора mTOR эверолимуса во второй линии терапии. Пациентов рандомизировали в соотношении 2:1 на группы эверолимуса (n = 277) и плацебо (n = 139). Основной целью исследования стала оценка ВБП у пациентов на фоне таргетной терапии эверолимусом или плацебо.
Как показали результаты исследования, эверолимус увеличивал медиану ВБП по сравнению с плацебо (4,9 против 1,9 месяца; р < 0,001) у пациентов с резистентным мПКР14. Тем не менее частота объективного ответа по критериям оценки ответа солидных опухолей (RECIST – Response Evaluation Criteria in Solid Tumors) была низкой и не превысила 2% у пациентов, получавших эверолимус. Медиана общей выживаемости в группе эверолимуса составила 14,78 месяца, в группе плацебо – 14,39 месяца.
Таким образом, значимых различий между группами больных мПКР по показателям общей выживаемости не выявлено.
Недостатки исследования RECORD-1 заключались в том, что только 21% пациентов получали эверолимус во второй линии терапии, в то время как 79% пациентов получали эверолимус в третьей и последующих линиях, а препаратом сравнения было выбрано плацебо.
При выборе терапии второй линии предпочтение отдают препаратам группы ИТК. В исследовании фазы III AXIS сравнивали эффективность и безопасность акситиниба и сорафениба в качестве терапии второй линии у 723 больных мПКР. Акситиниб – высокоселективный эффективный ингибитор рецепторов фактора роста эндотелия сосудов (VEGFR – vascular endothelial growth factor receptors) 1–3, участвующих в механизмах патологического ангиогенеза, опухолевого роста и метастазирования злокачественных новообразований. Акситиниб обеспечивает мощное ингибирование VEGFR-опосредованной пролиферации и выживаемости клеток эндотелия.
В последние годы были разработаны независимые прогностические факторы, влияющие на эффективность таргетной терапии и выживаемость больных мПКР.
По мнению докладчика, прогностические факторы следует оценивать по модели D.Y. Heng и соавт. Эта модель более адекватна, чем прогностическая модель MSKСС.
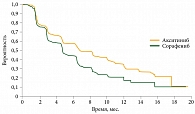
Пациенты, включенные в исследование AXIS, в первой линии получали сунитиниб (54%), ИФН-альфа (35%), бевацизумаб (5%) или темсиролимус (3%). Благоприятный прогноз по модели D.Y. Heng и соавт. отмечен у 18% больных из группы акситиниба, промежуточный – у 65% больных. В группе сорафениба эти показатели составили 22 и 62% соответственно. Согласно результатам исследования AXIS, медиана ВБП у пациентов группы акситиниба была на 43% выше (р < 0,001), чем у пациентов группы сорафениба (6,7 по сравнению с 4,7 месяца). ВБП после полученной ранее терапии сунитинибом в группе акситиниба составила 4,8 месяца, в группе сорафениба – 3,4 месяца. Медиана общей выживаемости составила 20,1 и 19,2 месяца соответственно (см. рисунок)15.
В исследовании оценивали профили токсичности, которые у обоих препаратов были схожи, за исключением преобладания артериальной гипертензии в группе акситиниба и более высокой частоты ладонно-подошвенного синдрома в группе сорафениба.
А.С. Калпинский отметил, что, по данным исследования, гипертензия, развившаяся на фоне лечения акситинибом, служит независимым предиктором увеличения общей выживаемости16. При этом лечение артериальной гипертензии не влияет на эффективность акситиниба. Исследователи титровали дозу акситиниба в зависимости от индивидуальной переносимости пациента. Начинали лечение с дозы 5 мг два раза в сутки, далее через две недели после начала терапии оценивали состояние больного. В отсутствие нежелательных явлений выше второй степени тяжести, при уровне артериального давления, не превышающем 150/90 мм рт. ст. и не требующем приема гипотензивных препаратов, дозу повышали до 7 мг два раза в сутки. Через четыре недели после начала лечения, придерживаясь аналогичных критериев, дозу увеличивали до 10 мг два раза в сутки17.
Особое значение в клинической практике имеет оптимальная последовательность использования таргетных препаратов у больных мПКР. Результаты исследования AXIS показали, что акситиниб значимо повышает частоту объективных ответов у пациентов с мПКР (см. таблицу). Акситиниб во второй линии терапии приводит к статистически и клинически значимому увеличению медианы ВБП у пациентов с мПКР, включая больных после терапии ингибиторами тирозинкиназ.
Таким образом, акситиниб – первый препарат, продемонстрировавший эффективность во второй линии в прямом сравнении с активным препаратом (сорафенибом).
Современными международными рекомендациями EAU (European Association of Urology – Европейская ассоциация урологов), NCCN, ESMO (European Society for Medical Oncology – Европейское сообщество медицинской онкологии) акситиниб рекомендован в качестве единого стандарта второй линии после цитокинов и ИТК.
Заключение
Появление в клинической практике таргетных препаратов – ингибиторов тирозинкиназ и mTOR способствовало повышению эффективности лечения больных мПКР. Применение последовательной таргетной терапии позволяет улучшить результаты даже у пациентов с неблагоприятным прогнозом.
Темсиролимус (Торизел, компания Pfizer) – специфический ингибитор mTOR, влияющий на синтез белков, регулирующих пролиферацию, рост и выживание опухолевых клеток.
Данные об эффективности и безопасности Торизела получены в ходе рандомизированного исследования у больных мПКР. У пациентов с мПКР на фоне терапии темсиролимусом отмечалось значительное увеличение медианы общей выживаемости по сравнению с больными, получавшими монотерапию ИФН-альфа и комбинацию темсиролимуса с ИФН-альфа.
Темсиролимус оказывает минимальное воздействие на качество жизни больных и характеризуется хорошей переносимостью.
Международными рекомендациями препарат одобрен для применения в первой линии терапии диссеминированного светлоклеточного и несветлоклеточного ПКР у пациентов с неблагоприятным прогнозом.
Селективный ингибитор VEGFR-1, 2, 3 акситиниб (Инлита®, компания Pfizer) мощно подавляет ангиогенез и пролиферацию опухолевых клеток и приводит к достоверному улучшению безрецидивной выживаемости больных распространенными формами ПКР.
Акситиниб более чем в два раза превосходит сорафениб по частоте объективного ответа и имеет благоприятный профиль безопасности при длительном применении. В ходе исследований показано, что артериальная гипертензия, развивающаяся на фоне таргетной терапии акситинибом, служит предиктором эффективности. Акситиниб – первый таргетный препарат, для которого официально зарегистрирована возможность повышения дозы на фоне лечения.
На основании результатов клинических исследований препарат Инлита® рекомендован в качестве стандарта второй линии терапии мПКР после цитокинов и ингибиторов тирозинкиназ.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.