Современные подходы к антиоксидантной терапии диабетической невропатии в амбулаторной практике
- Аннотация
- Статья
- Ссылки
- English
Диабетическая невропатия – самое распространенное неврологическое осложнение сахарного диабета. Актуальность диагностики и лечения диабетической невропатии обусловлена тем, что невропатия ухудшает качество жизни, может стать причиной инвалидизации и смерти больных.
Под диабетической невропатией понимают патогенетически связанное с сахарным диабетом сочетание синдромов поражения нервной системы, классифицируемое в зависимости от того, какие структуры вовлечены в патологический процесс: спинномозговые нервы (дистальная или периферическая), вегетативная нервная система (висцеральная или автономная) [1].
Диабетическая невропатия подразделяется на симметричную (дистальная сенсорная и/или моторная формы, диабетическая невропатия длинных нервных волокон, хроническая демиелинизирующая полирадикулопатия) и асимметричную (мононевропатия, множественные мононевропатии, радикулопатия, плексопатия или радикулоплексопатия, хроническая демиелинизирующая полирадикулоневропатия). Чаще всего наблюдается дистальная симметричная, преимущественно сенсорная полиневропатия, клинические проявления которой отмечаются у 30–50% больных сахарным диабетом первого и второго типа [2].
Распространенность диабетической полиневропатии варьируется в зависимости от используемых диагностических критериев. Частота невропатии, диагностируемой на основании клинических симптомов, составляет около 25%, а при проведении электронейромиографического исследования – 100% [3]. В целом истинная распространенность диабетической полиневропатии в популяции больных сахарным диабетом составляет около 30–34%, при впервые выявленном сахарном диабете – 7,5–10%. Кроме того, распространенность диабетической полиневропатии увеличивается со временем: при длительности сахарного диабета более 25 лет она диагностируется более чем в 50% случаев [4].
Для диабетической сенсорной полиневропатии характерно медленно прогрессирующее течение с типичной клинической картиной нарушения всех видов чувствительности по полиневропатическому типу в дистальных отделах конечностей (по типу «носков» и «перчаток»). Часто отмечаются субъективные ощущения в виде жжения, онемения, парестезий в конечностях, судороги икроножных мышц. В развернутой клинической стадии наблюдаются двигательные нарушения в виде слабости (преимущественно в дистальных отделах ног), сопровождающейся умеренной гипотрофией мышц голеней и стоп [5].
Диабетическая сенсорная полиневропатия – вторая по частоте встречаемости причина невропатической боли, клинические варианты которой связаны с поражением различных типов волокон периферических нервов, как тонких слабо миелинизированных, так и толстых быстропроводящих. В первую очередь в патологический процесс вовлекаются более тонкие нервные волокна, что ведет к снижению или потере температурной, болевой чувствительности. При этом пациенты предъявляют жалобы на парестезии, чувство зябкости, жжения, острые, колющие боли в области стоп. Следствием дегенеративных изменений толстых сенсорных нервных волокон становится нарушение вибрационной и проприоцептивной чувствительности. Кроме того, ослабляются глубокие сухожильные рефлексы и замедляется скорость распространения возбуждения по нервному волокну. При сенсорной полиневропатии больные жалуются на онемение, чувство покалывания, иногда ощущение инородного тела в области стоп. При поражении моторных нервов нарушается тонус сгибателей и разгибателей пальцев, развивается атрофия межкостных мышц, мелких мышц стопы, что ведет к деформации пальцев стопы.
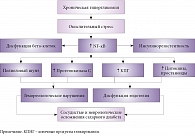
В настоящее время патогенетические механизмы сахарного диабета достаточно хорошо изучены (рис. 1) [6]. Известно, что диабетическая невропатия представляет собой многостадийный процесс, включающий целый каскад механизмов [7, 8]:
- активизацию в условиях гипергликемии полиолового пути утилизации глюкозы с помощью фермента альдозоредуктазы;
- неэнзиматическое гликирование белков с образованием конечных продуктов избыточного гликирования;
- нарушение обмена жирных кислот – гамма-линоленовой и арахидоновой кислот и, как следствие, изменение метаболизма вазоактивных субстанций, ведущее к снижению эндоневрального кровотока;
- нейротрофические нарушения;
- окислительный стресс.
Понимание патогенетических механизмов, лежащих в основе формирования осложнений сахарного диабета, представляется крайне важным для практического врача, поскольку нацеливает его использовать не только этиотропную, но и патогенетическую терапию. Необходимость патогенетического лечения обусловлена также тем, что контроля гликемии недостаточно для предупреждения и купирования симптомов диабетической полиневропатии. Так, метаанализ рандомизированных контролируемых исследований не подтвердил значительную пользу интенсивного контроля гликемии в отношении снижения проявлений невропатии у пациентов с сахарным диабетом второго типа [9]. Это согласуется с результатами Кохрановского обзора, в котором не было подтверждено, что интенсивный контроль гликемии способствует значительному улучшению состояния у пациентов с невропатией, развившейся на фоне сахарного диабета второго типа. Однако дизайн большинства исследований, проведенных с участием больных сахарным диабетом второго типа, не был специально разработан для оценки влияния интенсивного контроля гликемии на выраженность проявлений диабетической полиневропатии и включал только элементарную оценку невропатии [10]. Из этого следует, что поддержание стабильной нормогликемии, которая препятствует активации процессов окислительного стресса, остается актуальным методом профилактики диабетической невропатии при сахарном диабете.
В последнее время накоплено много данных о важной роли окислительного стресса в развитии диабетических осложнений [11, 12]. Повышенное количество глюкозы в крови способствует развитию гипергликемии. Расщепление метаболитов в цикле трикарбоновых кислот превышает способность электронтранспортной цепи усваивать получаемые электроны, что ведет к накоплению активных форм кислорода [13]. Однако образование свободных радикалов может происходить также в результате автоокисления глюкозы, при реакции окисления энидиолов с образованием продуктов Амадори и H2O2. Кроме того, митохондриальное окисление восстановленного никотинамидадениндинуклеотида с образованием O2- при синтезе простагландинов сопровождается накоплением O2- (образующийся O2- способен запускать активацию внутриклеточных сигнальный путей, проникая в клеточную мембрану через анионные каналы) [14]. В присутствии железа O2- и H2O2 могут образовывать высокореакционный гидроксильный радикал ОН·, который запускает реакции перекисного окисления липидов, сопровождающиеся появлением промежуточных продуктов – пероксильных и алкоксильных радикалов [15]. В неполярном окружении при физиологических условиях присутствует в основном протонированная форма супероксида – гидропероксидный радикал (HO2.) [15]. В связи с тем что супероксидный радикал в отличие от HO2 не способен проникать через биологические мембраны, его вклад в перекисное окисление липидов незначителен. При этом следует отметить, что супероксид-анион-радикал способен превращаться в H2O2 под действием двух видов (Cu-Zn- и Mn-) внутриклеточных супероксиддисмутаз и в последующем подвергаться трансформации в H2O при помощи ферментов каталазы или глутатионпероксидазы [15]. Образующийся O2·-, обусловленный состоянием гипергликемии, ингибирует активность глицеральдегид-3-фосфатдегидрогеназы путем модифицирования фермента полимерами АДФ-рибозы [16]. В то же время замедляется общий метаболизм глюкозы и повышается метаболизм глюкозы по полиольному пути [17–19]. При этом задействуется фермент альдозоредуктаза, который преобразует глюкозу в сорбитол с участием никотинамидадениндинуклеотидфосфата (НАДФ) в качестве кофермента. Преобладание полиольного пути усиливает окислительный стресс из-за увеличенного потребления НАДФ альдозоредуктазой. НАДФ необходим для генерации эндогенного антиоксиданта глутатиона, снижение концентрации НАДФ истощает глутатион, что ведет к нарастанию окислительного стресса [20].
Другим механизмом, посредством которого может усиливаться окислительный стресс, является транспорт электронов в митохондриях. Повышение внутриклеточного уровня глюкозы увеличивает перенос электронов в процессе функционирования дыхательной цепи в митохондриях, что приводит к усилению генерации свободных радикалов [8, 21]. P.A. Low и K.K. Nickander, построившие модель развития диабетической невропатии, отмечали возрастание активности содержащих кислород радикалов в седалищном нерве [22].
Расстройства метаболизма при сахарном диабете приводят к повреждению и гибели непосредственно клеточных структур, а сосудистые механизмы вызывают ишемическо-гипоксические тканевые расстройства. Оба эти процесса в большой степени взаимно потенцируют патофизиологические действия каждого, замыкая порочный круг поражения организма при сахарном диабете, ускоряя процессы поражения сосудистой стенки и тканей с высоким метаболизмом, предопределяя неизбежные и ранние неврологические осложнения. В этой связи лечение прежде всего направлено на то, чтобы разорвать порочный круг взаимодействия метаболических и сосудистых механизмов прогрессирования сахарного диабета. К числу патогенетически оправданных методов фармакотерапии расстройств тканевого метаболизма при сахарном диабете относится коррекция энергодефицита. Такая терапия может и должна проводиться длительными курсами антиоксидантов и антигипоксантов.
Антиоксиданты (в составе комплексной терапии сахарного диабета и его осложнений) оказывают протективное действие, ограничивая интенсивность перекисного окисления липидов [23]. Среди потенциально эффективных антиоксидантных средств, наряду с глутатионом, убихиноном, супероксиддисмутазой, витамином Е, важнейшим фактором антиоксидантной защиты является альфа-липоевая (тиоктовая) кислота. Благодаря своей дитиоловой природе альфа-липоевая (тиоктовая) кислота не только самостоятельно выполняет роль скэвенджера («тушителя») супероксидных радикалов, но и, взаимодействуя с перечисленными системами, потенцирует их антиоксидантные свойства, препятствуя активации окислительного стресса, продукты которого имеют, по современным представлениям, большое значение в патогенезе диабетической микроангиопатии. Кроме того, альфа-липоевая (тиоктовая) кислота увеличивает чувствительность тканей к инсулину, что в ряде случаев сопровождается снижением концентрации глюкозы в крови вплоть до гипогликемии [3, 11, 24].
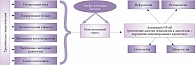
К настоящему моменту свойства альфа-липоевой (тиоктовой) кислоты изучены как в эксперименте, так и в клинике. В Medline опубликовано свыше 250 научных работ, посвященных механизму действия альфа-липоевой (тиоктовой) кислоты (рис. 2) [6].
Исследуя экспериментальную диабетическую невропатию, М. Nagamatsu отметил способность альфа-липоевой (тиоктовой) кислоты выступать в роли мощного липофильного перехватчика свободных радикалов [25].
Было установлено, что в условиях in vitro добавление альфа-липоевой (тиоктовой) кислоты приводит к дозозависимому снижению скорости нервной проводимости, улучшению кровоснабжения нерва, снижению количества продуктов перекисного окисления липидов [25, 26]. Как было показано на экспериментальной модели диабетической невропатии, одной из причин снижения кровообращения в нервных окончаниях является угнетающее действие супероксид-анион-радикала на NO-синтазу [27], которое можно предотвратить путем снижения уровня окислительного стресса.
Экспериментальные исследования с применением альфа-липоевой (тиоктовой) кислоты продемонстрировали ее нейропротективное и нейротрофическое действие. Так, использование низких доз альфа-липоевой (тиоктовой) кислоты влияло на проводимость нервов и дефицит кровообращения в нервных окончаниях [12], содержание фактора роста нервов, субстанции Р и нейропептида Y седалищного нерва [28, 29]. Обнаружено, что нейропротективное действие альфа-липоевой (тиоктовой) кислоты обусловлено не только ее антиоксидантными свойствами, но и способностью повышать уровень миоинозитола и креатинфосфата в нервных тканях [28].
Другое свойство альфа-липоевой (тиоктовой) кислоты, обнаруженное в экспериментальных условиях, заключалось в подавлении активации транскрипционного фактора NF-kB в культивируемых эндотелиальных клетках [30]. По некоторым данным, активные формы кислорода, образующиеся в дыхательной цепи митохондрий, выступают в качестве вторичных мессенджеров для активации NF-kB, фактора некроза опухоли альфа и интерлейкина 1 [21]. Взаимодействие конечных продуктов гликирования с поверхностными эндотелиальными рецепторами создает условия для развития внутриклеточного окислительного стресса, происходит активация NF-kB, который транслоцируется в ядро и индуцирует экспрессию эндотелиальных генных продуктов, таких как эндотелин 1, и тканевого фактора, которые повышаются при сахарном диабете [30]. При добавлении альфа-липоевой (тиоктовой) кислоты в клеточную культуру происходит подавление активации NF-kB. На фоне приема 600 мг альфа-липоевой (тиоктовой) кислоты в течение трех дней наблюдалось уменьшение активации фактора NF-kB мононуклеарных клеток периферической крови, что сопровождалось снижением продуктов окислительного стресса в плазме крови больных сахарным диабетом с нефропатией [31]. В других исследованиях применение альфа-липоевой (тиоктовой) кислоты у больных сахарным диабетом второго типа в течение нескольких дней или недель способствовало улучшению чувствительности к инсулину [32, 33], снижению уровня глюкозы [34] и продуктов окислительного стресса [35].
В многочисленных исследованиях терапия альфа-липоевой (тиоктовой) кислотой положительно влияла на симптомы заболевания и рост плазменных антиоксидантных показателей, способствовала купированию болевых симптомов на фоне снижения выраженности нейрональных нарушений [24, 36–42].
Лечебный эффект альфа-липоевой (тиоктовой) кислоты обусловлен ее мощным антиоксидантным действием. Высокая эффективность альфа-липоевой (тиоктовой) кислоты подтверждена в нескольких рандомизированных двойных слепых плацебоконтролируемых исследованиях: ALADIN, ALADIN II, ALADIN III, ORPIL, SYDNEY, DEKAN, NATHAN I и NATHAN II. Эти исследования показали, что применение препаратов альфа-липоевой (тиоктовой) кислоты способствует уменьшению как субъективных, так и объективных проявлений диабетической полиневропатии, болевого синдрома, улучшает чувствительность. Кроме того, были отмечены хорошая переносимость и безопасность альфа-липоевой (тиоктовой) кислоты [41, 43–47].
Трехнедельное исследование ALADIN продемонстрировало эффективность кратковременной терапии альфа-липоевой (тиоктовой) кислотой у больных с диабетической невропатией и позволило определить дозу альфа-липоевой (тиоктовой) кислоты с оптимальным терапевтическим эффектом. Под наблюдением находились 260 пациентов, которым в течение трех недель вводилась альфа-липоевая (тиоктовая) кислота внутривенно в дозе 100, 600, 1200 мг/сут. Наиболее эффективным и безопасным оказалось инфузионное введение альфа-липоевой (тиоктовой) кислоты в дозе 600 мг, при котором отмечалось улучшение периферической чувствительности (тепловой, температурной, тактильной, вибрационной). При увеличении дозы до 1200 мг чаще регистрировались нежелательные явления [35].
В двухлетнем исследовании ALADIN II оценивалось влияние альфа-липоевой (тиоктовой) кислоты на течение диабетической периферической невропатии. Препарат назначался сначала внутривенно в течение первых пяти дней, а затем перорально по 600 и 1200 мг. В исследование было включено 65 пациентов, 18 из которых принимали альфа-липоевую (тиоктовую) кислоту в дозе 1200 мг, 27 – в дозе 600 мг, 20 человек получали плацебо. Эффективность оценивали по следующим показателям: шкале невропатического дисфункционального счета (Neuropathy Dysability Score – NDS), скорости проводимости икроножных нервов (Sensory Nerve Conduction Velocity – SNCV), потенциалам действия чувствительных нервов (Sensory Nerve Action Potential – SNAP), скорости проводимости большеберцовых двигательных нервов (Motor Nerve Conduction Velocity – MNVC), дистальной латентности двигательных нервов (Motor Nerve Distal Latency – MNDL). Через 24 месяца терапии наблюдалось статистически значимое (p < 0,05) увеличение SNVC и SNAP в обеих группах лечения по сравнению с плацебо. На фоне терапии альфа-липоевой (тиоктовой) кислотой в дозе 1200 мг также значимо повышался показатель MNVC. При этом разница по NDS между тремя группами по сравнению с исходным состоянием, равно как и по частоте нежелательных явлений, отсутствовала. Таким образом, были доказаны безопасность длительной терапии альфа-липоевой (тиоктовой) кислотой и ее положительное влияние на течение диабетической периферической полиневропатии [44].
В полугодовом рандомизированном исследовании ALADIN III изучалась эффективность трехнедельного курса внутривенного введения альфа-липоевой (тиоктовой) кислоты 600 или 1200 мг/сут с дальнейшим приемом таблетированной формы в суточной дозе 1800 мг в течение шести месяцев [46, 48]. Трехнедельный курс парентерального введения альфа-липоевой (тиоктовой) кислоты способствовал существенному снижению неврологического дефицита по сравнению с плацебо при оценке по шкале невропатических нарушений (Neuropathy Impairment Score). Однако различие между группой больных, получавших альфа-липоевую (тиоктовую) кислоту, и группой плацебо не достигло статистической значимости. Это объясняется кратковременностью перорального приема препарата (по сравнению с исследованием ALADIN II), а также отсутствием количественной оценки результатов объективных показателей.
В трехнедельном исследовании ОRPIL эффективность альфа-липоевой (тиоктовой) кислоты 600 мг/сут парентерально и 1800 мг/сут перорально была сопоставима не только по субъективным показателям, но и по объективным параметрам. Следует отметить, что в данном исследовании использовалась форма препарата быстрого высвобождения, характеризующегося такой же биодоступностью при пероральном приеме, что и при парентеральном введении [49].
Рандомизированное двойное слепое плацебоконтролируемое исследование SYDNEY, проведенное в 2001 г. в США и России с участием 60 пациентов с сахарным диабетом первого и второго типов, показало, что альфа-липоевая (тиоктовая) кислота положительно влияет на клинические проявления диабетической периферической полиневропатии, способствует усилению мышечных рефлексов и скорости проведения нервного импульса [43].
В многоцентровом плацебоконтролируемом исследовании SYDNEY II оценивалось влияние различных доз препарата альфа-липоевой (тиоктовой) кислоты (600, 1200, 1800 мг) на клинические проявления диабетической полиневропатии по общей шкале оценки симптомов (Total Symptom Score) [41]. Статистически достоверные положительные результаты регистрировались во всех исследуемых группах. Различия наблюдались лишь в сроках наступления терапевтического эффекта. При назначении 600 мг препарата улучшение самочувствия отмечалось через три недели лечения, при использовании более высоких доз – в более короткие сроки. Анализ безопасности показал зависимое от дозы усиление тошноты и головокружения. При этом ни один пациент, принимавший альфа-липоевую (тиоктовую) кислоту в дозе 600 мг, не выбыл из исследования, тогда как 11 и 13% пациентов, получавших препарат в дозе 1200 и 1800 мг соответственно, отказались от терапии из-за побочных эффектов.
В плацебоконтролируемом исследовании DEKAN (n = 73) было показано, что терапия альфа-липоевой (тиоктовой) кислотой с использованием хорошо переносимой дозы 800 мг/сут перорально в течение четырех месяцев улучшала течение вегетативной кардионевропатии у больных сахарным диабетом второго типа [50].
В плацебоконтролируемом исследовании NATНAN I оценивались эффективность и безопасность альфа-липоевой (тиоктовой) кислоты у больных диабетом с дистальной симметричной полиневропатией (от слабой до умеренной степени). 460 пациентов получали 600 мг препарата или плацебо перорально в течение четырех лет. По результатам исследования был сделан вывод о том, что четырехлетняя терапия альфа-липоевой (тиоктовой) кислотой при диабетической полиневропатии слабой или умеренной степени хорошо переносится и уменьшает некоторые проявления неврологического дефицита и симптомы, но не нервную проводимость [51].
В ходе многоцентрового рандомизированного исследования NATНAN II с участием 32 центров в США, Канаде и Европе было обследовано 477 пациентов, из них 241 получал альфа-липоевую (тиоктовую) кислоту в дозе 600 мг парентерально, а 236 – плацебо в течение трех недель. По результатам исследования был сделан вывод о том, что кратковременная терапия альфа-липоевой (тиоктовой) кислотой 600 мг внутривенно способствовала снижению выраженности основных симптомов диабетической полиневропатии и уменьшению неврологического дефицита [52].
В исследовании K. Ibrahimpasic была подтверждена эффективность альфа-липоевой (тиоктовой) кислоты у больных диабетической дистальной сенсорно-моторной невропатией. Ее терапевтический эффект оказался более значимым у пациентов с хорошим гликемическим контролем [53]. Сходные данные опубликованы также В.Н. Храмилиным и соавт. [54]. Частота рецидивов болевой симптоматики не зависела от предшествующей схемы назначения альфа-липоевой (тиоктовой) кислоты, а определялась исходным уровнем гликозилированного гемоглобина (HbA1c). Наибольшая эффективность альфа-липоевой (тиоктовой) кислоты наблюдалась у пациентов с исходным уровнем HbA1c < 7,5%. Высокий уровень HbA1c (> 8,0%), тяжелые сенсорные нарушения могут служить предикторами низкой эффективности терапии альфа-липоевой (тиоктовой) кислотой. Таким образом, для обеспечения наибольшей эффективности терапии альфа-липоевой (тиоктовой) кислотой необходимо добиться исходного уровня HbA1c < 7,5% [54].
В настоящее время, по результатам многочисленных исследований, при сосудистых осложнениях сахарного диабета рекомендовано начинать терапию с внутривенных инфузий, далее переходя на пероральную форму. Оптимальная схема лечения: внутривенное капельное введение раствора альфа-липоевой (тиоктовой) кислоты в течение трех недель (15 капельниц) с последующим приемом 600 мг/сут перорально (один раз в сутки натощак, за 30–40 минут до еды) в течение одного-двух месяцев [5, 55]. Следует отметить, что большинство авторов, основываясь на доказанной клинической эффективности и безопасности, рекомендуют назначать альфа-липоевую (тиоктовую) кислоту именно в дозе 600 мг/сут [56–58].
На сегодняшний день в медицинской практике применяются различные препараты альфа-липоевой (тиоктовой) кислоты, различающиеся количеством активного вещества и формами выпуска. В числе широко известных средств этой группы – препарат Берлитион®, который выпускается в форме таблеток и раствора для инъекций. Взрослым при диабетической полиневропатии, как правило, рекомендуется прием внутрь 600 мг/сут тиоктовой кислоты (две таблетки препарата Берлитион®300). При тяжелой форме диабетической полиневропатии обычно назначается внутривенно капельно по 300–600 мг тиоктовой кислоты (одна-две ампулы препарата Берлитион®300 или одна ампула препарата Берлитион®600) в сутки. Для достижения необходимого терапевтического эффекта следует придерживаться рекомендаций по приему препарата. Как правило, Берлитион® принимают в течение длительного периода времени, продолжительность курса лечения определяет врач.
В заключение отметим, что прогноз сахарного диабета во многом определяется временем развития и тяжестью проявления поздних осложнений, к которым относится и дистальная полиневропатия. В практическом здравоохранении очень важно своевременно проводить профилактику и патогенетическое лечение осложнений сахарного диабета для предотвращения инвалидизации больных.
E.Yu. Solovyova, E.D. Dzhutova, Ye.A. Tyutyumova
Pirogov Russian National Research Medical University
Contact person: Ella Yuryevna Solovyova, ellasolovieva@yandex.ru
Data from experimental and clinical studies assessing efficacy and safety of alpha-lipoic acid as well as its influence on neurological complications of diabetes mellitus are reviewed in the paper.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.