Современные подходы к терапии и профилактике рецидивирующих циститов у беременных с применением D-маннозы: результаты проспективного рандомизированного клинического исследования
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. За 2019–2021 гг. в исследование было включено 40 беременных (средний возраст – 29,3 ± 7,0 года) на сроке до 27 недель с острым приступом цистита и рецидивами цистита вне беременности в анамнезе. После полного клинико-лабораторного обследования все пациентки были разделены на две группы. 20 пациенток первой группы принимали антибактериальный препарат (фосфомицина трометамол 3 г однократно или амоксициллина клавуланат 875 мг три раза в день в течение пяти дней) и D-маннозу в интермиттирующем режиме до родоразрешения, 20 пациенток второй группы – только антибактериальный препарат.
Результаты. При динамическом наблюдении беременных до родоразрешения в первой группе на фоне интермиттирующей терапии D-маннозой зафиксировано снижение уровня рецидивов в шесть раз по сравнению со второй группой. Наибольшее число рецидивов пришлось на первый и второй триместры (до 22 недель), что скорее всего обусловлено физиологическими изменениями мочеполовой системы беременной и состоянием относительной иммуносупрессии.
Выводы. Результаты динамического наблюдения и профилактического приема D-маннозы на протяжении всей беременности показали эффективность D-маннозы в предупреждении рецидивов цистита у беременных. Частота рецидивов у принимавших D-маннозу в профилактичнских целях была существенно ниже, чем у беременных, не получавших ее. Для валидации результатов данного исследования необходимы дальнейшие многоцентровые исследования. Тем не менее первоначальные выводы свидетельствуют об эффективности D-маннозы в предупреждении рецидивов цистита и ее безопасности у беременных.
Материал и методы. За 2019–2021 гг. в исследование было включено 40 беременных (средний возраст – 29,3 ± 7,0 года) на сроке до 27 недель с острым приступом цистита и рецидивами цистита вне беременности в анамнезе. После полного клинико-лабораторного обследования все пациентки были разделены на две группы. 20 пациенток первой группы принимали антибактериальный препарат (фосфомицина трометамол 3 г однократно или амоксициллина клавуланат 875 мг три раза в день в течение пяти дней) и D-маннозу в интермиттирующем режиме до родоразрешения, 20 пациенток второй группы – только антибактериальный препарат.
Результаты. При динамическом наблюдении беременных до родоразрешения в первой группе на фоне интермиттирующей терапии D-маннозой зафиксировано снижение уровня рецидивов в шесть раз по сравнению со второй группой. Наибольшее число рецидивов пришлось на первый и второй триместры (до 22 недель), что скорее всего обусловлено физиологическими изменениями мочеполовой системы беременной и состоянием относительной иммуносупрессии.
Выводы. Результаты динамического наблюдения и профилактического приема D-маннозы на протяжении всей беременности показали эффективность D-маннозы в предупреждении рецидивов цистита у беременных. Частота рецидивов у принимавших D-маннозу в профилактичнских целях была существенно ниже, чем у беременных, не получавших ее. Для валидации результатов данного исследования необходимы дальнейшие многоцентровые исследования. Тем не менее первоначальные выводы свидетельствуют об эффективности D-маннозы в предупреждении рецидивов цистита и ее безопасности у беременных.



Введение
Заболеваемость циститом в России составляет 26–36 млн случаев в год, или 0,5–0,7 эпизода заболевания на одну женщину в год. Особенностью воспалительных заболеваний мочевыводящих путей является тенденция к рецидивирующему течению: по данным литературы, обострение цистита в течение шести месяцев после возникновения первичного эпизода возникает у каждой третьей женщины [1–4]. Распространенность инфекций мочевыводящих путей (ИМП) у беременных достигает 8–10%: бессимптомная бактериурия (ББУ) – 2–10% и более [4, 5], острый цистит – 1–3% [4, 6, 7], острый пиелонефрит – менее 1% [7, 8]. При этом ИМП чаще развивается во втором и третьем триместрах беременности и только у 10–20% – в первом триместре [8, 9]. У 20–40% беременных в отсутствие лечения ББУ возникает пиелонефрит [2].
Одним из факторов рецидивирования считается способность бактерий образовывать биопленку (мукополисахаридный комплекс). Формирующиеся хронические очаги инфекции с последующим развитием устойчивости к антибиотикам усложняют тактику лечения. Кроме того, клеточная стенка бактерий Escherichia coli имеет крошечные пальцевидные выступы, которые содержат на поверхности сложные молекулы, называемые лектинами. Лектины действуют как клеточный клей. Они связывают бактерии со стенкой мочевого пузыря. Бактерии, прикрепившись к маннозосодержащим рецепторам стенки мочевого пузыря, не удаляются при мочеиспускании [10–12].
В современных клинических рекомендациях предусмотрено проведение скрининга на выявление цистита и ИМП у беременных при первом посещении врача ввиду угрозы тяжелых осложнений у матери и плода [13].
Лечение хронического цистита у беременных заключается в устранении причин, вызвавших хроническое воспаление. Лечение комплексное и направлено на восстановление нарушенной уродинамики, ликвидацию очагов реинфекции, компенсацию сопутствующих заболеваний и др. Антибактериальное лечение при хроническом цистите проводят только после бактериологического исследования и определения чувствительности микрофлоры к антибактериальным лекарственным средствам. Следует отметить, что длительное и частое применение антибиотиков приводит к нарушению влагалищной микрофлоры и флоры кишечника, развитию тяжелых дисбиозов влагалища и кишечника, формированию полирезистентных штаммов бактерий. В связи с этим возрастает актуальность применения натуральных природных заменителей химических препаратов, которые крайне редко вызывают нежелательные побочные реакции, а в комбинации с антибактериальными препаратами потенцируют их лечебный эффект. Как следствие – сокращение длительности антибактериальной терапии, повышение ее эффективности, снижение риска возникновения побочных эффектов.
Манноза (D-манноза) наряду с фруктозой, глюкозой и другими природными веществами относится к группе простых сахаридов. D-манноза – моносахарид (моноз), который представлен двумя таутомерными формами – циклической и линейной [14]. Таутомерия играет важную роль в химических процессах внутри живых организмов. В естественной природе D-манноза содержится в растениях тропических и субтропических широт, в частности плодах цитрусовых деревьев. D-манноза относится к минорным сахарам и в организме человека участвует в синтезе гликопротеидов, гликолипидов, иммунных тел (лимфоцитов, фагоцитов), играющих основную роль в системе рецепции между клетками. 7–10% суточной потребности D-маннозы синтезируются в организме человека в процессе метаболизма, остальное количество D-маннозы должно поступать с продуктами питания или в виде пищевой добавки.
В пищевых продуктах D-манноза входит в состав гомогенных или гетерогенных полисахаридов, не расщепляющихся под воздействием кислот и ферментов желудочно-кишечного тракта человека. Длительное снижение концентрации D-маннозы в крови приводит к нарушению синтеза не только клеточных рецепторов и клеточных структур, но и углеводной части иммунных тел. В результате синтеза гликопротеидов и гликолипидов с меньшим количеством молекул D-маннозы нарушается система рецепции в сторону ее упрощения. В этом случае защитные функции организма против попадания чужеродных микроорганизмов и формирования патологических клеток снижаются.
Таким образом, недостаток D-маннозы в организме в течение длительного периода способствует развитию сахарного диабета, ожирения, заболеваний сердечно-сосудистой системы, щитовидной железы и в конечном итоге иммунодефицитного состояния [12, 15, 16].
Согласно результатам исследований, введение в рацион питания D-маннозы приводит к нормализации углеводного обмена и постепенной регенерации всех биохимических процессов в клетках. D-манноза обладает низким гликемическим индексом, не нарушает баланс сахара в крови и безопасна для диабетиков. Современные научные данные подтверждают наличие обратной корреляции уровня D-маннозы и глюкозы у больных диабетом [14, 15, 17, 18].
D-манноза обладает пребиотическими свойствами, стимулируя функционирование кишечника и селективно обеспечивая рост бифидобактерий кишечной микрофлоры человека и животных. Имеются немногочисленные данные о пребиотическом действии этого углевода. Коррекция микробиоценоза кишечника является основной составляющей терапии большинства заболеваний человека [19, 20].
Клинические испытания показали чрезвычайную эффективность D-маннозы при мочеполовых инфекциях. От некоторых из них с помощью D-маннозы удается излечиться в течение нескольких дней. При этом побочных эффектов не наблюдается.
D-манноза имеет преимущества перед антибиотиками:
- не влияет на условно-полезную флору и не вызывает дисбактериоз;
- не провоцирует возникновение и рост грибковых инфекций;
- не оказывает дополнительной нагрузки на желудочно-кишечный тракт;
- не вызывает эффекта привыкания у болезнетворных микроорганизмов [12, 16, 19, 20].
D-манноза связывает E. coli, не позволяя ей прикрепляться к стенке слизистой оболочки. В свободном состоянии бактерии вымываются из организма вместе с током мочи или естественными выделениями, не образуя колоний и не вызывая инфекционного заражения. При этом бактерии вымываются только из той среды, для которой их присутствие нетипично. На микрофлору кишечника D-манноза не оказывает подобного влияния. В отличие от других сахаридов D-манноза не расщепляется в желудочно-кишечном тракте. Попадая в кровь, она концентрируется в почках, сохраняя первоначальную структуру, затем растворяется в моче и проникает в другие органы мочевыводящей системы [21, 22].
В европейских рандомизированных контролируемых исследованиях сравнивали эффективность и безопасность биологически активной добавки (БАД), содержащей D-маннозу (2 г), проантоцианидины (140 мг), урсоловую кислоту (7,89 мг) и комплекс витаминов (A, C, D), и проантоцианидинов в монорежиме (240 мг), назначаемых в профилактических целях в течение 24 недель (шесть месяцев) после эпизода острой инфекции мочевыводящих путей у женщин. Показано, что БАД, содержащая D-маннозу (per os), более эффективна в профилактике инфекций мочевыводящего тракта, чем проантоцианидины в монотерапии (240 мг ежедневно). При этом самым частым побочным эффектом оказалась диарея [11, 17].
В эксперименте на мышах показано, что пероральный прием D-маннозы блокирует прогрессирование начальной стадии сахарного диабета. Влияние D-маннозы в образовании регуляторных клеток достигается за счет активации трансформирующего фактора роста (ТФР-бета), одного из наиболее важных иммуносупрессивных цитокинов. Активация ТФР-бета в Т-клетках связана с двумя зависимыми, но комплементарными направлениями: интегрином αvβ8 и активными формами кислорода. Кроме того, D-манноза уже использовалась в лечении врожденных нарушений гликозилирования типа Ib. Бактериальная адгезия к слизистой оболочке, опосредованная фимбриями бактерий, является важным условием для развития инфекций мочеполовых путей. D-манноза, содержащаяся в моче в повышенной концентрации, при взаимодействии с адгезинами фимбрий блокирует адгезию уропатогенных бактерий в уротелий [14, 15, 17, 18, 21, 23, 24].
Полученные результаты подтверждают высокую эффективность D-маннозы в комбинации с традиционной антибактериальной терапией. Кроме того, D-манноза может способствовать снижению потребности в антибиотикотерапии у беременных.
Цель проведенного исследования – оценить эффективность D-маннозы в комплексной терапии у беременных с острым приступом хронического рецидивирующего неосложненного цистита.
Материал и методы
В проспективное рандомизированное сравнительное клиническое исследование в параллельных группах за период 2019–2021 гг. было включено 40 беременных (средний возраст – 29,3 ± 7,0 года) на сроке до 27 недель, обратившихся в акушерские отделения ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздрава России с острым приступом цистита и имевших в анамнезе рецидивы цистита вне беременности.
Критериями включения пациенток в исследование служили:
- возраст от 18 до 40 лет на момент включения в исследование;
- первый и второй триместры физиологически протекающей беременности;
- наличие в анамнезе хронического рецидивирующего неосложненного цистита, при появлении острого приступа сопровождавшегося двумя или более симптомами (боль в нижнем отделе живота при мочеиспускании, учащенное мочеиспускание, ложные позывы, чувство неполного опорожнения мочевого пузыря, жжение при мочеиспускании), лейкоцитурии по данным общего анализа мочи;
- два или более эпизодов острого приступа хронического рецидивирующего цистита в течение последних шести месяцев или три эпизода в течение последнего года;
- подписанное пациенткой письменное информированное согласие на участие в клиническом исследовании; готовность пациентки соблюдать все условия протокола исследования.
Все пациентки после рандомизации методом конвертов были разделены на две группы:
первая группа (n = 20): антибактериальный препарат (фосфомицина трометамол 3 г однократно или амоксициллина клавуланат 875 мг три раза в день в течение пяти дней) и БАД к пище Цистэль Пренатал (суточная доза содержит 913 мг D-маннозы, 187 мг (11 мг в пересчете на магний) магния оксида, капсула (желатин, диоксид титана)) по одной капсуле два раза в день во время еды в течение месяца. Затем чередование курсов терапии: две недели приема D-маннозы по одной капсуле два раза в день и две недели перерыва до родоразрешения;
вторая группа (n = 20): только антибактериальный препарат (фосфомицина трометамол 3 г однократно или амоксициллина клавуланат 875 мг три раза в день в течение пяти дней).
Критерием исключения являлся сопутствующий прием фитопрепаратов для лечения и профилактики цистита.
Всем беременным выполнялось полное клинико-лабораторное обследование: физикальное, лабораторное (общий анализ мочи, культуральное исследование мочи), определение жизненно важных функций (артериальное давление, частота сердечных сокращений, частота дыхательных движений, температура тела), уровня глюкозы крови натощак, а также плановые осмотры и обследования, предусмотренные приказом Министерства здравоохранения Российской Федерации от 1 ноября 2012 г. № 572н «Об утверждении Порядка оказания медицинской помощи по профилю „акушерство и гинекология“ (за исключением использования вспомогательных репродуктивных технологий)».
Особое внимание уделяли характеру субъективных жалоб, времени их появления, данным анамнеза, преморбидному фону, длительности заболевания, связи с факторами риска, сроком беременности, генеративной функции (паритету, количеству и весу ранее рожденных детей, особенностям родов (естественные или с помощью оперативных пособий), наличию сопутствующих родам осложнений), перенесенным урологическим и гинекологическим заболеваниям, анализу результатов ранее проведенной терапии, перенесенным операциям на органах малого таза, хроническим сопутствующим заболеваниям. Уточняли характер провоцирующих факторов.
Для определения наличия и выраженности лейкоцитурии, гематурии, цилиндрурии и примеси различных солей исследовали осадок мочи. Для этого у женщин собирали среднюю порцию утренней мочи и исследовали методом проточной цитофлюориметрии – технологии полупроводникового диодного лазера, позволяющей идентифицировать и подсчитывать флюоресцентно-меченные частицы в жидких средах. Автоматический анализатор осадка мочи UF-500i (1000i) (Sysmex corp., Япония), работающий по этому принципу, определяет уровни эритроцитов, лейкоцитов, количество эпителиальных клеток, цилиндров, кристаллов, бактерий с приблизительным разделением на грамотрицательные и грамположительные и грибов. Положительным результат считали при титре бактерий, по данным UF-500i, ≥ 104 КОЕ/мл и наличии лейкоцитов свыше 10 в мкл.
Для проведения посева мочи на флору и чувствительность к антибиотикам после туалета наружных половых органов пациентки самостоятельно собирали в стерильную пробирку среднюю порцию мочи – 3–5 мл. Исследование проводили классическим культуральным методом путем посева на питательные среды с последующей видовой идентификацией выделенных микроорганизмов методом времяпролетной MALDI-TOF-MS на масс-спектрометре AutoflexIII (Bruker, Германия) и по биохимическим показателям на автоматическом бактериологическом анализаторе Vitek2Compact (BioMerieux, Франция) с определением чувствительности к антибактериальным препаратам. Степень бактериурии не выше 103 КОЕ/мл, как правило, свидетельствовала об отсутствии воспалительного процесса и являлась результатом «контаминации» (за исключением случаев с наличием клинических симптомов цистита и лейкоцитурии, при повторном выделении микроорганизма из мочи после антибактериальной терапии). При степени бактериурии более 104 КОЕ/мл оценивали наличие клинических симптомов и лейкоцитарной реакции. Об истинной бактериурии говорили при росте микроорганизмов в титре 105 КОЕ/мл и выше.
Контрольное обследование пациенток проводили через 14 дней и три месяца после окончания приема антибактериальных препаратов. Далее до родоразрешения женщины находились под динамическим наблюдением.
Статистическая обработка полученных результатов выполнялась с помощью Microsoft Excel 2010 и стандартных пакетов программ (SPSS 23.0, Statistica for Windows 10). Количественные показатели с нормальным распределением представлены в виде среднего арифметического значения, стандартного отклонения, 95%-ного доверительного интервала. В случае несоответствия нормальному распределению количественные показатели представлены в виде медианы и интерквантильного разброса.
При сравнении количественных показателей для двух групп использовали критерий Стьюдента или непараметрический критерий Манна – Уитни.
Анализ статистической значимости различий качественных признаков проведен с помощью критерия Хи-квадрат Пирсона с поправкой Йейтса на непрерывность или точного критерия Фишера.
Статистически значимыми различия считались при р < 0,05.
Результаты
В соответствии с поставленной целью и задачами, 40 беременных прошли клинико-лабораторное обследование и получили лечение с применением антибактериальных препаратов и D-маннозы (Цистэль Пренатал).
Средний возраст включенных в исследование составил 29,3 ± 7,0 года, длительность заболевания превысила четыре года с рецидивами более четырех раз в год (табл. 1). Срок беременности на момент включения в исследование в первой группе составил 8,7 ± 6,0 недели, во второй – 11,9 ± 7,0 недели.
Интересно, что беременность в результате экстракорпорального оплодотворения наступила у 10% женщин первой группы и 31,3% – второй. Дебют заболевания большинство пациенток связывали с началом половой жизни. При этом каждая третья женщина первой группы и каждая пятая второй отмечали наследственный характер воспалительных заболеваний мочевыводящих путей (у матери или сестры).
При активном выявлении жалоб 14 (70%) женщин первой группы и 9 (45%) второй беспокоили патологические выделения из половых путей (р > 0,05).
В ходе опроса отмечались такие жалобы, как учащенное мочеиспускание, жжение и резь при мочеиспускании, ощущение неполного опорожнения мочевого пузыря, ургентные позывы, а также симптомы опорожнения: затрудненное начало мочеиспускания, напряжение при мочеиспускании, разбрызгивание струи мочи, прерывистое мочеиспускание, дриблинг. Статистически значимых различий между группами не установлено.
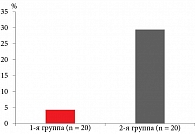
Посев мочи на флору и чувствительность к антибиотикам выполнялся всем пациенткам согласно клиническим рекомендациям. В нашем исследовании рост бактерий при культуральном исследовании обнаружен в 100% случаев. Структура микробной контаминации мочи представлена на рис. 1.
Масс-спектрометрию осадка мочи применяли для видовой идентификации культивированных микроогранизмов. Метод с высокой достоверностью идентифицировал микроорганизм при ≥ 104 КОЕ/мл. Так, в первой группе в 1 (5%) случае выявлен Streptococcus agalactiae, в 7 (35%) – E. сoli, в 7 (35%) – Enterococcus faecalis, в 4 (20%) – Klebsiella pneumoniae и в 1 (5%) – Str. haemolyticus. Во второй группе наиболее часто встречалась E. coli – 8 (40%) женщин. В 4 (20%) случаях обнаружен E. faecalis, в 3 (15%) – Staphylococcus epidermidis, в 2 (10%) – Enterobacter aerogenes и по одному случаю Acinetobacter haemolyticus (5%), K. pneumoniae (5%), S. aureus (5%) (рис. 1). Статистически значимых различий между группами не зафиксировано.
Согласно намеченному плану исследования и данным культурального исследования мочи с чувствительностью к антибактериальным препаратам, 6 (30%) беременных первой группы получали фосфомицин дважды на ночь, 14 (70%) – амоксициллина клавуланат 875 мг три раза в день в течение пяти дней и Цистэль Пренатал до родоразрешения. 17 (80%) женщин второй группы получали амоксициллина клавуланат 875 мг три раза в день в течение пяти дней и 3 (20%) женщины – фосфомицин дважды на ночь.
В обеих группах проводилось динамическое наблюдение через десять дней, три и шесть месяцев после лечения для клинико-лабораторного обследования и оценки количества и степени тяжести рецидивов.
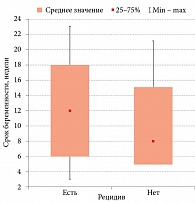
При динамическом наблюдении беременных до родоразрешения установлено снижение в первой группе (на фоне интермиттирующей терапии D-маннозой) количества рецидивов в шесть раз по сравнению со второй группой (рис. 2). При этом наибольшее число рецидивов пришлось на первый и второй триместры беременности (до 22 недель), что скорее всего обусловлено физиологическими изменениями мочеполовой системы беременной и состоянием относительной иммуносупрессии (рис. 3).
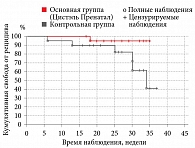
Кроме того, при регрессионном анализе методом Кокса – Мантеля выявлены статистически значимые различия количества рецидивов за период наблюдения до родоразрешения среди женщин, принимавших D-маннозу и не принимавших ее (Cox-Mantel Test p = 0,03637 или Cox's F-Test p = 0,00860) (рис. 4).
На визитах в период динамического наблюдения через три и шесть месяцев повторно проводилось культуральное исследование мочи с видовой идентификацией микроорганизма. В отличие от второй в первой группе отмечалось статистически значимое снижение бактериурии (табл. 2), что, вероятно, связано с антиадгезивным эффектом D-маннозы, способствующим выведению бактерий из мочевых путей. D-манноза в моче может связывать и выводить бактерии, такие как E. coli, конкурируя за адгезию E. coli к эпителиальным клеткам мочевого пузыря [14, 15, 17, 25].
Ни одного сколько-нибудь значимого нежелательного явления не зарегистрировано.
Кроме того, при динамическом исследовании уровня гликемии натощак и проведении орального одноэтапного глюкозотолерантного теста не выявлено отклонений от нормы.
Родоразрешение во всех случаях произошло в срок. В 15% случаев применено оперативное родоразрешение по акушерским показаниям. Вес новорожденных в обеих группах был сопоставим: в первой группе – 3124 ± 76 г, во второй – 3246 ± 92 г (р = 0,861).
Таким образом, прием D-маннозы ассоциируется с низким гликемическим индексом, не влияет на уровень гликемии натощак и безопасен у беременных.
Обсуждение
В терапии рецидивирующих циститов у беременных распространенной практикой является борьба с резистентностью E. coli методом коррекции антибактериальной терапии (увеличение дозы препарата и продолжительности лечения), а также с помощью активного выявления и лечения бессимптомной бактериурии. При этом бактерии приобретают большую устойчивость к антибиотикам широкого спектра действия. Штаммы E. coli колонизируют в норме уротелий с помощью ворсинок (пили) 1-го типа. Относительная иммуносупрессия во время беременности и инвазия на поверхности клеток мочевого пузыря обеспечивают E. coli защитой. В результате бактерии реплицируют, создавая бактериальный резервуар. В нем бактерии могут оставаться в течение нескольких недель в состоянии покоя. Они не обнаруживаются иммунной системой и защищены от антибиотиков.
Химическая структура D-маннозы позволяет абсорбировать бактерии E. coli. По мнению ряда зарубежных авторов, присутствие в моче достаточного количества D-маннозы позволяет связывать бактерии и не допускать колонизации слизистой оболочки мочевого пузыря.
В нашем исследовании впервые сравнивались два разных подхода к профилактике и лечению рецидивирования циститов у беременных. В первой группе после стандартной антибактериальной терапии женщины получали интермиттирующую терапию D-маннозой на протяжении всей беременности, во второй – только курс антибиотиков. Показаны высокая эффективность и переносимость D-маннозы у беременных, а также отсутствие ее влияния на уровень гликемии натощак и вес плода.
В перспективе научные и клинические исследования должны быть продолжены на больших выборках для подтверждения эффективности и безопасности D-маннозы.
Заключение
В рамках нашего исследования во время динамического наблюдения и профилактического приема D-маннозы на протяжении всей беременности показана эффективность D-маннозы в предупреждении рецидивов цистита у беременных. Частота рецидивов у женщин, принимавших D-маннозу в профилактических целях, была существенно ниже, чем у беременных, не получавших ее.
Для валидации результатов данного исследования необходимы дальнейшие многоцентровые исследования. Тем не менее первоначальные результаты свидетельствуют об эффективности и безопасности D-маннозы в предупреждении рецидивов цистита у беременных.
Авторы заявляют об отсутствии конфликта интересов.
T.A. Teterina, PhD, M.P. Ishchuk, I.A. Apolikhina, PhD, Prof.
V.I. Kulakov National Medical Research Center for Obstetrics, Gynecology and Perinatology
N.N. Burdenko Voronezh State Medical University
I.M. Sechenov First Moscow State Medical University
Contact person: Tatyana A. Teterina, palpebra@inbox.ru
Objective – to evaluate the therapeutic effectiveness of D-mannose in complex therapy in pregnant women with an acute attack of chronic recurrent uncomplicated cystitis.
Material and methods. For 2019–2021, the study included 40 pregnant women (average age – 29.3 ± 7.0 years) at up to 27 weeks with an acute attack of cystitis and the history of recurrent cystitis without pregnancy. After the complete clinical and laboratory examination, all patients were divided into two groups. 20 patients of the first group took an antibacterial drug (fosfomycin trometamol 3 g once or amoxicillin clavulanate 875 mg three times a day for five days) and D-mannose in intermittent mode before delivery, 20 patients of the second group – only an antibacterial drug.
Results. During the dynamic observation of pregnant women before delivery in the first group against the background of intermittent therapy with D-mannose, 6-fold decrease in the level of relapses was recorded compared to the second group. The greatest number of relapses occurred in the first and second trimesters (up to 22 weeks), which is most likely due to physiological changes in the urogenital system of pregnant women and the state of relative immunosuppression.
Conclusions. The results of dynamic observation and prophylactic administration of D-mannose throughout pregnancy showed the effectiveness of D-mannose in preventing relapses of cystitis in pregnant women. The relapse rate in those who took D-mannose as a prophylaxis was significantly lower than in pregnant women who did not receive this drug. To validate the results of this study further multicenter studies are in need. However, initial findings suggest the efficacy and safety of D-mannose in preventing recurrent cystitis in pregnant women.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.