Старт инъекционной терапии с фиксированной комбинации аналога базального инсулина и агониста рецептора глюкагоноподобного пептида 1 как новая возможность достижения целей терапии сахарного диабета 2 типа
- Аннотация
- Статья
- Ссылки
- English
В ряде исследований, в том числе в условиях реальной клинической практики, продемонстрировано преимущество концепции одномоментной инициации терапии базальным инсулином и арГПП-1 перед последовательным назначением указанных препаратов.
В статье представлен обзор исследований эффективности и безопасности комбинации базального инсулина и арГПП-1, а также исследований фиксированной комбинации инсулина гларгин и ликсисенатида на старте инсулинотерапии.
В ряде исследований, в том числе в условиях реальной клинической практики, продемонстрировано преимущество концепции одномоментной инициации терапии базальным инсулином и арГПП-1 перед последовательным назначением указанных препаратов.
В статье представлен обзор исследований эффективности и безопасности комбинации базального инсулина и арГПП-1, а также исследований фиксированной комбинации инсулина гларгин и ликсисенатида на старте инсулинотерапии.

Сахарный диабет (СД) 2 типа представляет собой хроническое прогрессирующее заболевание, характеризующееся нарастанием гипергликемии и необходимостью постепенной интенсификации терапии для достижения и поддержания гликемического контроля [1, 2].
Несмотря на все большее распространение инновационных опций, широкое применение комбинаций различных пероральных сахароснижающих препаратов (ПССП) и/или инъекционных сахароснижающих препаратов, у существенной части пациентов не удается достичь целевых значений гликемического контроля. Так, в ряде исследований, проведенных в Европе и США, показано, что уровень гликированного гемоглобина (HbA1c) 7% и менее достигается в 60–70% случаев [3, 4]. Согласно результатам международного многоцентрового наблюдательного неинтервенционного исследования IDMPS, проводившегося с 2005 по 2017 г. в развивающихся странах, лишь у 30–38% больных удается достичь уровня HbA1c менее 7%. Доля пациентов с уровнем HbA1c менее 7% на инсулинотерапии составляет менее 30% [5]. Аналогичная ситуация отмечается и в России [6]. В опубликованном в 2020 г. анализе динамического мониторинга качества контроля углеводного обмена у пациентов с СД 2 типа отмечено, что при наличии явных положительных тенденций по сравнению с данными 2005–2010 гг. целевого уровня HbA1c в среднем достигают 24,7% [7].
Одной из причин сложившейся ситуации является терапевтическая инерция, то есть отсутствие интенсификации лечения при недостижении целей гликемического контроля [5]. При анализе базы данных исследований реальной клинической практики британские ученые установили, что у пациентов с СД 2 типа неудовлетворительный контроль гликемии в среднем сохранялся на протяжении семи лет до интенсификации терапии ПССП или инсулином [8, 9]. На момент интенсификации лечения среднее значение HbA1c составило 9,7%. Согласно результатам исследования IDMPS, в реальной клинической практике время до начала лечения инсулином после постановки диагноза варьировалось от 8,5 до 10 лет [5].
В то же время установлено, что отсрочка с интенсификацией терапии повышает риск развития поздних осложнений СД 2 типа и, как следствие, расход ресурсов здравоохранения [10, 11].
Анализ данных, проведенный K. Khunti и соавт., свидетельствует, что у пациентов с уровнем HbA1c 7% и более через 5,3 года существенно повышался риск развития сердечно-сосудистых заболеваний: инфаркта миокарда на 67%, инсульта на 51%, сердечной недостаточности на 64% и композитного риска неблагоприятных сердечно-сосудистых событий на 62% [12].
Как показал анализ британской базы данных CPRD, у большинства пациентов с уровнем HbA1c 9% и более, не достигших целей терапии на фоне применения ПССП, интенсификация терапии с применением только базального инсулина или агониста рецептора глюкагоноподобного пептида 1 (арГПП-1) чаще всего не приводила к целевым результатам [13]. Кумулятивная вероятность достижения уровня HbA1c менее 7% в течение шести месяцев составила 13% при старте инъекционной терапии с арГПП-1 (n = 5583) и 10% при старте с базального инсулина (n = 5606). Анализ британской базы данных THIN также продемонстрировал низкую вероятность (менее 35%) достижения уровня HbA1c менее 7,5% у взрослых больных СД 2 типа, переведенных с ПССП на терапию предварительно смешанными инсулинами [14].
Изложенные данные обусловливают актуальность поиска новых решений в управлении СД 2 типа, позволяющих достигать целевых значений гликемии у большей доли пациентов.
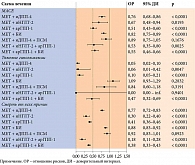
В связи со сказанным выше особый интерес представляют результаты работы M.H. Jensen и соавт. [15]. Ученые пытались выявить наиболее оптимальную комбинацию сахароснижающих препаратов, сравнивая риски развития серьезных сердечно-сосудистых событий, тяжелой гипогликемии и смерти от всех причин. Оценивались такие широко используемые схемы терапии, как метформин (МЕТ) с производными сульфонилмочевины (ПСМ), метформин с ингибитором дипептидилпептидазы 4 (иДПП-4), метформин с ингибитором натрий-глюкозного котранспортера 2 (иНГЛТ-2), метформин с арГПП-1, метформин с базальным инсулином (БИ), метформин в сочетании с иДПП-4 и ПСМ, а также с иНГЛТ-2 и арГПП-1 и с арГПП-1 и базальным инсулином.
В отношении опций, включающих базальный инсулин, установлено преимущество комбинации «метформин + арГПП-1 + базальный инсулин» перед комбинацией «метформин + базальный инсулин» по всем трем параметрам (рис. 1) [15]. Необходимо отметить, что в качестве референс-терапии была выбрана комбинация «метформин + ПСМ».
За последние годы накопилась значительная доказательная база о превосходстве одномоментного старта с двух и более сахароснижающих препаратов над последовательным добавлением терапевтических опций. Это касается и различных вариантов комбинаций ПССП (метформина и иНГЛТ-2, иНГЛТ-2 и иДПП-4, метформина и иДПП-4) [16–18].
Так, в исследовании VERIFY сравнивали долгосрочные эффекты инициации лечения сразу с комбинации метформина и вилдаглиптина и только с метформина. При применении ранней комбинированной сахароснижающей терапии риск утраты гликемического контроля снижался на 50% [18].
В 2020 г. были опубликованы результаты работы X.V. Peng и соавт. [19]. Ученые проанализировали американскую базу данных REACHnet с целью оценки эффективности различных вариантов интенсификации терапии у пациентов с СД 2 типа, которые не смогли достичь целевого уровня HbA1c при использовании ПССП. Пациенты были разделены на три когорты: первая – одномоментно стартовавшие с терапии базальным инсулином и арГПП-1, вторая – сначала применявшие базальный инсулин, к которому был добавлен арГПП-1 на срок 90 дней, третья – начавшие получать базальный инсулин, а потом, спустя 90 дней, еще и арГПП-1. Вероятность достижения уровня HbA1c менее 7% через 12 месяцев была наибольшей в первой когорте – 33,4%. Во второй когорте данный показатель составил 24,5%. Наименьшим он оказался в третьей когорте – 20,9%. Статистически значимая разница обнаружена между первой и третьей когортами (p = 0,0186). Среднее наблюдаемое снижение значений уровня HbA1c за 12 месяцев было наибольшим в первой когорте (-1,7 ± 2,2%), далее во второй (-1,5 ± 2,5%) и третьей (-1,3 ± 2,4%).
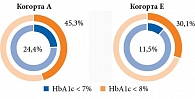
В определенной степени продолжением идеологии данного исследования был ретроспективный анализ данных рутинной клинической практики, проведенный J. Rosenstock и соавт. [20]. Согласно полученным результатам, одновременная инициация лечения с базального инсулина и арГПП-1 превосходила по эффективности последовательное добавление данных опций. Первоначально для проведения анализа были отобраны 6 млн записей о пациентах с исходным уровнем HbA1c более 9%, которые стартовали с базального инсулина и арГПП-1 в любой последовательности. В качестве исследуемого был выбран период с января 2011 г. по июнь 2017 г. Далее были отобраны 6,5 тыс. анкет с достаточно полными записями, которые и были включены в анализ. В зависимости от количества дней между стартом с базального инсулина и стартом с арГПП-1 сформированы пять когорт пациентов: A – менее 30 дней, B – 31–90 дней, C – 91–180 дней, D – 181–270 дней, E – 271–360 дней. Когорту А исследователи назвали когортой одновременного старта терапии, а когорты В, С, D и E – когортами последовательного старта.
Исходные демографические и клинические характеристики пациентов в когортах были схожими.
Высокий исходный уровень HbA1c (10,5–10,9%) подтверждал наличие клинической инерции.
Пациенты, которые начинали две инъекционные опции в разные дни, с меньшей вероятностью достигали целей гликемического контроля, чем те, кто стартовал сразу с обеих опций (рис. 2 и 3). При этом вероятность достижения HbA1c менее 7% была выше у тех, кто получал оба препарата в диапазоне 30 дней, и менее, чем у тех, кто применял их в диапазоне 91 день и более, независимо от того, с чего именно начиналась последовательная терапия.
J. Rosenstock и соавт. сделали вывод, что наиболее эффективным для пациентов с СД 2 типа на терапии ПССП и уровнем HbA1c более 9% является одномоментный старт с базального инсулина и арГПП-1, а не ожидание эффекта от одной из этих опций [20].
Представленные выше данные подтверждают целесообразность использования фиксированных комбинаций базального инсулина и арГПП-1. К преимуществам подобных комбинаций можно отнести и удобство применения (одна инъекция один раз в сутки), привычный (как у базальных инсулинов) режим подбора дозы. При этом такая терапия не сопровождается увеличением риска развития гипогликемии и массы тела по сравнению с применением только инсулина [21].
В международных (консенсусы Американской диабетической ассоциации и Европейской ассоциации по изучению диабета) и российских рекомендациях 2018 г. указано на возможность старта инъекционной сахароснижающей терапии с фиксированной комбинации инсулина и арГПП-1. При этом в международных консенсусах указано на целесообразность использования данной опции при уровне HbA1c выше целевого значения на 2% и более [21], в российских рекомендациях таких ограничений нет [1].
Фиксированная комбинация инсулина гларгин 100 ЕД/мл и ликсисенатида1 выпускается в предварительно заполненных шприц-ручках двух видов [22]:
шприц-ручка 10-40 (желтого цвета) содержит 100 ЕД/мл инсулина гларгин и 50 мкг/мл ликсисенатида и позволяет вводить от 10 до 40 ЕД препарата;
шприц-ручка 30-60 (оливкового цвета) содержит 100 ЕД/мл инсулина гларгин и 33 мкг/мл ликсисенатида и позволяет вводить от 30 до 60 ЕД препарата.
Применение фиксированной комбинации инсулина гларгин 100 ЕД/мл и арГПП-1 ликсисенатида изучалось в трех рандомизированных клинических исследованиях. Параметры эффективности и безопасности были проанализированы у пациентов, не достигших целей терапии на ПССП [23], комбинации базального инсулина и ПССП [24] либо комбинации арГПП-1 и ПССП [25].
Субанализ результатов исследования LixiLan-O у пациентов с исходным уровнем HbA1c 9% и более показал, что значений менее 7% удалось достичь у 74% получавших фиксированную комбинацию гларгина и ликсисенатида и у 47 и 0% применявших инсулин гларгин и ликсисенатид соответственно [26].
В 2018 г. J. Rosenstock и соавт. провели непрямое (методом подбора пар) сравнение параметров эффективности и безопасности фиксированной комбинации инсулина гларгин и ликсисенатида (из серии исследований LixiLan) и свободной комбинации инсулина гларгин и ликсисенатида (из серии исследований GetGoal) [27]. Подобный анализ стал возможен благодаря сходству популяций и дизайнов клинических исследований.
Сопоставление показателей соответствия проводилось в каждой сравниваемой группе на основании возраста, расы, индекса массы тела, уровня HbA1c, глюкозы плазмы натощак, длительности СД и применения ПССП.
Установлено, что использование фиксированной комбинации инсулина гларгин и ликсисенатида приводило к большему снижению уровня HbA1c (p < 0,0001), чем применение свободной комбинации инсулина гларгин и ликсисенатида (на 1,3 и 0,7% соответственно при сравнении результатов исследований LixiLan-O и GetGoal Duo-1) [27]. Доля пациентов, достигших уровня HbA1c менее 7%, в группе фиксированной комбинации была достоверно больше, чем в группе свободной комбинации инсулина гларгин и ликсисенатида, – 79 и 51% соответственно (p < 0,0001) [27]. При применении фиксированной комбинации улучшение показателей гликемического контроля сопровождалось меньшим числом нежелательных явлений со стороны желудочно-кишечного тракта, что обусловлено более постепенной титрацией дозы ликсисенатида. В исследованиях LixiLan-O и GetGoal Duo-1 тошнота и рвота встречались в 9,2 и 1,1% случаев соответственно при применении фиксированной комбинации и в 20,7 и 10,3% при использовании свободной комбинации инсулина гларгин и ликсисенатида [27].
К концу клинических исследований существенно различались и дозы инсулина гларгин. Так, в исследованиях LixiLan-O и GetGoal Duo-1 его доза составила 29 ЕД в фиксированной комбинации и 55 ЕД в свободной комбинации [27].
Более выраженный сахароснижающий эффект фиксированной комбинации инсулина гларгин и ликсисенатида не сопровождался увеличением частоты гипогликемий и массы тела [27].
Таким образом, как в рандомизированных клинических исследованиях, так и в исследованиях реальной клинической практики продемонстрировано преимущество концепции одномоментной инициации терапии базальным инсулином и арГПП-1 перед последовательным назначением указанных опций. Данный подход высокоэффективен в достижении целей гликемического контроля, при этом безопасен с точки зрения риска развития гипогликемических состояний и увеличения массы тела.
Своевременная инициация инъекционной терапии фиксированными комбинациями базального инсулина и арГПП-1 способна значимо улучшить параметры гликемического контроля и изменить ситуацию с достижением целей терапии СД 2 типа.
1 В России зарегистрирована под торговым наименованием Соликва СолоСтар®.
N.A. Demidov, PhD
Moscovskii city Hospital, Department of Healthcare of Moscow
Contact person: Nikolay A. Demidov, nicolay13@mail.ru
An important characteristic of type 2 diabetes mellitus (T2DM) is the progressive nature of this chronic disease. With the increase in the duration of type 2 diabetes, the need for intensification of antihyperglycemic therapy, which could help to achieve and maintain glycemic parameters within the target values, also grows. A significant proportion of patients with T2DM today do not reach the target glycemic values even with the use of the most effective antihyperglycemic treatment options: insulin therapy and glucagon-like peptide 1 receptor analogue (GLP-1 RA). A number of analyzes, including RWE that have appeared in the international literature in recent years, have demonstrated the advantages of the concept of simultaneous initiation of therapy with basal insulin
and GLP-1 RA in comparison with the sequential initiation of these options for injectable glucose-lowering therapy. The article provides an overview of studies of the efficacy and safety parameters of a combination of basal insulin and GLP-1 RA, as well as clinical studies of a fixed combination of insulin glargine and lixisenatide for starting insulin therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


