Комбинированная инъекционная терапия как опция интенсификации инсулинотерапии у пациентов с сахарным диабетом 2 типа
- Аннотация
- Статья
- Ссылки
- English
Применение базального инсулина при правильной титрации дозы позволяет достичь целевой гликемии натощак, но практически не оказывает влияния на постпрандиальную гликемию. Для коррекции постпрандиальной гипергликемии требуется интенсификация лечения. В этой связи представляется перспективным использование фиксированных комбинаций базального инсулина и агонистов рецепторов глюкагоноподобного пептида 1 (арГПП-1). Фиксированные комбинации базального инсулина и арГПП-1 можно рассматривать в качестве опции как для старта инсулинотерапии, так и для ее интенсификации, поскольку арГПП-1 позволяют снизить постпрандиальную экскурсию глюкозы, сдержать увеличение массы тела, минимизировать количество инъекций и уменьшить риск гипогликемии.
В настоящее время в мире доступны две фиксированные комбинации базального инсулина и арГПП-1: «инсулин гларгин + ликсисенатид» и «инсулин деглудек + лираглутид». За счет комплементарного механизма действия они влияют на 7 из 11 патофизиологических дефектов, приводящих к развитию СД 2 типа. Простая схема назначения и титрации дозы обеспечивает приверженность пациентов лечению.
В статье представлены данные исследований эффективности и безопасности фиксированной комбинации инсулина гларгин и ликсисенатида, подтверждающие преимущество последней перед применением каждого ее компонента в отдельности, сравнительного исследования эффективности фиксированных комбинаций «инсулин гларгин + ликсисенатид» и «инсулин деглудек + лираглутид». Приводится клинический случай успешного использования комбинации «инсулин гларгин + ликсисенатид» у пациентки с СД 2 типа.
Применение базального инсулина при правильной титрации дозы позволяет достичь целевой гликемии натощак, но практически не оказывает влияния на постпрандиальную гликемию. Для коррекции постпрандиальной гипергликемии требуется интенсификация лечения. В этой связи представляется перспективным использование фиксированных комбинаций базального инсулина и агонистов рецепторов глюкагоноподобного пептида 1 (арГПП-1). Фиксированные комбинации базального инсулина и арГПП-1 можно рассматривать в качестве опции как для старта инсулинотерапии, так и для ее интенсификации, поскольку арГПП-1 позволяют снизить постпрандиальную экскурсию глюкозы, сдержать увеличение массы тела, минимизировать количество инъекций и уменьшить риск гипогликемии.
В настоящее время в мире доступны две фиксированные комбинации базального инсулина и арГПП-1: «инсулин гларгин + ликсисенатид» и «инсулин деглудек + лираглутид». За счет комплементарного механизма действия они влияют на 7 из 11 патофизиологических дефектов, приводящих к развитию СД 2 типа. Простая схема назначения и титрации дозы обеспечивает приверженность пациентов лечению.
В статье представлены данные исследований эффективности и безопасности фиксированной комбинации инсулина гларгин и ликсисенатида, подтверждающие преимущество последней перед применением каждого ее компонента в отдельности, сравнительного исследования эффективности фиксированных комбинаций «инсулин гларгин + ликсисенатид» и «инсулин деглудек + лираглутид». Приводится клинический случай успешного использования комбинации «инсулин гларгин + ликсисенатид» у пациентки с СД 2 типа.


Введение
В 2019 г. количество больных сахарным диабетом (СД) в мире достигло 463 млн, преимущественно за счет пациентов с СД 2 типа [1]. Согласно результатам крупномасштабного эпидемиологического исследования NATION, в Российской Федерации распространенность СД 2 типа составляет 5,4% [2]. С учетом количества населения в возрасте от 20 до 79 лет это более 6 млн [2].
Сложность механизма развития СД 2 типа предопределяет основные цели лечения. Таковыми являются обеспечение оптимального контроля показателей углеводного и липидного обмена, снижение риска развития гипогликемических состояний, предупреждение или замедление прогрессирования поздних осложнений.
Естественное течение заболевания, связанное с прогрессирующим снижением массы β-клеток поджелудочной железы, со временем затрудняет поддержание целевых параметров глюкозы в крови и гликированного гемоглобина (НbА1с) с помощью пероральных сахароснижающих препаратов (ПССП). Менее 50% пациентов могут поддерживать адекватный контроль гликемии на монотерапии ПССП через три года после манифестации диабета. Через девять лет только 25% достигают целей терапии [3]. Этим объясняется необходимость интенсификации лечения – за счет увеличения либо дозы препарата, либо количества препаратов (двух или трех) [4].
Считается, что при недостижении целевой гликемии на фоне применения двух ПССП показана инициация терапии инсулином или агонисты рецепторов глюкагоноподобного пептида 1 (арГПП-1), но не добавление третьего перорального препарата [5]. В то же время включение инсулина в состав комбинированной терапии ПССП усложняет схему лечения и снижает качество жизни больных. Речь, в частности, идет о необходимости правильной титрации дозы, повышении риска развития симптоматических и бессимптомных гипогликемий, отеков, увеличения массы тела. Повторные гипогликемии ассоциируются с развитием микро- и макрососудистых осложнений, тяжелые гипогликемии – с высоким риском развития сосудистых катастроф [6]. Поэтому внедрение в клиническую практику эффективных и безопасных инновационных препаратов с минимальным риском развития гипогликемических состояний и дополнительными эффектами приобретает особую значимость.
Общая стратегия лечения сахарного диабета 2 типа
В настоящее время выработана общая стратегия лечения СД 2 типа – консенсус Американской диабетической ассоциации и Европейской ассоциации по изучению диабета 2019 г. [7]. Аналогичный документ разработан и в России.
Согласно национальным алгоритмам, стратификация лечебной тактики осуществляется в зависимости от того, насколько уровень НbА1с превышает целевой. Эффективность терапии оценивается по соответствию достигнутого уровня НbА1с целевому. При необходимости проводится интенсификация терапии.
В рутинной клинической практике препаратом первой линии считается метформин [8].
Интенсификация терапии или же ее инициация при высоких показателях гликемии чаще всего осуществляется за счет добавления других ПССП (комбинация двух-трех препаратов) и препаратов инсулина.
Инициация и интенсификация инсулинотерапии
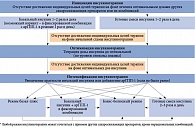
Инсулин является самым мощным сахароснижающим препаратом. Общие рекомендации по началу, оптимизации и интенсификации инсулинотерапии при СД представлены на рисунке.
Выбор режима инициации и интенсификации инсулинотерапии зависит от особенностей течения СД 2 типа и образа жизни больного (табл. 1).
В России около 5% пациентов с СД 2 типа получают монотерапию инсулином. До 11% находятся на комбинированной терапии инсулином пролонгированного действия и ПССП. Примерно 40% больных СД 2 типа, получающих базальный инсулин в комбинации с пероральными антидиабетическими препаратами или без них, достигают целевого уровня НbА1с. Большинству для достижения целей лечения требуется его интенсификация (табл. 2).
Необходимо отметить, что классический подход к ведению таких пациентов предполагает добавление прандиального инсулина один – три раза в день или переход на готовые смеси инсулина. Однако такой вариант более сложный для пациентов. Он требует увеличения количества инъекций, более частого самоконтроля. Кроме того, повышается риск развития гипогликемических состояний и увеличения массы тела.
Для многих пациентов, нуждающихся в интенсификации, такая схема неприемлема.
Фиксированные комбинации инсулина и агонистов рецепторов ГПП-1
Идеальными для комбинирования с базальным инсулином являются арГПП-1. Длительно действующие арГПП-1 (дулаглутид, лираглутид, семаглутид, эксенатид пролонгированного действия) в основном влияют на показатели гликемии натощак, короткодействующие (ликсисенатид, эксенатид) – на постпрандиальную гликемию. К преимуществам данных препаратов следует отнести простой режим титрации дозы, эффективность в снижении гликемии без увеличения риска развития гипогликемии и набора массы тела.
В настоящее время в арсенале врачей есть две фиксированные комбинации инсулина и арГПП-1: «инсулин деглудек + лираглутид», «инсулин гларгин + ликсисенатид». Режим введения – один раз в день.
Указанные выше комбинации можно использовать в качестве дополнения к монотерапии метформином, или к комбинированной терапии метформином с другим пероральным сахароснижающим препаратом, или монотерапии базальным инсулином у взрослых пациентов с СД 2 типа.
Фиксированная комбинация инсулина гларгин и ликсисенатида
Фиксированная комбинация инсулина гларгин и ликсисенатида выпускается в предварительно заправленных шприц-ручках двух видов:
- шприц-ручка 10-40 (желтого цвета) содержит 100 ЕД/мл инсулина гларгин и 50 мкг/мл ликсисенатида и позволяет вводить от 10 до 40 ЕД препарата;
- шприц-ручка 30-60 (оливкового цвета) содержит 100 ЕД/мл инсулина гларгин и 33 мкг/мл ликсисенатида и позволяет вводить от 30 до 60 ЕД препарата.
Фиксированной комбинации инсулина гларгин и ликсисенатида было посвящено два крупнейших клинических исследования. В исследовании LixiLan-O сравнивались эффективность и безопасность фиксированной комбинации с эффективностью и безопасностью ликсисенатида или инсулина гларгин [9]. В исследовании приняло участие 1170 пациентов с СД 2 типа, не достигших целей на терапии метформином или его комбинации с другим пероральным сахароснижающим препаратом в течение 30 недель. Фиксированная комбинация инсулина гларгин и ликсисенатида существенно превосходила по данным показателям ликсисенатид и инсулин гларгин.
В многоцентровом открытом рандомизированном контролируемом исследовании LixiLan-L [10] оценивались эффективность и безопасность фиксированной комбинации инсулина гларгин и ликсисенатида у взрослых пациентов с СД 2 типа с неадекватным контролем заболевания на фоне применения базального инсулина от 15 до 40 ЕД в комбинации с метформином или без него. В исследовании приняло участие 736 пациентов. Период активного контроля составил 30 недель.
Пациенты были рандомизированы на группы в соотношении 1:1. Первая группа (n = 369) получала инсулин гларгин, вторая (n = 367) – фиксированную комбинацию инсулина гларгин и ликсисенатида. В качестве первичной конечной точки для оценки эффективности выбрано снижение уровня НbА1с относительно исходного. Вторичные конечные точки эффективности включали изменение массы тела, глюкозы плазмы натощак и двухчасовой экскурсии глюкозы. Дополнительные показатели для оценки эффективности – доля пациентов, достигших НbА1с < 7,0 и ≤ 6,5%, изменение качества жизни по опроснику EuroQoL 5-Dimensions (EQ-5D) и влияние веса на качество жизни (IWQoL-Lite). Безопасность лечения оценивалась по таким критериям, как смерть вследствие терапии, нежелательные явления, серьезные нежелательные явления, доля отказавшихся от лечения, частота гипогликемических состояний, иммуногенность и развитие панкреатита.
На 30-й неделе уровень НbА1с в группе фиксированной комбинации уменьшился на 1,13% (стандартное отклонение (СО) 0,057%), в группе инсулина гларгин – на 0,62% (СО 0,055%). Пациенты, получавшие фиксированную комбинацию, достигли среднего значения НbА1с 6,94% (СО 0,87%), инсулин гларгин – 7,48% (СО 0,91%). Разница между группами лечения составила -0,52% при 95%-ном доверительном интервале (ДИ) -0,633– -0,397, и эта разница оказалась статистически значимой (р < 0,0001). В группе фиксированной комбинации доля пациентов, достигших НbА1с < 7,0% на 30-й неделе, была больше, чем в группе инсулина гларгин, – 54,9 против 29,6% соответственно. Аналогичный результат отмечен в отношении достигших НbА1с ≤ 6,5% к окончанию исследования – 33,9 против 14,2% соответственно. У пациентов, получавших фиксированную комбинацию, также наблюдалось статистически значимо большее снижение двухчасовой экскурсии плазмы – в среднем -3,43 ммоль/л (95% ДИ -3,925– -2,939; р < 0,0001). Через 30 недель достоверной разницы в изменении уровня глюкозы плазмы натощак между группами не зафиксировано – в среднем 0,11 ммоль/л (95% ДИ -0,207–0,428; р = 0,4951).
К 30-й неделе масса тела в группе фиксированной комбинации в среднем уменьшилась на 0,67 кг, в группе инсулина гларгин, наоборот, увеличилась на 0,70 кг. Между группами была получена статистически значимая разница – -1,37 кг (95% ДИ -1,808– -0,930; р < 0,0001).
Количество сообщивших о каких-либо побочных реакциях в группах терапии было одинаковым – 53,4% среди получавших фиксированную комбинацию и 52,3% среди применявших инсулин гларгин. Аналогичная тенденция прослеживалась в отношении серьезных нежелательных реакций – 5,5 против 4,9%. Наиболее часто регистрируемыми побочными эффектами в группе фиксированной комбинации были тошнота (10,4 и 0,5% соответственно), головная боль (5,8 и 2,7%), диарея (4,4 и 2,7%) и рвота (3,6 и 0,5%). Частота отмены препарата из-за серьезных нежелательных реакций была низкой в обеих группах (менее 3,0%). Однако в группе фиксированной комбинации данный показатель был выше – 2,7 против 0,8%. Наиболее частой причиной отмены фиксированной комбинации стала тошнота (1,1%).
В ходе исследования было три смертельных исхода: один в группе фиксированной комбинации, два в группе инсулина гларгин. Причиной смерти в первом случае была пневмония, в двух вторых – сердечно-легочная недостаточность и рак желчного пузыря.
Частота документированной симптоматической гипогликемии (событие с типичными симптомами гипогликемии при уровне глюкозы в плазме крови ≤ 3,9 ммоль/л) для группы фиксированной комбинации составила 40,0%, для группы инсулина гларгин – 42,5%. Однако частота случаев развития тяжелой гипогликемии была выше в группе фиксированной комбинации – 1,1 против 0,3%.
Аллергические реакции либо вообще не отмечались, либо отмечались крайне редко. Таковые зафиксированы только в группе инсулина гларгин (0,3%).
В исследовании не было зарегистрировано ни одного случая возникновения панкреатита.
Кроме того, отмечено удобство использования в одной инъекции сразу двух препаратов.
В качестве варианта интенсификации инсулинотерапии фиксированная комбинация инсулина и арГПП-1 может быть рекомендована пациентам с СД 2 типа при неэффективности терапии базальным инсулином в комбинации с разными ПССП и до начала введения болюсного инсулина.
Необходимо отметить, что подбор дозы фиксированной комбинации инсулина гларгин и ликсисенатида, согласно зарегистрированной инструкции, проводится так же, как подбор дозы любого базального инсулина, – по уровню гликемии плазмы натощак.
Не меньший интерес представляет сравнение эффектов представленных выше фиксированных комбинаций. Так, в независимый анализ для непрямого сравнения эффективности фиксированной комбинации инсулина гларгин и ликсисенатида с эффективностью фиксированной комбинации инсулина деглудек и лираглутида было включено восемь клинических исследований данных препаратов. Абсолютное изменение уровня HbA1c относительно исходного в группе «инсулин гларгин + ликсисенатид» составило -1,50% (95% ДИ -1,89– -1,12%; р < 0,01), в группе «инсулин деглудек + лираглутид» – -1,89% (95% ДИ -2,04– -1,73%; р < 0,01). Существенных различий между применением данных препаратов не выявлено. Масса тела при применении комбинации «инсулин гларгин + ликсисенатид» уменьшилась на 0,62 кг (95% ДИ -0,93– -0,31; р < 0,01), комбинации «инсулин деглудек + лираглутид» – на 0,81 кг (95% ДИ -3,26– -1,65; р = 0,52). Разница между группами терапии оказалась незначимой [11].
Опыт применения
Пациентка 56 лет. СД 2 типа развился на фоне ожирения. Длительность СД – восемь лет. Рекомендована диета с ограничением жиров и углеводов в комбинации с метформином в дозе 1500 мг/сут.
В течение последних трех лет принимала метформин в дозе 2000 мг/сут в комбинации с глибенкламидом (микронизированная форма) в дозе 7 мг/сут и инсулином гларгин 300 ЕД/мл (32 ЕД перед сном). Контроль гликемии осуществляла один раз в две недели. Гликемия плазмы натощак – 7–10 ммоль/л, постпрандиальная гликемия – до 15 ммоль/л.
Сопутствующие заболевания: неалкогольная жировая болезнь печени, артериальная гипертензия в течение десяти лет. Постоянно принимает ингибиторы ангиотензинпревращающего фермента в сочетании с блокаторами кальциевых каналов. Часто обостряется пиелонефрит. Три года назад проведена холецистэктомия. Аллергических реакций не отмечено. Наследственная отягощенность в отношении ожирения и СД 2 типа по материнской линии.
Проведены биохимические и гормональные исследования. Учитывалось количество подтвержденных симптоматических и бессимптомных гипогликемий. При осмотре офтальмологом – глазное дно без патологии.
С учетом возраста пациентки, длительности СД 2 типа, отсутствия тяжелых осложнений установлено целевое значение HbA1c менее 7,0%.
Рекомендовано интенсифицировать терапию фиксированной комбинацией инсулина гларгин и ликсисенатида. Согласно инструкции для медицинского применения, стартовая доза препарата составила 20 ЕД в шприц-ручке 10-40. Время инъекции также было выбрано в соответствии с инструкцией – перед приемом пищи, содержащим максимальное количество углеводов. В данном случае – в течение часа перед ужином (обычно в 18.00).
При проведении самоконтроля максимальные показатели гликемии пациентка регистрировала через два часа после ужина. Глибенкламид был отменен.
Длительность наблюдения за пациенткой составила шесть месяцев.
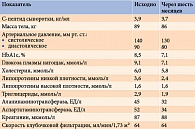
Динамика показателей на фоне терапии представлена в табл. 3.
Доза препарата через шесть месяцев составила 32 ЕД. За указанный период уровень НbА1с уменьшился на 1,4%, масса тела – на 3 кг. Снижение массы тела – дополнительный фактор, способствующий улучшению гликемии. Артериальное давление составило 130/80 мм рт. ст.
За время наблюдения зафиксировано четыре эпизода гипогликемии, связанных с физической активностью.
Переносимость лечения хорошая, побочных эффектов не отмечено.
Заключение
Интенсификация терапии фиксированной комбинацией инсулина гларгин и ликсисенатида может быть рекомендована пациентам с СД 2 типа и избыточной массой тела, уровнем НbА1с > 7% на фоне комбинированной терапии. Она может стать альтернативой более интенсифицированному режиму инсулинотерапии при сохраненной функции β-клеток поджелудочной железы. Данный вариант лечения в отличие от интенсивной инсулинотерапии не требует более частого мониторинга гликемии, дополнительного обучения пациентов титрации дозы.
M.B. Antsiferov, MD, PhD, Prof., O.M. Koteshkova, PhD, N.A. Demidov, PhD
Endocrinological Dispensary of the Moscow Healthcare Department
Moscovskii city Hospital, Department of Healthcare of Moscow
Contact person: Olga M. Koteshkova, koala58@mail.ru
The progressive nature of type 2 diabetes mellitus (T2DM) leads to the fact that many patients require basal insulin therapy. However, the administration of insulin does not lead to a significant improvement in the compensation of carbohydrate metabolism. Only 30% of patients achieve the goal of treatment when initiating basal insulin therapy. Prescribing basal insulin leads to fasting normoglycemia and has virtually no effect on postprandial glycemia. Many patients have postprandial hyperglycemia and additional intensification of therapy is required for correction.
Fixed ratio combinations of basal insulin and glucagon-like peptide-1 receptor analogues (GLP-1 RA) are an option for both starting insulin therapy and an option for intensifying insulin therapy, including because GLP-1 RA can reduce postprandial glucose excursion, inhibit weight gain, minimize the number of injections, and the risk of hypoglycemia. Currently, two fixed combinations of basal insulin and arGPP-1 are available in the world: ‘insulin glargine + lixisenatide’ and ‘insulin degludec + liraglutide’. The complementary mechanisms of action of the two components of the drug are aimed at seven of the eleven pathophysiological defects in type 2 diabetes. A simple prescribing and titration regimen improves patient adherence to treatment.
In this article, we discuss the benefits of fixed ratio combination of GLP-1 RA with insulin, and present a clinical case of using FRC of insulin glargine and GLP-1 RA lixisenatide in a patient with T2DM.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.