Возможности комбинированной инъекционной терапии на старте инсулинотерапии у пациентов с сахарным диабетом 2 типа
- Аннотация
- Статья
- Ссылки
- English
Соблюдение общепринятых рекомендаций по титрации дозы базального инсулина дает возможность добиться целевого уровня гликемии натощак, но не всегда позволяет достичь целевых значений постпрандиальной гликемии и целевого уровня гликированного гемоглобина (HbA1c). Для получения лучших показателей представляется перспективным использование фиксированных комбинаций базального инсулина и агонистов рецепторов глюкагоноподобного пептида 1. Так, в клинических исследованиях, в которых изучалась эффективность данной комбинации, через 30 недель после инициации терапии уровня HbA1c менее 7% удалось достичь 74% больных СД 2 типа.
В статье представлены результаты исследований эффективности и безопасности фиксированной комбинации инсулина гларгин и ликсисенатида. Кроме того, приводится пример успешного использования фиксированной комбинации на старте инсулинотерапии у пациента с СД 2 типа.
Соблюдение общепринятых рекомендаций по титрации дозы базального инсулина дает возможность добиться целевого уровня гликемии натощак, но не всегда позволяет достичь целевых значений постпрандиальной гликемии и целевого уровня гликированного гемоглобина (HbA1c). Для получения лучших показателей представляется перспективным использование фиксированных комбинаций базального инсулина и агонистов рецепторов глюкагоноподобного пептида 1. Так, в клинических исследованиях, в которых изучалась эффективность данной комбинации, через 30 недель после инициации терапии уровня HbA1c менее 7% удалось достичь 74% больных СД 2 типа.
В статье представлены результаты исследований эффективности и безопасности фиксированной комбинации инсулина гларгин и ликсисенатида. Кроме того, приводится пример успешного использования фиксированной комбинации на старте инсулинотерапии у пациента с СД 2 типа.



Введение
В настоящее время в мире продолжается неинфекционная эпидемия сахарного диабета (СД). Так, согласно данным экспертов Международной федерации диабета, в 2019 г. число пациентов достигло 463 млн, преимущественно за счет лиц с СД 2 типа [1].
В России в 2019 г. на учете по поводу СД состояло 4,58 млн, или 3,1% населения [2]. С 2000 г. данная популяция увеличилась на 2,5 млн [2]. Последний анализ мониторинга качества контроля углеводного обмена у пациентов с СД на основании результатов комплексного обследования в мобильном медицинском центре (Диамодуле) свидетельствует, что, несмотря на положительную динамику параметров по сравнению с 2005–2010 гг., показатели гликированного гемоглобина (HbA1c), соответствующие декомпенсации СД 2 типа, имеют место у 30–40% пациентов, соответствующие целевым – у 24,7% [3].
Недостаточный контроль заболевания у трети пациентов и, следовательно, его осложнений обусловливает актуальность поиска новых подходов к терапии, в том числе использования инновационных препаратов, позволяющих в отличие от применения традиционных средств достичь целевых значений гликемии у большей доли больных.
Стратегия лечения сахарного диабета 2 типа
В настоящее время выработана общая стратегия лечения СД 2 типа. Она представлена в совместном консенсусе Американской диабетической ассоциации и Европейской ассоциации по изучению диабета 2019 г. [4]. Аналогичный документ разработан и в России.
Согласно национальным алгоритмам, стратификация лечебной тактики осуществляется в зависимости от уровня НbА1с, то есть в зависимости от того, насколько он превышает целевой уровень. Эффективность терапии оценивается по соответствию достигнутого уровня целевому. При необходимости проводится интенсификация терапии.
В рутинной клинической практике препаратом первой линии считается метформин [5].
Интенсификация терапии или же ее инициация при высоких показателях гликемии чаще всего осуществляется за счет добавления других пероральных сахароснижающих препаратов (ПССП) и инсулина.
Инсулинотерапия: инициация и оптимизация
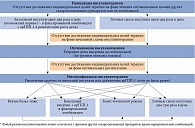
Инсулин является самым мощным сахароснижающим препаратом. Общие рекомендации по инициации и оптимизации инсулинотерапии при СД представлены на рис. 1.
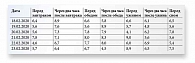
Выбор режима инсулинотерапии зависит от особенностей течения СД 2 типа и образа жизни больного (таблица).
Фиксированные комбинации инсулина и агонистов рецепторов ГПП-1
Идеальными для комбинирования с базальным инсулином являются агонисты рецепторов глюкагоноподобного пептида 1 (арГПП-1). Длительно действующие арГПП-1 (дулаглутид, лираглутид, семаглутид, эксенатид пролонгированного действия) в основном влияют на показатели гликемии натощак, короткодействующие (ликсисенатид, эксенатид) – на постпрандиальную гликемию.
К преимуществам фиксированных комбинаций базального инсулина и арГПП-1 следует отнести простой режим титрации дозы (такой же, как у базальных инсулинов), более высокую эффективность в снижении гликемии по сравнению с базальным инсулином. При этом сахароснижающая эффективность не сопровождается увеличением риска развития гипогликемии и набора массы тела в отличие от старта терапии базальным инсулином.
В настоящее время в арсенале врачей есть две фиксированные комбинации инсулина и арГПП-1: «инсулин деглудек + лираглутид», «инсулин гларгин + ликсисенатид». Режим введения обеих комбинаций – один раз в день.
Указанные выше комбинации можно использовать у пациентов, не достигших целей терапии СД при монотерапии метформином, или комбинированной терапии метформином с другим ПССП, или комбинации арГПП-1 с ПССП, или монотерапии базальным инсулином у взрослых пациентов с СД 2 типа.
Фиксированная комбинация инсулина гларгин с ликсисенатидом
Фиксированная комбинация инсулина гларгин и ликсисенатида выпускается в предварительно заправленных шприц-ручках двух видов:
- шприц-ручка 10-40 желтого цвета содержит 100 ЕД/мл инсулина гларгин и 50 мкг/мл ликсисенатида и позволяет вводить от 10 до 40 ЕД препарата;
- шприц-ручка 30-60 оливкового цвета содержит 100 ЕД/мл инсулина гларгин и 33 мкг/мл ликсисенатида и позволяет вводить от 30 до 60 ЕД препарата.
Фиксированная комбинация инсулина гларгин и ликсисенатида изучена в трех крупных клинических исследованиях. Параметры эффективности и безопасности препарата оценивались у пациентов, не достигших целей терапии на ПССП [6], на комбинации базального инсулина и ПССП [7], комбинации арГПП-1 и ПССП [8].
Так, в рандомизированном открытом 30-недельном исследовании с активным контролем LixiLan-O, проведенном у пациентов с СД 2 типа, не получавших ранее терапию инсулином и с недостаточным гликемическим контролем при применении ПССП, сравнивались эффективность и безопасность фиксированной комбинации инсулина гларгин и ликсисенатида (n = 468), инсулина гларгин (n = 466) и ликсисенатида (n = 233) по отдельности [6].
Через 30 недель после добавления в схему лечения фиксированной комбинации инсулина гларгин и ликсисенатида 74% (345) пациентов достигли значений HbA1c < 7%. Добавление только инсулина гларгин привело к аналогичному результату лишь в 59% случаев (277 пациентов), только ликсисенатида – в 33% (77).
К 30-й неделе уровень HbA1с у получавших фиксированную комбинацию инсулина гларгин и ликсисенатида снизился на 1,6%, у получавших лечение инсулином гларгин и ликсисенатидом – на 1,3 и 0,9% соответственно [6].
При этом более эффективное снижение HbA1c на фоне фиксированной комбинации инсулина гларгин и ликсисенатида не приводило к увеличению частоты гипогликемий и массы тела по сравнению с монотерапией инсулином гларгин [6].
Опыт применения
Пациент М., 52 года, обратился с жалобами на общую слабость, снижение зрения, увеличение массы тела.
Из анамнеза: больной страдает СД 2 типа около 12 лет, принимал метформин в дозе 2000 мг/сут в течение четырех лет. Из-за неудовлетворительного контроля гликемии проведена интенсификация терапии гликлазидом МВ 60 мг/сут с последующей коррекцией дозы до 120 мг/сут. По данным самоконтроля, на фоне терапии нецелевая гликемия сохранялась. Была проведена попытка назначения ингибитора натрий-глюкозного котранспортера 2. Однако из-за развития баланопостита пациент отказался от приема данного препарата. В 2019 г. в течение трех месяцев получал трехкомпонентную терапию: метформин 2000 мг/сут, гликлазид МВ 120 мг/сут, лираглутид 1,2 мг/сут. На фоне терапии постпрандиальная гликемия снизилась до целевых показателей (менее 9 ммоль/л), однако сохранялась гипергликемия натощак и появились нежелательные явления (диспепсия, постоянная тошнота). Поэтому препарат был отменен. От интенсификации терапии с помощью инсулина пациент отказался.
В последние пять лет больной ведет малоподвижный образ жизни, что способствовало увеличению массы тела. Режим питания нарушен: постоянные перекусы, отсутствие полноценных приемов пищи. Курит (20 сигарет в день), алкоголь употребляет умеренно (полусладкое вино, пиво). Периодически отмечает повышение артериального давления до 160/90 мм рт. ст. Назначенную антигипертензивную терапию принимает нерегулярно.
Семейный анамнез по сердечно-сосудистым заболеваниям отягощен. Отец умер от инсульта в возрасте 60 лет, мать страдает артериальной гипертензией.
При физикальном осмотре: рост – 186 см, вес – 126 кг, индекс массы тела – 36,5 кг/м2, окружность талии – 118 см. Кожные покровы обычной окраски и влажности, периферических отеков нет. Аускультация легких – без особенностей. Частота дыхания – 18 в минуту. Тоны сердца приглушены, частота сердечных сокращений – 80 в минуту. Артериальное давление – 140/90 мм рт. ст. Живот при пальпации мягкий, безболезненный. Печень у края реберной дуги. Симптом поколачивания отрицательный с обеих сторон. Дизурических явлений нет. Пульсация на аа. dorsalis pedis сохранена. Щитовидная железа при пальпации не увеличена, безболезненная, диффузно-однородной структуры, клинических признаков нарушения функции щитовидной железы нет.
Лабораторные и инструментальные исследования: клинический анализ крови в норме. Клинический анализ мочи: без особенностей, но отмечается микроальбуминурия – 160 мг/сут, соотношение «альбумин/креатинин мочи» – 25 мг/ммоль. Биохимический анализ крови: общий белок – 71,8 г/л, мочевина – 7 ммоль/л, креатинин – 70 мкмоль/л, мочевая кислота – 326 мкмоль/л, общий билирубин – 10 ммоль/л, аспартатаминотрансфераза – 40 ед/л, аланинаминотрансфераза – 42 ед/л, гликемия – 13,9 ммоль/л, общий холестерин – 5,7 ммоль/л, триглицериды – 0,94 ммоль/л, холестерин липопротеинов низкой плотности (ЛПНП) – 4,06 ммоль/л, холестерин липопротеинов высокой плотности (ЛПВП) – 1,63 ммоль/л, скорость клубочковой фильтрации (СКФ) – 109 мл/мин/1,73 м2 (расчет по формуле MDRD), HbA1c – 8,8%.
Электрокардиограмма: ритм синусовый с частотой сердечных сокращений 76 в минуту. Отклонение электрической оси сердца влево. Признаки гипертрофии левого желудочка.
По данным эхокардиограммы признаки гипертрофии левого желудочка, полости не расширены, зон гипокинеза не отмечено, фракция выброса 68%.
Заключение офтальмолога: непролиферативная диабетическая ретинопатия OU.
Заключение специалиста отделения диабетической стопы: диабетическая периферическая сенсомоторная нейропатия, дистальный тип. Риск развития синдрома диабетической стопы высокий.
Данные самоконтроля глюкозы в крови приведены на рис. 2.
Для уточнения динамики гликемии было проведено непрерывное мониторирование (рис. 3).
Эпизод гипогликемии был связан с приемом алкоголя (прием алкоголя без закуски).
При оценке значимости гипергликемии необходимо учитывать, что она редко возникает в отсутствие других весомых метаболических нарушений, которые обладают самостоятельным значением в развитии сердечно-сосудистых заболеваний, но вместе с тем усиливают неблагоприятное воздействие друг друга и требуют своевременной активной коррекции.
Учитывая анамнез, было принято решение о назначении комбинации инсулина пролонгированного действия и арГПП-1. Для повышения комплаентности выбрана фиксированная комбинация инсулина гларгин и ликсисенатида (в России зарегистрирована под торговым наименованием Соликва СолоСтар). Стартовая доза для не получавших ранее инсулин составляет 10 ЕД/сут. Препарат был назначен в комбинации с метформином 2000 мг/сут. В последующем его доза была увеличена до 30 ЕД/сут.
Препарат вводили один раз в день в течение часа перед завтраком (согласно инструкции) в подкожно-жировую клетчатку передней брюшной стенки. Для введения использовали желтую шприц-ручку 10-40 (100 ЕД/мл инсулина гларгин + 50 мкг/мл ликсисенатида). Титрацию дозы проводили один раз в неделю. Дополнительно для коррекции липидного спектра крови назначен аторвастатин в дозе 20 мг/сут.
Уровень HbA1c был оценен через три месяца после назначения терапии.
Пациент вел записи в дневнике самоконтроля несистематически. Однако в течение недели перед визитом к врачу регулярно измерял глюкозу в крови и массу тела. Согласно данным самоконтроля, наблюдалась четкая тенденция к снижению гликемии как натощак, так и постпрандиальной (рис. 4).
Через три месяца наблюдения масса тела снизилась на 2,5 кг, уровень HbA1c – на 1,6% (7,4 против целевого менее 7,0%). Доза препарата составила 30 ЕД/сут.
Показатели биохимического анализа крови через три месяца: гликемия – 5,9 ммоль/л, общий холестерин – 4,1 ммоль/л, триглицериды – 0,74 ммоль/л, ЛПНП – 2 ммоль/л, ЛПВП – 1,73 ммоль/л, СКФ – 102 мл/мин/1,73 м2 (расчет по формуле MDRD).
Гипогликемии не зарегистрированы, уровень глюкозы в крови менее 3,9 ммоль/л не отмечался. Переносимость терапии хорошая.
Заключение
Старт инсулинотерапии с фиксированной комбинации инсулина гларгин и ликсисенатида может быть рекомендован больным СД 2 типа с уровнем НbА1с, превышающим целевые значения на фоне применения комбинации оптимальных доз ПССП. По сравнению с базальным инсулином данный вариант стартовой терапии может обеспечить лучший контроль гликемии без усложнения схемы лечения. Титрация дозы препарата осуществляется так же, как подбор дозы базального инсулина.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении данной публикации.
M.B. Antsiferov, MD, PhD, Prof., O.M. Koteshkova, PhD, O.V. Dukhareva, PhD, N.A. Demidov, PhD, E.A. Ermakova, PhD
Endocrinological Dispensary of the Moscow Healthcare Department
Moscovskii city Hospital, Department of Healthcare of Moscow
Contact person: Olga M. Koteshkova, koala58@mail.ru
The traditional option for starting insulin therapy in patients with type 2 diabetes mellitus (DM) is the start of basal insulin. However, this does not always lead to the achievement of the goals of glycemic control – only 30% of patients reach the target glycemic values 6 months after the initiation of insulin therapy.
The correct use of basal insulin (especially adequate dose titration) allows to achieve the target fasting glucose, but does not always allow to achieve the target values of postprandial glycemia and, accordingly, the target level of HbA1c. To achieve the best results of therapy, it seems promising to use fixed ratio combinations of basal insulin and glucagon-like peptide 1 (GLP-1) receptor agonists, which, according to the results of clinical studies, allow 74% of patients to achieve HbA1c less than 7% at the start of insulin therapy, which is the target value for most patients with diabetes.
The article presents data from clinical trials of the efficacy and safety of fixed ratio combination of insulin glargine and lixisenatide, confirming the advantage over the use of each of its components separately. A clinical case of the successful use of a fixed ratio combination of insulin glargine + lixisenatide on the start of insulin therapy in patient with type 2 diabetes is presented.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.