Субетта – новый активатор рецептора инсулина
- Аннотация
- Статья
- Ссылки
- English
В качестве нового подхода к лечению СД 2 типа, влияющего на ведущее патогенетическое звено – инсулинорезистентность, может быть рассмотрено включение в комплексную терапию препарата Субетта.
В статье представлены данные о механизме действия Субетты. Рассмотрены эндотелиопротективные возможности препарата. Кроме того, приведены результаты клинических исследований его гипогликемической эффективности.
В качестве нового подхода к лечению СД 2 типа, влияющего на ведущее патогенетическое звено – инсулинорезистентность, может быть рассмотрено включение в комплексную терапию препарата Субетта.
В статье представлены данные о механизме действия Субетты. Рассмотрены эндотелиопротективные возможности препарата. Кроме того, приведены результаты клинических исследований его гипогликемической эффективности.


Введение
Рост популяции пациентов с сахарным диабетом (СД) 2 типа и частоты его хронических осложнений, особенно сердечно-сосудистых и почечных, – одна из самых актуальных проблем, с которой сегодня сталкивается мировое сообщество. Если в 2017 г. число больных СД достигло 412 млн, к 2040 г. ожидается его увеличение до 642 млн [1].
СД 2 типа – гетерогенное состояние, в основе развития которого лежат два дефекта: прогрессирующая дисфункция β-клеток поджелудочной железы с нарушением секреции инсулина и периферическая резистентность тканей (поперечно-полосатых мышц, печени и жировой ткани) к инсулину, причем чаще всего преобладает инсулинорезистентность. Дефект в секреции инсулина приводит к неспособности компенсировать инсулинорезистентность при нормальной или даже повышенной концентрации инсулина в плазме. Гипергликемия в свою очередь способствует дальнейшему снижению функции β-клеток и увеличению инсулинорезистентности за счет глюкозотоксичности [2].
Инсулиновый рецептор и инсулинорезистентность
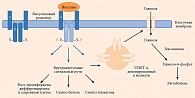
Инсулиновый рецептор (ИР) – трансмембранный тирозинкиназный рецептор, который состоит из двух α- и двух β-субъединиц (рис. 1). Инсулин с высокой специфичностью связывается и распознается α-субъединицей, которая располагается на наружной поверхности клеточной мембраны. Данная связь приводит к конформационным изменениям α-субъединицы и тирозинкиназной активности β-субъединицы (трансмембранного белка), после чего происходит аутофосфорилирование β-субъединицы рецептора инсулина по нескольким тирозиновым остаткам. Фосфорилирование β-субъединицы вызывает фосфорилирование других внутриклеточных белков – субстратов инсулинового рецептора (СИР) 1 и 2. Активация СИР-1 способствует вовлечению в процесс фосфатидилинозитол-3-киназы, активирующей сигнальный путь, стимулирующий транслокацию глюкозного транспортера 4 (ГЛЮТ-4) из цитозоля в плазматическую мембрану и, следовательно, трансмембранный перенос глюкозы в клетки жировой и мышечной ткани [3]. Таким образом, данный сигнальный путь в большей степени ответственен за метаболическое действие инсулина (перенос глюкозы и подавление глюконеогенеза). Второй сигнальный путь – путь митоген-активируемых протеинкиназ. Он регулирует экспрессию генов, контролирующих рост и дифференциацию клетки. Рассматриваемые пути различаются прежде всего чувствительностью к трансформационным изменениям СИР-1 и возникающей в результате этого инсулинорезистентности.
Изменения на любом из этапов внутриклеточной сигнальной трансдукции инсулина могут стать причиной инсулинорезистентности на молекулярном уровне. Согласно определению, предложенному экспертами Американской диабетической ассоциации (American Diabetes Association), под инсулинорезистентностью следует понимать нарушение биологического ответа (метаболического и молекулярно-генетического) на экзогенный и эндогенный инсулин, метаболизма углеводов, жиров и белков, а также изменение синтеза ДНК, регуляции транскрипции генов, процессов дифференцировки и роста клеток и тканей организма.
В инициации инсулинорезистентности большое значение отводится пострецепторным нарушениям передачи сигнала инсулина, обусловленным, вероятно, повышением уровня фактора некроза опухоли α, неэтерифицированных жирных кислот, малоподвижным образом жизни, высококалорийной диетой, возрастом, курением, избыточным весом/ожирением и др. [4]. Причинами инсулинорезистентности клеток поперечно-полосатых мышц могут быть также дефекты транспорта глюкозы, обусловленные патологией ГЛЮТ-4 [5].
Способы коррекции инсулинорезистентности
Основной целью лечения СД 2 типа является контроль гликемии, что позволяет предотвратить развитие поздних его осложнений. Фармакотерапия прежде всего должна быть направлена на коррекцию инсулинорезистентности – одно из важных звеньев патогенеза. Это признают эксперты всех национальных и международных организаций, занимающихся проблемами диабетологии. Во всех разработанных ими алгоритмах лечения в качестве препарата выбора для стартовой терапии рекомендован метформин. Однако эта мера лишь частично решает проблему, поскольку влияние метформина на чувствительность мышечной и жировой тканей к инсулину незначительно. Тиазолидиндионы благодаря уникальному механизму действия превосходят в этом метформин. Снижая нагрузку на β-клетки, они надолго сохраняют их резервную способность секретировать инсулин. Однако публикация S.E. Nissen и соавт. «Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes» («Влияние росиглитазона на риск развития инфаркта миокарда и смерти от сердечно-сосудистых причин») (2007), представляющая собой метаанализ данных 42 рандомизированных клинических исследований, всколыхнула медицинскую общественность [6]. Эта ситуация привела к тому, что Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration) ввело новые беспрецедентные требования к доказательной базе по безопасности гипогликемических препаратов, а в сентябре 2010 г. Европейское медицинское агентство (European Medicines Agency) рекомендовало приостановить в Европе продажу росиглитазона. До истории с росиглитазоном в 2000 г. был отозван еще один представитель данной группы – троглитазон из-за высокой гепатотоксичности. На сегодняшний день судьба троглитазона и росиглитазона накладывает тень на пиоглитазон.
В связи со сказанным существует острая необходимость в препаратах, влияющих именно на инсулинорезистентность.
В 2010 г. на отечественном фармацевтическом рынке появился новый препарат Субетта (ООО «Научно-производственная фирма «Материа Медика Холдинг»).
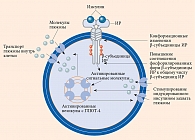
Субетта – комплексный препарат, созданный на основе антител к β-субъединице рецептора инсулина (анти-βIR) и антител к эндотелиальной NO-синтазе (анти-eNOS) в релиз-активной форме. В отличие от высоких концентраций антител, связывающихся с антигенами и блокирующих их, антитела в релиз-активной форме не блокируют молекулы-мишени, а через конформационные изменения регулируют их функцию и биологические эффекты [7, 8]. Изменяя конформацию β-субъединицы инсулинового рецептора, препарат активирует его: повышает соотношение активированных форм β-субъединиц инсулинового рецептора к общим формам [8] и продукцию адипонектина адипоцитами [9], стимулирует индуцированный инсулином захват глюкозы клетками мышечной ткани [10]. Одновременно препарат модулирует активность eNOS, оказывая терапевтическое действие на эндотелиальную дисфункцию [11]. Последняя также ассоциируется с инсулинорезистентностью. Кроме того, эндотелиальная дисфункция провоцирует прогрессирование СД 2 типа и его сосудистых осложнений [11].
Механизм гипогликемического действия Субетты представлен на рис. 2.
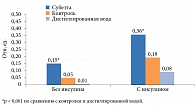
Доказано, что Субетта повышает соотношение фосфорилированных форм β-субъединиц ИР к общему числу β-субъединиц. Это приводит к восстановлению чувствительности рецептора как к эндогенному, так и к экзогенному инсулину. Как следствие, происходит активация инсулин-зависимого транспорта глюкозы и развитие антигипергликемического эффекта (рис. 3). Экспериментально установлено, что Субетта может активировать ИР как в присутствии, так и в отсутствие инсулина [8]. Так, при инкубации зрелых адипоцитов человека с препаратом Субетта в течение 72 часов, в отличие от контролей – культуральной среды или дистиллированной воды, наблюдалось увеличение соотношения фосфорилированных форм β-субъединиц ИР к общим формам β-субъединиц рецептора. В среде без инсулина среднее значение оцениваемого показателя для препарата Субетта составило 0,15 ± 0,014 отн. ед., тогда как для культуральной среды – 0,05 ± 0,003 отн. ед., для дистиллированной воды – 0,01 ± 0,007 отн. ед. [8]. В среде с инсулином соотношение фосфорилированных форм к общим формам β-субъединиц было следующим: 0,359 ± 0,008 отн. ед. в среде с Субеттой, 0,194 ± 0,01 отн. ед. в контроле и 0,081 ± 0,009 отн. ед. в среде с дистиллированной водой [8].
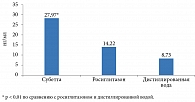
Принимая во внимание, что препарат Субетта влияет на ИР, а биосинтез адипонектина связан с активацией рецептора, увеличение продукции адипонектина можно считать следствием активации ИР. Инкубация зрелых адипоцитов человека с препаратом Субетта в течение 72 часов привела к статистически значимому увеличению концентрации адипонектина в культуральной среде по сравнению с контролем (дистиллированной водой) и росиглитазоном. Росиглитазон также стимулировал продукцию адипонектина, однако выраженность этого эффекта была ниже, чем у Субетты (рис. 4) [9].
В мышечной и жировой тканях инсулин стимулирует перемещение ГЛЮТ-4 из внутриклеточного пространства на поверхность клетки, за счет чего реализуется его функция в снижении уровня глюкозы в плазме. Необходимо отметить, что ГЛЮТ-4 является главным переносчиком глюкозы в данных клетках [12]. Поскольку утилизация глюкозы в организме осуществляется главным образом мышечной тканью посредством ГЛЮТ-4, было проведено исследование in vitro по оценке влияния Субетты на захват глюкозы миоцитами в присутствии инсулина. В качестве материала были использованы клетки мышечной ткани человека через пять дней после дифференцировки. Добавление Субетты к инсулину способствовало повышению инсулин-зависимого захвата глюкозы миоцитами на 43% (p < 0,001) (рис. 5). В то же время добавление отрицательного контроля (дистиллированной воды) не оказывало существенного влияния. Таким образом, полученные данные свидетельствуют, что препарат Субетта существенно повышает чувствительность тканей к инсулину посредством стимулирования переноса глюкозы ГЛЮТ-4 в миоциты [10].
Эндотелиопротективные и другие свойства
Антигипертензивное действие компонента Субетты изучали в условиях экспериментальной модели дефицита NO, созданного с помощью введения N-нитро-L-аргинин-метилового эфира (L-NAME). В качестве критерия оценки была выбрана экспрессия eNOS. Применение анти-eNOS в релиз-активной форме приближало показатель экспрессии к значениям интактных животных. Известно, что эналаприл и лозартан (классические антигипертензивные препараты) могут предотвращать L-NAME-индуцированный дефицит NO, однако их эндотелиопротективное действие менее выражено, чем у анти-eNOS в релиз-активной форме. Анти-eNOS в релиз-активной форме повышают активность последней и таким образом содержание NO, обеспечивающего эндотелиопротективное действие.
Положительное влияние препарата на сердечно-сосудистую систему связано с уменьшением сосудистого спазма, нормализацией артериального давления и улучшением периферической микроциркуляции [13].
Выявлено также, что анти-eNOS в релиз-активной форме обладают умеренным психотропным действием. Речь, в частности, идет о противотревожном, антиастеническом, вегетостабилизирующем эффектах. Компоненты, входящие в состав Субетты, усиливают влияние друг друга на чувствительность клеток к инсулину за счет неспецифической NO-зависимой активации внутриклеточной трансдукции сигнала от инсулинового рецептора. Как следствие, повышается эффективность инсулинотерапии, стабилизируются применяемые дозы и снижается риск развития побочных эффектов [14].
Клинические эффекты
Эффективность и безопасность Субетты в комплексной терапии больных сахарным диабетом 2 типа оценивали в многоцентровом двойном слепом плацебоконтролируемом рандомизированном клиническом исследовании в параллельных группах. Его результаты представлены на сайте ClinicalTrials.com.
В исследование были включены пациенты, не достигшие оптимального гликемического контроля (гликированный гемоглобин (HbA1c) > 7,0%) на фоне комбинации базального инсулина и метформина и/или препарата сульфонилмочевины. Данная терапия проводилась в соответствии с принятыми стандартами лечения не менее трех месяцев до включения в исследование.
Добавление Субетты ассоциировалось с положительным влиянием на контроль гликемии с 12-й недели – уровень HbA1c в среднем снизился на 0,54% в выборке всех пациентов, начавших лечение (рис. 6). При этом длительное применение препарата не сопровождалось увеличением количества нежелательных явлений по сравнению с приемом плацебо [15].
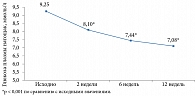
Пострегистрационный опыт применения Субетты у пациентов с СД 2 типа свидетельствует о значимой динамике абсолютных значений глюкозы плазмы натощак по сравнению с исходным уровнем (p < 0,001) (рис. 7) [16].
Заключение
Внедрение в клиническую практику принципиально новой опции, способной влиять на инсулиновый рецептор и инсулинорезистентность, – препарата Субетта позволит обеспечить лучший контроль гликемии у пациентов с СД 2 типа. Высокий терапевтический потенциал данного препарата обеспечивается за счет благоприятного профиля эффективности и безопасности, что является особенно важным при терапии хронических заболеваний.
Субетту можно использовать в составе комплексной терапии как у пациентов с впервые выявленным СД 2 типа, так и длительное время страдающих этим заболеванием.
Учитывая, что большинство пациентов с СД 2 типа – лица пожилого возраста с сопутствующими заболеваниями, представляется важным, что включение Субетты в комбинированную терапию не требует коррекции суточной дозы принимаемых препаратов. Достижение целевого уровня глюкозы и дополнительные эндотелиопротективные свойства также позволяют снизить риск развития и прогрессирования сердечно-сосудистых осложнений у данной категории больных.
Следует отметить, что единственным противопоказанием для назначения препарата Субетта является повышенная индивидуальная чувствительность к его компонентам.
A.M. Mkrtumyan, DM, PhD, Prof., L.V. Yegshatyan, PhD
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
A.S. Loginov Moscow Clinic Scientific Center
Contact person: Ashot Musayelovich Mkrtumyan, vagrashot@mail.ru
Despite the variety of antidiabetic drugs, most patients with type 2 diabetes mellitus (DM2) do not achieve individual treatment goals. Due to poor control of glycemia at any stage of the disease, it is necessary to adjust therapy in a timely manner. For this, as a rule, the dose of the drug taken should be increased or another antidiabetic drug should be added. As a modern approach to the treatment of DM2, affecting the leading component of pathogenesis – insulin resistance, Subetta in a complex therapy can be considered. The article presents data on the mechanism of action of the Subetta, endothelium protective properties and some results of hypoglycemic efficiency according to the results of clinical trials.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.