Тромбоэмболические осложнения во время беременности и низкомолекулярный гепарин
- Аннотация
- Статья
- Ссылки








Практическая значимость проблемы определяется, во-первых, явным нарастанием частоты легочных эмболий при самых разнообразных заболеваниях; во-вторых, значительным увеличением частоты послеоперационных и посттравматических эмболий, чаще возникающих при сложных хирургических вмешательствах; в-третьих, тем обстоятельством, что ТЭЛА становится третьей по частоте причиной смерти в высокоразвитых странах, уступая только инфарктам, инсультам и злокачественным новообразованиям (1).
Несмотря на прогресс медицинской науки и высокий интерес к проблеме тромботических осложнений, в течение последних 40 лет заболеваемость ВТЭ не имеет тенденции к снижению. В качестве причин такой тенденции можно выделить несколько факторов, включая увеличение частоты аутоиммунных заболеваний в общей популяции, в том числе и антифосфолипидного синдрома, неподвижный образ жизни, высокая частота встречаемости метаболического синдрома в популяции, характер питания, еще мало изученные, но, безусловно, играющие не последнюю роль экологические факторы. Заболеваемость ВТЭ составляет 200 на 100 000; 0,1% населения ежегодно погибает от ТЭЛА, т.е. 1 человек из 1000 живущих на Земле (1, 2).
В экономически развитых странах, где за последние 30 лет удалось снизить материнскую смертность от геморрагических осложнений, гестозов и сепсиса, ТЭЛА в настоящее время является ведущей причиной материнской смертности (3).
В России смертность от тромбоэмболических осложнений колеблется от 1,5 до 2,7 на 10 000 родов, и в структуре материнской смертности в 90-е гг. занимала 6-7 место, при этом частота ТЭЛА и ее доля в структуре материнской смертности не имеет тенденции к снижению (4).
Актуальность проблемы ТЭЛА обусловлена не только тяжестью течения заболевания и высокой летальностью, но и трудностями его своевременной диагностики. По данным патологоанатомических исследований, в 50-80% случаев ТЭЛА не диагностируется вообще, а правильный диагноз ТЭЛА имеет место при жизни лишь в трети случаев (5). Летальность среди пациентов без патогенетической терапии составляет 40% и более, при массивной тромбоэмболии достигает 70%, а при своевременно начатой терапии колеблется от 2 до 8%. Таким образом, своевременное начало антикоагулянтной терапии позволяет в 4-6 раз снизить летальность при тромбоэмболических осложнениях (6).
Венозные тромбозы магистральных вен приводят к тромбированию сосудов плаценты, ухудшают маточно-плацентарное кровообращение и внутриутробное состояние плода (22). Таким образом, тромбоэмболические осложнения создают реальную угрозу жизни и здоровью матери и плода и предопределяют рост материнской и перинатальной смертности.
Повышенное внимание к проблеме тромбоэмболических осложнений во время беременности связанно еще и с их тяжелыми отдаленными последствиями (прежде всего, посттромбофлебитическим синдромом и хронической легочной гипертензией). У 85% женщин после перенесенного во время беременности тромбоза глубоких вен (ТГВ) развивается хотя бы один признак посттромбофлебитического синдрома, а у 4% формируются трофические язвы (8). Кроме того, посттромбофлебитический синдром намного чаще развивается, если тромбозы проявились во время беременности (в 80% случаев) по сравнению с общей популяцией (в 30-40% случаев) (9).
Cо времени открытия Рудольфом Вирховым в 1884 г. трех главных факторов развития тромбов (замедление скорости кровотока, повреждение стенки сосуда, изменение свойств крови) были выявлены и изучены целый ряд факторов, предрасполагающих к тромбозу, однако даже при тщательном анализе всех факторов риска причина тромбозов в 50% случаев остается не известной (так называемые идиопатические тромбозы) (10).
Тромбоэмболия нередко развивается внезапно, без каких-либо предшествующих факторов риска. При массивной ТЭЛА часто не бывает времени, чтобы установить диагноз и начать адекватное лечение. Таким образом, тромбоэмболические осложнения традиционно относят к непредотвратимым причинам материнской смертности.
Факторы риска и патогенез
Частота тромбоэмболических осложнений во время беременности составляет 2-5 на 1000 родов, что в 5-6 раз больше, чем в общей популяции (15, 16). Вероятно, истинная частота тромбоэмболических осложнений, связанных с беременностью, еще больше, так как ТГВ в 38% случаев, а ТЭЛА в 22% случаев развивается уже после выписки пациентки из акушерского стационара (17). На сегодня считается, что ТГВ примерно с одинаковой частотой развиваются во время беременности и в послеродовом периоде, тогда как ТЭЛА наиболее часто наблюдается после родоразрешения. Следует отметить, что по сравнению с беременностью в послеродовом периоде ежедневный риск тромбоэмболических осложнений возрастает в 20-30 раз (17).
Беременность сама по себе является состоянием, при котором риск развития венозных тромбозов увеличивается в 5-6 раз. Фактически для физиологической беременности характерны все признаки триады Вирхова. В течение беременности наблюдается прогрессивное увеличение содержания прокоагулянтных факторов (VIII, VII, V, X, XII, VII, фибриногена), снижение активности антикоагулянтной системы за счет развития резистентности к активированному протеину С (АРС) и снижения уровня протеина S на 40% (18). Торможение фибринолиза при беременности связано с продукцией плацентой ингибитора активатора плазминогена 2 типа (PAI-2), а также вследствие трехкратного увеличения экспрессии PAI-1 на эндотелии. Состояние гипофибринолиза усугубляется вследствие повышения уровня антиплазмина и ингибитора фибринолиза, активируемого тромбином (TAFI). Другим фактором, способствующим формированию протромботического потенциала, являются венозный стаз, который начинает формироваться в конце I триместра беременности. К 25-29 неделе скорость венозного кровотока уменьшается на 50%, наибольшей степени венозный стаз достигает при сроке беременности 36 недель; исходная скорость кровотока восстанавливается через 6 недель после родоразрешения. При беременности венозное давление в среднем повышается на 10 мм рт. ст., чему способствует нарушение венозного оттока под давлением беременной матки и увеличение кровотока по маточной вене и внутренним подвздошным венам. Вследствие изменения гормонального фона при беременности в условиях избытка гестагенов происходит уменьшение тонуса вен, что также способствует развитию стаза. Кроме того, как при оперативных родах, так и при естественном родоразрешении происходит повреждение тазовых вен. С одной стороны, эволюционное значение физиологической гиперкоагуляции состоит в предотвращении чрезмерной кровопотери при родах, с другой стороны, при определенных неблагоприятных условиях оно может способствовать развитию тромботических осложнений.
Существует еще целый ряд приобретенных факторов риска развития венозных тромбозов во время беременности: оперативное родоразрешение (особенно экстренное), возраст старше 35 лет, состояния, сопровождающиеся ДВС-синдромом (гестоз, септические осложнения, тяжелая экстрагенитальная патология) (15).
Приобретенные факторы риска тромбоза во время беременности:
- оперативное вмешательство (кесарево сечение, операции на беременной матке, наложение акушерских щипцов);
- осложнения беременности, сопровождающиеся ДВС-синдромом – ревматические пороки сердца, застойная сердечная недостаточность, искусственные клапаны сердца, заболевания почек (приобретенный дефицит антитромбина III вследствие неселективной протеинурии при нефротическом синдроме), артериальная гипертензия, гестоз, акушерские кровотечения; гнойно-септические заболевания, инфекционные и воспалительные заболевания (воспалительные заболевания ЖКТ, мочевая инфекция);
- возраст старше 35 лет;
- многорожавшие;
- ожирение (ИМТ > 29 кг/м2 до беременности);
- тромбоз глубоких вен или тромбоэмболия в анамнезе;
- варикозное расширение вен;
- иммобилизация (например, при длительном токолизе, параличах, авиаперелете);
- дегидратация (рвота беременных);
- синдром гиперстимуляции яичников;
- травма таза;
- злокачественные новообразования.
Особенно высокий риск тромбоэмболических осложнений при беременности характерен для женщин с тромбозами в анамнезе. По ретроспективным данным частота рецидивов ВТЭ в последующую беременность достигает 15% (19), что может свидетельствовать о важной роли генетических факторов в развитии тромбоэмболических осложнений.
Однако несмотря на столь тщательное изучение факторов риска ВТЭ причина развития этого осложнения остается не известной приблизительно в половине случаев (т.е. наблюдаются так называемые идиопатические тромбозы) (16). В последнее время все больше внимания уделяется изучению роли тромбофилических состояний в развитии как тромбоэмболических, так и акушерских осложнений. Под тромбофилией понимают наследственные или приобретенные (АФС) аномалии в системе гемостаза, предполагающие к развитию тромбозов.
Исследования последних лет свидетельствуют о четкой связи генетических тромбофилий и АФС с такими осложнениями беременности, как синдром потери плода, внутриутробная задержка роста плода (ЗВУРП), внутриутробная гибель плода, преждевременная отслойка нормально расположенной плаценты (ПОНРП), тяжелые формы гестоза (20, 21, 22). Если ранее роль тромбофилии в патогенезе осложнений беременности рассматривалась только с точки зрения процессов микротромбирования сосудов плацентарного ложа, то в настоящее время взгляды на патогенетическое влияние тромбофилии значительно расширились. Это связано с изучением роли системы гемостаза и нетромботических эффектов тромбофилии еще на этапах имплантации плодного яйца и инвазии трофобласта.
При ряде тромболических состояний риск ВТЭ повышается более чем в 100 раз, особенно при наличии гомозиготных, мультигенных форм тромбофилии или комбинированных форм (генетические тромбофилии + АФС) (23). В различных исследованиях показана взаимосвязь между развитием ВТЭ во время беременности и наличием таких мутаций, как FV Leiden, мутация протромбина G20210A, мутация MTHFR C677C, дефектов антикоагулянтной системы (дефицит антитромбина III, протеинов С и S) (24-27).
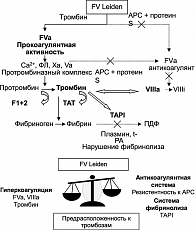
Резистентность к активированному протеину С встречается в среднем у 3-7% среди европейской популяции и у 20-30% пациентов с тромбозами (28). Классическим примером резистентности к АРС является мутация FV Leiden, при которой фактор V и VIII становятся нечувствительными к инактивирующему влиянию протеина С, что приводит к избыточному формированию тромбина и торможению фибринолиза (рисунок 1). Резистентность к АPC также может иметь место и при других мутациях фактора V (FV Hong-Kong, FV Cambridge, HRII-гаплотип), а также при целом ряде приобретенных факторов, включая циркуляцию АФА и, что немаловажно, может сопровождать физиологическое течение беременности. В исследовании А. Gerhardt и соавт. (2000) у женщин с эпизодами ВТЭ во время беременности мутация FV Leiden выявлена почти в половине случаев (43,7%), в то время как в контрольной группе – только у 7,7% (29).
При сохранении прокоагулянтной активности фактора V повреждается его антикоагулянтная функция. Вследствие АРС-резистентности не происходит деградация факторов Va и VIIIa. Это приводит к увеличению образования тромбина и возникновению состояния гиперкоагуляции.
Связываясь с тромбомодулином на эндотелиальной поверхности, тромбин увеличивает синтез TAPI. TAPI ингибирует фибринолиз путем отщепления лизилового фрагмента от молекул фибрина, что предотвращает ее связывание с плазмином и t-PA.
Помимо генетических причин резистентности к АРС, существует и целый ряд приобретенных факторов.
Причины приобретенного дефицита протеина С и резистентности к АРС:
- антифосфолипидный синдром;
- ДВС-синдром;
- тромбоз глубоких вен, тромбоэмболия легочной артерии;
- тяжелый гестоз;
- заболевания печени;
- послеоперационный период;
- инфекция, сепсис;
- злокачественные новообразования;
- острый респираторный дистресс-синдром; гемолитико-уремический синдром;
- тромботическая тромбоцитопеническая пурпура;
- прием оральных контрацептивов;
- уремия (нарушение активности протеина С при гемодиализе);
- нарушение синтеза протеина С;
- дефицит витамина К;
- терапия L-аспарагиназой, метотрексатом, 5-фторурацилом;
- терапия непрямыми антикоагулянтами.
Резистентность к активированному протеину С усугубляется при циркуляции антифосфолипидных антител. При наличии физиологической резистентности к протеину С, которая развивается во время беременности, может произойти декомпенсация системы гемостаза и развитие тромбоза.
Мутация протромбина G20210A ассоциируется с повышением уровня протромбина (активность фактора II достигает 130% и выше) и выявляется у 2-5% здорового населения. При этой мутации риск ВТЭ повышается в среднем в 3 раза (1). Мутация протромбина G20210A была выявлена у 16,9% беременных с ВТЭ по сравнению с 1,3% в контрольной группе (29).
До 40% пациентов с тромбозами имеют комбинированные формы тромбофилии: сочетание мутации FV Leiden с мутацией протромбина G20210A. При этом риск тромбозов повышается в 50-80 раз, т.е. риск ВТЭ становится сопоставимым с таковым при гомозиготной мутации FV Leiden (30).
Нарушения в системах протеина С и протеина S встречаются в среднем c частотой 0,14-0,5% в общей популяции и у 3,2% пациентов с тромбозами. Риск развития тромбоза во время беременности составляет от 3 до 10% для пациенток с дефицитом протеина С и до 6% для пациенток с дефицитом протеина S. В послеродовом периоде риск тромбозов повышается до 7-19% для пациенток с дефицитом протеина С и до 7-22% для пациенток с дефицитом протеина S (1, 31).
Имеющиеся на сегодня данные по риску развития тромбоэмболических осложнений во время беременности при наличии дефицита естественных антикоагулянтов представлены в таблице 1.
АФС является одним из наиболее важных факторов риска тромбоэмболических осложнений во время беременности. В настоящее время под АФС понимают симптомокомплекс, сочетающий клинические признаки и лабораторные данные, – наличие антифосфолипидных антител в сочетании с артериальными и/или венозными тромбозами и/или акушерскими осложнениями (34). Для установления диагноза АФС достаточно одного лабораторного и одного клинического критерия. Во время беременности тромбозы манифестируют у 30% пациенток с АФС (35). Риск рецидива ВТЭ при АФС значительно выше, чем в общей популяции и достигает 70% (36).
Современные критерии антифосфолипидного синдрома (34):
- венозный или артериальный тромбоз;
- акушерские осложнения – гибель морфологически нормального плода при сроке беременности > 10 недель, преждевременные роды (< 34 недель беременности), тяжелые формы гестоза, плацентарная недостаточность, 3 и более выкидыша при сроке беременности до 10 недель (при отсутствии гормональных и анатомических причин, хромосомных аномалий);
- лабораторные критерии – волчаночный антикоагулянт, антитела к кардиолипину (двукратное исследование с 12-недельным интервалом), антитела к b2-гликопротеину I.
Патогенетическими механизмами развития тромбозов при АФС являются взаимодействие с фосфолипидами эндотелиальных клеток и тромбоцитов, нарушение секреции простациклина, нарушение контактной активации фибринолиза, ингибиция тканевого активатора плазминогена (t-PA), тромбомодулина / протеина С / протеина S, индукция резистентности к APC.
Гипергомоцистеинемию связывают с ранним развитием атеросклероза и повышением риска тромбозов. Наиболее часто причиной гипергомоцистеинемии является мутация метилентетрагидрафолатредуктазы MTHFR С677T. Тяжелые формы гипергомоцистеинемии встречаются относительно редко, однако в общей популяции умеренное повышение уровня гомоцистеина (> 15 мкмоль/л) выявляется с частотой приблизительно 10% (31). Ряд исследователей не считают мутацию MTHFR C677T фактором повышенного риска ВТЭ как в общей популяции, так и во время беременности (26, 37, 38). В то же время другие исследователи придерживаются абсолютно противоположной точки зрения. Так, по данным последнего эпидемиологического исследования, проведенного в России, при наличии мутации MTHFR C677T риск развития ВТЭ увеличивается в 3 раза (39). Дальнейшее изучение роли гипергомоцистеинемии для развития ВТЭ во время беременности представляется весьма важным. Во-первых, женщины в экономически развитых западных странах с ранних сроков беременности получают фолиевую кислоту в качестве витаминной добавки, что способствует снижению уровня гомоцистеина. Гипергомоцистеинемия является единственной наследственной аномалией гемостаза, которая сравнительно компенсируется при применении такой простой терапии, как фолиевая кислота, витамины В6, В12. Для нашей страны характерна более высокая морбидность населения, отсутствие концепции здорового образа жизни и, соответственно, дефицит в пищевом рационе необходимых витаминов, антиоксидантов и, в первую очередь, непосредственно фолиевой кислоты. Данные наших ученых свидетельствуют о повышении риска не только гестозов и синдрома потери плода, но и острых сосудистых нарушений (ПОНРП, ВТЭ) при наличии мутации MTHFR C677T (22, 40). Актуальность этой проблемы связана еще и с тем, что мутация MTHFR является наиболее распространенной генетической аномалией гемостаза и выявляется в общей популяции в 10-20% случаев (31).
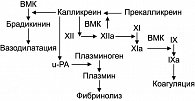
В настоящее время активно изучается роль генетических дефектов фибринолиза в повышении риска артериальных и венозных тромбозов. Доказана связь мутации t-PA I/D с увеличением риска венозных тромбозов в общей популяции (41, 42). Поскольку фактор XII вовлекается не только в контактную активацию коагуляционного каскада, но и в генерацию плазмина, его дефицит в большей степени связан с развитием не геморрагических тромботических осложнений (рисунок 2). В европейской популяции выраженный дефицит фактора XII выявляется у 1,5-3% населения и у 9-15% пациентов с ВТЭ (43). У носителей мутации 46ТТ риск ВТЭ возрастает в 3 раза (44).
PAI-1 обеспечивает до 60% общей ингибиторной активности в отношении активатора плазминогена в плазме крови и тем самым играет важную роль в регуляции фибринолиза. Наиболее частый полиморфизм 4-гуанодина (4G/5G) в промоторе PAI-1 ассоциируется с повышенной активностью PAI-1. Частота полиморфизма PAI-1 в общей популяции достигает 20%. При варианте 4G/4G уровень PAI-1 повышается на 25% (31). Обнаружена связь между повышенным уровнем PAI-1 и метаболическим синдромом, сахарным диабетом, гиперлипидемией. Это объясняет увеличение риска атеротромботических осложнений при наличии мутации PAI-1 (45).
Фактор XII является активатором свертывания крови по внутреннему пути, но еще и регулятором фибринолиза. Фактор XIIa способствует активации каллекреина, который в свою очередь поддерживает u-PA-зависимую активацию плазмина. ВМК – высокомолекулярный киноген; u-PA – активатор плазминогена урокиназного типа.
Большое значение имело открытие и изучение нетромботических эффектов тромбофилий, в частности, их влияния на процессы имплантации и инвазии трофобласта. Обнаружена взаимосвязь между гипофибринолизом и такими акушерскими осложнениями, как синдром потери плода, неудачи экстракорпорального оплодотворения, гестозы (46-48). В условиях гипофибринолиза (как в результате полиморфизма PAI-1, так и других причин) происходит десинхронизация локальных процессов фибринолиза и фибринообразования при имплантации. В такой ситуации протеаз, синтезируемых бластоцистой, становится относительно недостаточно, чтобы разрушить экстрацеллюлярный матрикс в эндометрии и внедриться на достаточную глубину. Недостаточная инвазия трофобласта в дальнейшем определяет феномен эндотелиальной дисфункции при гестозе.
Нами было обследовано 47 пациенток с тромбоэмболическими осложнениями во время беременности (средний возраст 28 ± 5,2 года). Группа I составила 47 пациенток с тромбозами: подгруппа 1 (n = 27) – пациентки с тромбозами в предыдущую беременность, подгруппа 2 (n = 20) – пациентки с тромбозами в настоящую беременность; группу II (контрольную) составили здоровые беременные (n = 40). Все женщины были обследованы на генетические тромбофилии (метод ПЦР) и антифосфолипидные антитела (АФА): волчаночный антикоагулянт (ВА) (тест с ядом гадюки Рассела), антикардиолипины (аКЛ), анти-бета2-гликопротеин I (метод ELISA). Базовая терапия при подготовке и на протяжении всей беременности у пациенток с тромбозами в анамнезе (подгруппа 1) включала низкомолекулярный гепарин (НМГ) под контролем D-димера (ELISA), антиоксиданты – омега 3, витамины группы В, фолиевую кислоту (до 4 мг/сут в случае гипергомоцистеинемии), а также аспирин (80-100 мг/сут) (во II триместре и примерно до 34 недель беременности) и натуральный прогестерон при АФС. У женщин с тромбоэмболическими осложнениями во время беременности антикоагулянтная терапия была начата после развития клинических симптомов.
У 26 (55%) пациенток тромбозы развились во время беременности (с 20 по 38 неделю), у 21 пациентки – в послеродовом периоде. У 7 из них тромбозы возникли после экстренного кесарева сечения. У 9 (19%) пациенток ВТЭ были рецидивирующими. У 26 (55%) выявлена ТЭЛА, у 20 пациенток (42,5%) – ТГВ, у одной пациентки в послеродовом периоде развился тромбоз яичниковой вены.
Обращает на себя внимание более высокая частота тромбозов в семейном анамнезе у пациенток с ВТЭ (в 38% случаев по сравнению с 8,5% в контрольной группе женщин с физиологической беременностью), что может указывать на наличие генетической предрасположенности к тромбозам у таких пациенток.
Важно отметить, что даже при тщательном анализе факторов риска дополнительные факторы развития тромбоза не были обнаружены у 36% пациенток.
Обнаружение крайне высокой частоты тяжелых акушерских осложнений в личном анамнезе у пациенток с ВТЭ (таблица 2) позволило еще до проведения исследований системы гемостаза сделать предположение о наличие тромбофилических состояний.
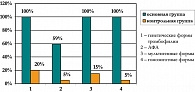
При анализе генетических форм тромбофилии и АФС у пациенток с ВТЭ получены следующие результаты (рисунок 3):
- в 100% случаев обнаружены генетические формы тромбофилии;
- у каждой пациентки выявлено по 4-6 форм тромбофилии (мультигенная тромбофилия обнаружена в 100%), включая одну или несколько гомозиготных форм (100%);
- в 85% случаев выявлены мультигенные дефекты фибринолиза;
- в 59% случаев обнаружены антифосфолипидные антитела;
- в контрольной группе достоверно реже выявлялись генетические тромбофилии (20%), циркуляция АФА (5%), мультигенные тромбофилии (15%), гомозиготные формы (5%), не было обнаружено наиболее тромбогенных мутаций (FV Leiden, мутации протромбина G20210A).
У пациенток с тромбозами в настоящую беременность после появления симптомов применялись терапевтические дозы НМГ под контролем D-димера до родов и после в течение минимум 6 недель. Летальный исход, связанный с массивной ТЭЛА, был зарегистрирован в 2 случаях (7,4%). Рождением живого плода у женщин из 1 подгруппы беременность закончилась в 89% случаев. Акушерские осложнения в этой подгруппе во время настоящей беременности составили 60% (тяжелые гестозы, антенатальная гибель плода, отслойка плаценты, СЗРП, ФНП). При сравнении подгруппы 2, в которой профилактика проводилась начиная с этапов планирования беременности, с подгруппой 1 рецидива ВТЭ не было ни в одном случае, акушерские осложнения наблюдались у 16% пациенток (легкие формы гестоза) (p < 0,05), в 100% случаев беременность закончилась рождением живых доношенных детей. Способ родоразрешения определялся акушерской ситуацией, но никак не характером антикоагулянтной терапии. Частота кесаревых сечений составила 56% в подгруппе 1 и 55% в подгруппе 2.
Профилактика ВТЭ
Важнейшим вопросом является профилактика тромбоэмболических осложнений беременности, как первичная у беременных из группы высокого риска, так и вторичная профилактика, которая имеет огромное значение как для матери, так и для плода. У пациенток с ТЭЛА во время беременности риск развития ВТЭ в следующую беременность значительно повышается и достигает 4-15% (49, 50). Единая тактика профилактики рецидива ВТЭ во время беременности на настоящее время не разработана и рекомендации варьируют от пассивного наблюдения до применения высоких доз гепарина в течение всей беременности и в послеродовом периоде (16, 51) (таблица 3). В связи с этим крайне важным является определение и анализ факторов риска развития тромбоэмболических осложнений и их рецидивов у каждой отдельно взятой пациентки.
Всем пациенткам показано ношение эластических чулок.
Как и в общей популяции, у пациенток с тромбоэмболическими осложнениями во время беременности необходима антикоагулянтная терапия не только в остром периоде тромбоза, но и длительная вторичная антикоагулянтная профилактика. Ее продолжительность колеблется от 3 месяцев до неопределенно долгих сроков в зависимости от причин тромбоза и наличия хронических факторов риска рецидива ВТЭ (44) (таблица 4). В то же время четких показаний к назначению длительной терапии пока не выработано. Также отсутствуют критерии, при помощи которых можно было бы опередить для каждого пациента в отдельности, нуждается ли он в продолжении антикоагулятной терапии или же ее прекращение является безопасным. В настоящее время предпринимаются первые попытки использования D-димера в качестве маркера хронического состояния гиперкоагуляции и предиктора рецидивов тромбозов при определении необходимости в продолжении антикоагулянтной терапии (56). Однако это вопрос требует дальнейшего изучения.
Таким образом, выявление патогенетической причины тромбоза является важным ориентиром для разработки дальнейшей тактики ведения пациенток с тромбоэмболическими осложнениями во время беременности.
В своей практике, как было указано выше, мы придерживаемся активной тактики ведения беременности у женщин с тромбоэмболическими осложнениями в анамнезе и тромбофилиями, которая включает обязательную комплексную терапию начиная с этапа планирования беременности: применение низкомолекулярного гепарина под строгим контролем гемостазиограммы, витаминную, антиоксидантную терапию, при необходимости антиагреганты и натуральный прогестерон. Такая тактика позволила нам в 100% случаев избежать рецидивов тромбоэмболических осложнений, развития тяжелых акушерских осложнений и добиться рождения живых доношенных детей. Обратите внимание, что грамотно подобранная антикоагулянтная терапия в этом случае имеет значение не только для матери, но и обуславливает исходы у плодов. Важно отметить, что использование стандартной коагулограммы не является показательным и достаточным. Часто она объективно не отражает степень имеющейся гиперкоагуляции, а при применении низкомолекулярного гепарина не происходит изменений ни одного из стандартных показателей коагулограммы (в том числе НМГ в отличие от стандартного нефракционированного гепарина не влияет на АЧТВ). Поэтому в своей практике мы широко используем маркеры тромбофилии: D-димер, комплексы тромбин-антитромбин (ТАТ), фрагменты протромбина F1+2, которые являются зеркалом текущего состояния системы гемостаза, позволяют говорить о степени повышения риска тромбоэмболических осложнений и диагностировать их, а также контролировать эффективность терапии НМГ.
Таким образом, выявление генетических форм тромбофилии не меняет тактику терапии в остром периоде тромбозов, однако позволяет определить длительность и интенсивность вторичной профилактики ВТЭ; наиболее эффективный и безопасный антикоагулянт; тактику ведения последующих беременностей, направленную на профилактику акушерских осложнений и ВТЭ; тактику при ситуациях, связанных с высоким риском тромбозов (оперативное вмешательство, прием оральных контрацептивов, заместительной гормональной терапии).
Выявление роли тромбофилий в патогенезе как акушерских, так и тромбоэмболических осложнений открывает перед исследователями большие перспективы: прогнозирование риска ВТЭ у пациенток с осложненной беременностью (первичная профилактика ВТЭ), разработка патогенетически обоснованной, эффективной и безопасной вторичной профилактики акушерских осложнений и ВТЭ.
Важнейшими показаниями для проведения скрининга на предмет тромбофилий являются идиопатический тромбоз; рецидивирующие тромбозы (особенно у лиц моложе 50 лет); отягощенный наследственный анамнез в отношении тромбоэмболических осложнений; тромбозы необычных локализаций (синдром Бадда–Киари, мезентериальный тромбоз, тромбоз церебральных вен); тромбоз на фоне приема оральных контрацептивов или ЗГТ; акушерские осложнения в личном и в семейном анамнезе (тромбоэмболические осложнения, тяжелый гестоз, отслойка плаценты, внутриутробная задержка развития плода, преждевременные роды, выкидыши, неудачи ЭКО); кожные некрозы на фоне приема оральных антикоагулянтов.
Препарат выбора – низкомолекулярный Гепарин
Низкомолекулярный гепарин по праву можно назвать препаратом века. В результате исследований, проводимых последние 20 лет, посвященных поиску форм гепарина, которые бы наилучшим образом отвечали соотношению структура–активность, был синтезирован низкомолекулярный гепарин, который включал фракции с более короткими молекулярными цепями с лучшим антитромботическим эффектом.
НМГ получают путем деполимеризации нефракционированного гепарина (НГ), молекулярная масса их колеблется в пределах от 4 до 5 кДа, в молекуле содержится приблизительно 15 моносахаридов. Деполимеризация может быть осуществлена химическим, энзиматическим и физическим методом (излучение). На сегодняшний день существует множество НМГ, производимых разными странами и различными методами, что обуславливает и некоторые отличия в биологической активности этих препаратов (таблицы 5,6). При подборе терапии следует учитывать, что различные препараты НМГ обладают различными свойствами, что может отразиться на их клинической эффективности.
Изменение структуры молекулы гепарина, т.е. уменьшение молекулярной массы почти в 3 раза, повлекло за собой и изменения в фармакодинамике и фармакокинетике. Для НМГ характерны более высокая биодоступность, чем у НГ, – почти 100%, больший период полужизни; они меньше связываются с различными белками (таблица 7), клетками; проявляют меньшую аффинность к фактору фон Виллебранда; почечный клиренс намного превалирует над клеточным (что важно учитывать у больных с почечной недостаточностью, особенно при скорости клубочковой фильтрации менее 30 мл/мин). НМГ намного меньше, чем НГ, связываются с клетками эндотелия, что также обеспечивает длительную циркуляцию препарата в плазме крови (в 2-4 раза больше по сравнению с НГ). Максимальный уровень анти-Ха-активности в плазме достигается через 3-4 ч и сохраняется 12 ч и более. Вследствие высокой биодоступности, более длительного периода полужизни, отсутствия зависимости клиренса от дозы препарата антикоагулянтный эффект НМГ более предсказуем по сравнению с НГ. Для поддержания необходимого уровня антикоагуляции достаточно введения НМГ 1-2 раза в сутки.
При беременности фармакокинетика НМГ может меняться вследствие увеличения объема распределения препарата и увеличения скорости его клиренса, поэтому при беременности предпочтительно применять НМГ 2 раза в сутки. Сравнительная характеристика НМГ и НГ представлена в таблице 8.
Механизм действия НМГ
Основное отличие механизма действия НМГ на систему гемостаза от НГ состоит в том, что НМГ обладают в основном анти-Ха-активностью, т.е. антитромбиновой.
Антикоагулянтный эффект НГ, как известно, зависит от уникального пентасахарида, который связываясь с АТ III, потенцирует ингибицию тромбина и фактора Ха антитромбином. Однако только около 1/3 всех молекул гепарина содержит эту уникальную пентасахаридную последовательность. Именно пентасахаридная последовательность обуславливает высокую аффинность к АТ III. Таким образом, почти 2/3 гепарина обладает минимальной антикоагулянтной активностью при терапевтических концентрациях, которые применяются в клинике. Для ингибиции тромбина гепарин должен формировать «мост», соединяющий АТ III и тромбин, однако для ингибиции FХа такое взаимодействие не требуется. Молекулы гепарина с количеством сахаридных единиц менее 18 неспособны одновременно связывать тромбин и АТ III и в результате не могут катализировать ингибицию тромбина. Фракции гепарина, содержащие меньшее количество сахаридов, способны катализировать ингибицию фактора Ха, при этом АТ III обеспечивает высокую аффинность пентасахаридной последовательности. Поскольку молекулы НМГ в большем количестве содержат фракции с массой менее 5000 Да, они в основном обладают анти-Ха-активностью.
Однако если в состав НМГ входят фракции, имеющие массу более 5400 Да, что эквивалентно наличию более 18 дисахаридных остатков, то также проявляется анти-IIа активность. Так, для одного из первых НМГ, Фраксипарина, молекулярная масса которого в среднем составляет 4500 Да, благодаря наличию фракций с молекулярной массой больше 5400 Да характерно соотношение активностей анти-IIа- / анти-Ха равное 1 : 4.
Характерно также, что нефракционированный гепарин не способен ингибировать фактор Ха, связанный с тромбоцитами, в отличие от НМГ.
НМГ способствуют также активации фибринолиза путем освобождения из эндотелия тканевого активатора плазминогена t-РА; кроме того, они меньше подвержены действию антигепаринового фактора 4 тромбоцитов и, соответственно, реже вызывают гепариновую иммунную тромбоцитопению.
Долгое время противотромботический эффект НМГ связывали исключительно с анти-Ха-активностью, пока не выяснилось, что только 30% активности НМГ осуществляется через АТ III и 70% – через так называемый ингибитор внешнего пути свертывания TFPI и другие фармакологические эффекты, такие, как высвобождение из эндотелия антиагрегантных субстанций (простациклин) и пр. Это объясняет, почему у пациентов сохраняется «антитромботическое состояние» после подкожного введения профилактической дозы НМГ в течение 24 ч, несмотря на то, что уже через 12 ч после инъекции анти-Ха-активность не обнаруживается.
Эффекты НМГ, не связанные с взаимодействием с АТ III:
- высвобождение TFPI;
- взаимодействие с гепарин-кофактором II;
- ингибиция прокоагулянтного действия лейкоцитов;
- активация фибринолиза;
- связывание с белками;
- модуляция сосудистого эндотелия (рецепторно- и нерецепторно-обусловленная).
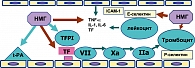
Благодаря успехам в области исследования системы гемостаза на сегодняшний день известно, что в генезе большинства тромботических проявлений огромную роль играет активация внешнего пути свертывания и выделение в кровь тканевого фактора TF. Этот механизм является доминирующим во время беременности, в перинатальном и послеоперационном периодах, при гнойно-септических заболеваниях, АФС, ожирении, онкологических заболеваниях, множестве кардиоваскулярных заболеваний и ряде связанных с ним состояний (пороки сердца, нестабильная стенокардия, атеросклероз, искусственные клапаны сердца, наличие кава-фильтра, чрескожная транслюминальная коронарная ангиопластика), а также при ряде тяжелых состояний: ТЭЛА, острый респираторный дистресс-синдром легких, отслойка плаценты, эмболия околоплодными водами и др.
TFPI-фактор, или LACI-фактор (липопротеин-ассоциированный ингибитор коагуляции), является мощным естественным ингибитором внешнего пути свертывания. НМГ значительно повышают его уровень в крови. Он контролирует обусловленный фактором Ха отрицательный feed-back-механизм и ингибирует комплексы TF/VII/ФЛ и TF/VIIa/Фл/Ха, которые через образование протромбиназы ведут к генерации тромбина и затем фибрина. Для TFPI характерны и другие потенциально антитромботические фармакологические свойства:
- ингибитор образования протеаз;
- прямой ингибитор фактора Ха и эластазы;
- ингибитор обусловленной тканевым фактором активации тромбоцитов и макрофагов;
- взаимодействие с липопротеинами низкой плотности с изменением их патологической роли (особенно при атеросклерозе);
- взаимодействие с сосудистым эндотелием;
- модуляция эндогенных гликозаминогликанов;
- нейтрализация эндогенно образующегося тканевого фактора;
- регуляторная функция.
В нормальных физиологических условиях TFPI первично синтезируется в микроваскулярном эндотелии и в небольших количествах мегакариоцитами и макрофагами и не синтезируется нормальными гепатоцитами или эндотелием крупных сосудов (большого калибра); незначительные количества TFPI исходят из фибробластов, однако при активации этих клеток уровень TFPI увеличивается в 6-8 раз.
Таким образом, in vivo существует 3 пула TFPI: 80-85% связано с гликозаминогликанами эндотелиоцитов, 10% – с липопротеинами в плазме и 3% представлено в тромбоцитах. TFPI имеет молекулярную массу 42 000 Да и включает в себя 3 участка с ингибиторной активностью. Ингибиция каталитической активности комплекса TF/FVIIa/ФЛ/Ха осуществляется в два этапа:
- средний домен TFPI связывает фактор Ха;
- первый домен TFPI связывает фактор VIIa в комплексе TF/VII/ФЛ.
Функция III домена не совсем ясна, хотя известно, что благодаря наличию С-терминального катионного «хвоста» TFPI может связываться с гликозаминогликанами на поверхности клеток.
В экспериментальных условиях при применении синтетических TFPI (синтезирован как TFPI с I и II доменами, так и TFPI, включающий все три домена) была установлена их протекторная роль в возникновении тромбозов и ДВС-синдрома, обусловленных введением тканевого тромбопластина и эндотоксина. Кроме того, был изучен эффект TFPI на рестеноз после повреждения интимы на модели животных. TFPI значительно снижал частоту возникновения рестенозов, обусловленных гиперплазией интимы после артериальных вмешательств. Это свидетельствует об особой роли TFPI при множестве кардиоваскулярных заболеваний и состояний, протекающих с TF-индуцированной гиперкоагуляцией, таких, как нестабильная стенокардия, атеросклероз, искусственные клапаны сердца, кава-фильтр, чрескожная транслюминальная ангиопластика.
Следует отметить, что различия низкомолекулярных гепаринов проявляются и на уровне стимуляции высвобождения TFPI. Эти различия могут лежать в основе различий антикоагулянтных свойств низкомолекулярных гепаринов.
Следует отметить, что при применении НМГ наблюдается гораздо менее выраженное высвобождение vWF по сравнению с НГ. Высвобождение vWF происходит в условии повреждения эндотелия. Взаимодействуя с рецепторами тромбоцитов IIb/IIIa, vWF активирует адгезию тромбоцитов к обнаженному субэндотелию и их агрегацию. Кроме того, vWF связывает фактор VIII, предотвращая инактивацию FVIIIa под действием протеина С и способствуя усилению образования фактора Xa и тромбина по внутреннему пути коагуляции. Повышение уровня vWF является маркером активации тромбоцитов, может способствовать развитию тромбозов и может служить маркером неблагоприятного исхода сердечно-сосудистых заболеваний (в частности, нестабильной стенокардии). И вновь между эффектами разных НМГ были выявлены различия.
Возвращаясь к эффектам НМГ, следует отметить, что независимо от патогенетического механизма тромбозов общим для них является активация тромбинового пути, и преимуществом НМГ является их способность препятствовать образованию тромбина различными путями. Если же учесть меньшую зависимость противотромботического эффекта НМГ от уровня АТ III, чем у НГ, то можно думать о более успешном применении НМГ у больных с дефицитом АТ III.
Таким образом, НМГ влияет на все компоненты механизма гемостаза: эндотелий, тромбоциты, факторы коагуляции, фибринолитическую систему.
Однако, по последним данным, эффекты гепарина могут быть обусловлены не только его антикоагулянтными свойствами. На сегодня доказана взаимосвязь процессов воспаления и коагуляции, которые могут взаимно активировать друг друга, приводя к формированию порочного круга. Так, помимо функции инициатора процессов коагуляции, тканевый фактор обладает еще и провоспалительной активностью, и его экспрессия значительно возрастает под влиянием провоспалительных цитокинов (TNF-a, IL-1b). Тромбин и фактор Xa, взаимодействуя с рецепторами из семейства PARs (рецепторы, активируемые протеазами), активируют продукцию провоспалительных цитокинов и процессы пролиферации, являющиеся ключевым звеном патогенеза атеросклероза, опухолевого роста.
В последнее время пристальное внимание уделяется изучению влияния НМГ на процессы воспаления и возможность его применения для лечения различных заболеваний, включая воспалительные заболевания кишечника, бронхиальную астму, аутоиммунные и сердечно-сосудистые заболевания. Так, НМГ обладает способностью ингибировать лейкоцитарно-эндотелиальные взаимодействия, являющиеся ключевым звеном процессов воспаления. Наличие анти-Ха-активности позволяет блокировать не только коагуляцию, но и процессы воспаления. НМГ обладает также антицитокиновым свойством вследствие подавления продукции важнейшего провоспалительного цитокина TNF-a. НМГ способен подавлять экспрессию TF, индуцированную под влиянием противовоспалительных цитокинов (TNF-a, IL-1b). Ключевым этапом воспалительного ответа является взаимодействие лейкоцитов при помощи Р-селектинов с сосудистой стенкой. Показано, что гепарин обладает способностью блокировать такое взаимодействие, что еще раз подтверждает наличие у данного препарата противовоспалительных свойств. Интересно, что, по последним данным, НМГ обладает большей противовоспалительной активностью по сравнению с НГ.
На рисунке 4 обобщены современные представления о механизме действия НМГ.
Механизмы действия НМГ:
- антикоагулянтный эффект достигается за счет анти-Xa-активности и антитромбиновой активности, высвобождения TFPI;
- механизмы противовоспалительной активности – ингибирование лейкоцитарно-эндотелиальных взаимодействий, антицитокиновые свойства (подавление экспрессии TNF-a), подавление экспрессии TF на эндотелии;
- активация фибринолиза – увеличение синтеза тканевого активатора плазминогена (t-PA) TFPI, подавление активации тромбоцитов за счет супрессии высвобождения vWF, слабая антиагрегантная и антиадгезивная активность.
Основные преимущества НМГ перед НГ
Благодаря меньшей молекулярной массе и большей биодоступности НМГ дольше циркулирует в крови и обеспечивает продолжительный противотромботический эффект в значительно меньших суточных дозах. Поэтому возможно однократное подкожное введение препарата в сутки; препараты (в частности, Фраксипарин, Эноксапарин, Далтепарин) не вызывают образование гематом в области инъекций. Пик анти-Ха-активности достигается в течение 3-5 ч, при этом антикоагулянтный ответ на НМГ более предсказуемый по сравнению с НГ. Период полувыведения НМГ более длительный, чем у НГ (5-6 ч), и не является дозозависимым.
Одно из важнейших качественных отличий НМГ от НГ – способность существенно не удлинять такие показатели, как АЧТВ, ТВ и др., что связано преимущественно с воздействием на фактор Ха и ингибицией внешнего пути свертывания.
НМГ в гораздо меньшей мере подвержены влиянию антигепаринового фактора 4 тромбоцитов, соответственно крайне редко вызывают тромбоцитопению и не вызывают гепарин-индуцированные тромбозы.
НМГ обладают рядом преимуществ перед НГ. Их отличают:
- хорошая биодоступность и быстрое всасывание при подкожном введении;
- более предсказуемое антикоагулянтное действие;
- меньший риск геморрагических осложнений;
- отсутствие необходимости в регулярном лабораторном контроле в период лечения;
- длительность действия и возможность подкожного введения 1-2 р/сут;
- минимальный риск развития гепарин-индуцированной тромбоцитопении, так как НМГ практически не взаимодействует с тромбоцитами и фактором 4 тромбоцитов;
- меньший риск развития остеопороза.
Как уже обсуждалось, каждый из НМГ имеет свои биологические, фармакокинетические и терапевтические особенности – эти препараты не взаимозаменяемы.
Далтепарин (Фрагмин) имеет молекулярную массу 4-6 тыс. дальтон. Активным веществом является далтепарин натрия, выделенный в процессе контролируемой деполимеризации гепарина азотистой кислотой. Основным свойством далтепарина является выраженное влияние на Ха-фактор при слабом влиянии на тромбин. Далтепарин выпускается в одноразовых шприцах по 2500 МЕ, 5000 МЕ и 10 000 МЕ. Далтепарин назначают в дозе из расчета 100-200 анти-Ха/кг 1-2 раза в сутки подкожно. С профилактической целью далтепарин назначается в дозе 2500-5000 МЕ 1 раз в сутки.
Эноксапарин натрия (Клексан, Ловенокс) – НМГ с высокой активностью в отношении Ха-фактора свертываемости и низкой активностью в отношении фактора IIа (тромбин). В 1 мг эноксапарина натрия содержится 100 анти-Ха-единиц (по международному стандарту НМГ). При подкожном введении эноксапарин быстро и практически полностью всасывается. Антитромботическая активность эноксапарина сохраняется на протяжении 24 ч, что позволяет вводить препарат 1 раз в сутки. В дозах, используемых для профилактики венозных тромбозов, практически не влияет на время кровотечения, время свертываемости, агрегацию тромбоцитов. Профилактическая доза эноксапарина натрия составляет 40 мг в сутки подкожно, а максимальная доза – 80–100 мг/сут.
Надропарин кальций (Фраксипарин) выпускается в одноразовых шприцах по 0,3 мл (2850 МЕ анти-Ха), 0,4 мл (3800 МЕ анти-Ха), 0,6 мл (5700 МЕ анти-Ха), 0,8 мл (7600 МЕ анти-Ха), 1 мл (9500 МЕ анти-Ха), 0,6 мл форте (11400 МЕ анти-Ха). Надропарин кальций 1 мл эквивалентен 9500 МЕ анти-Ха-факторной активности надропарина кальция. Надропарин кальций представляет собой НМГ, который характеризуется более высокой анти-Xа-факторной активностью по сравнению с анти-IIа-активностью. Анти-Xа-активность сохраняется в течение 18 ч. Отношение между этими видами активности для надропарина кальция находится в пределах 2,5-4. В профилактических дозах надропарин не вызывает выраженного снижения АЧТВ. При курсовом лечении в период максимальной активности возможно увеличение АЧТВ до значения, в 1,4 раза превышающего стандартное. Такое пролонгирование отражает остаточный антитромботический эффект надропарина кальция. Таким образом, в качестве базисного терапевтического агента используется надропарин кальций в дозах 0,3-1 мл (150-250 ICU/кг) в зависимости от выраженности тромбофилии.
Заключение
С современных позиций диагноз «тромбоз», за которым может скрываться целый ряд аномалий системы гемостаза, не может полностью удовлетворять клинициста. Диагноз тромбоза подобен диагнозу анемии, когда, помимо характерных клинических симптомов, для врача важны результаты лабораторных и инструментальных исследований для определения причины анемии и назначения патогенетически обоснованного лечения. Так, выявление АФА у пациента с тромбозом свидетельствует о необходимости длительной антикоагулянтной терапии с применением НМГ и аспирина и отказа от использования варфарина и глюкокортикоидов. Гипергомоцистеинемия, как генетически обусловленная, так и приобретенная, эффективно корригируется при помощи фолиевой кислоты и витаминов группы В, синдром липких тромбоцитов – при помощи аспирина.
Ведущую роль в возникновении тромбоэмболических осложнений во время беременности играют три основных фактора: генетические тромбофилии, гипергомоцистеинемия и антифосфолипидный синдром. В условиях гиперкоагуляции, которая наблюдается во время беременности, происходит декомпенсация системы гемостаза, и тромбофилии проявляются клинически развитием тромбоэмболических и акушерских осложнений. Наиболее неблагоприятным в отношении тромбоэмболических осложнений у беременных является сочетание мультигенных форм тромбофилии и АФС и наличие гомозиготных форм тромбофилии. Следовательно, беременность можно назвать экзаменом, выявляющим все ранее скрытые аномалии гемостаза, которые приводят к возникновению акушерских и/или тромбоэмболических осложнений.
Выявление у большинства пациенток с ВТЭ во время беременности множественных дефектов фибринолиза свидетельствует об их ведущей роли в возникновении тромбоэмболических осложнений. Возникновение тромбозов может быть обусловлено декомпенсацией системы гемостаза в условиях торможения фибринолиза, свойственного физиологической беременности, и в условиях нарушений фибринолиза, связанных с циркуляцией антифосфолипидных антител. К этим факторам добавляются дефекты сразу нескольких факторов, отвечающих за функционирование фибринолитической системы.
У всех пациенток с тромбозами и с акушерскими осложнениями во время беременности или в анамнезе (как личном, так и семейном) необходимо проводить скрининг на наследственные формы тромбофилии. Это позволяет определить дальнейшую тактику лечения пациентки, его длительность, выбор препарата, позволяет предотвратить как тромбоэмболические, так и акушерские осложнения при планировании последующей беременности, дать пациентке рекомендации по антикоагулянтной терапии при возникновении внешних факторов риска тромбозов (травма, оперативные вмешательства), провести при необходимости исследование на тромбофилии у родственников пациентки. Кроме того, пациенткам с тромбофилиями абсолютно противопоказана оральная контрацепция и заместительная гормональная терапия.
Открытие генетических форм тромбофилии и АФС, изучение их роли в патогенезе тромбозов, разработка эффективной терапии и профилактики ВТЭ позволяет нам говорить о том, что тромбоэмболические осложнения являются предотвратимыми причинами материнской смертности.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.