Дифференцированный подход к выбору метода иммунокорригирующей терапи в акушерстве и гинекологии
- Аннотация
- Статья
- Ссылки


Этиологическая структура воспалительных заболеваний половых органов женщины крайне разнообразна. Спектр возбудителей включает в себя десятки видов всех классов микроорганизмов: бактерии, вирусы, простейшие и грибы (2, 20, 21). Преобладают смешанные инфекции, в составе которых частота вирусных агентов и их ассоциаций достигает 50%. При внутриутробном инфицировании резко увеличивается частота ассоциированных с вирусными поражениями осложнений беременности. Преобладают в этой общей структуре потери беременности и плацентарная недостаточность (2, 8, 14, 22). Среди инфекционных причин антенатальной смертности вирусные и смешанные (вирусно-бактериальные инфекции) составляют 75% (14, 15, 28). В акушерстве и гинекологии наибольшее значение имеют не только заболевания половых органов, но и инфекции с преобладанием экстрагенитальных поражений: генитальный герпес, папилломавирусная и цитомегаловирусная инфекции. Среди всех женщин, контаминированных вирусами, более 60% приходится на лица репродуктивного возраста (20-25 лет) (13, 19).
В последнее время стало понятным, что без использования современных достижений фундаментальной и клинической иммунологии решение проблемы вирусной патологии практически невозможно. Успехи в области молекулярной и биохимической вирусологии связаны с раскрытием стратегии вирусного генома, выявлением особенностей биосинтеза вирус-специфических макромолекул. Тем не менее, проблема профилактики и лечения различных острых и хронических, в т. ч. персистирующих вирусных инфекций, еще далека от окончательного разрешения (3, 5, 9, 12, 25, 27).
Еще одним вопросом определения выбора метода контроля за эффективностью лечения является установление критериев бактериологической, вирусологической излеченности женщин (2, 7, 8, 17, 18, 21, 23). Неадекватная оценка тяжести течения инфекционного процесса и неправильно разработанная стратегия терапии приводят к развитию аутоиммунной патологии и хронизации воспалительных заболеваний (3, 10, 11, 16, 29).
В структуре патологии, связанной с персистирующими, рецидивирующими инфекциями, глобальной проблемой являются нарушения иммунитета. В настоящее время более трети всей патологии человека протекает в сочетании с клиническими признаками иммунной недостаточности, что определяет тяжесть клинических проявлений заболевания, развитие осложнений и ухудшение прогноза. Именно снижение локальной и общей резистентности организма приводят к длительно существующим заболеваниям. Кроме того, герпетическая, цитомегаловирусная инфекция, вызванная вирусом Эпштейн-Барр, папилломавирусная инфекции в первую очередь приводят к патологии самой иммунной системы. При этом клинические проявления заболеваний возникают при иммунодефицитных состояниях (13, 19, 25, 28).
Физиологический иммунодефицит, возникающий во время гестации, создает состояние длительно существующего повышения риска манифестации и рецидивирования персистирующих инфекций у беременных и новорожденных (22, 24, 26).
В настоящее время основой правильной врачебной деятельности является использование принципов доказательной медицины, основывающейся на знании использования эффективных лечебных воздействий и подтверждения их безопасности. Именно оценка соотношения предполагаемой пользы к прогнозируемому (ожидаемому) риску является краеугольным камнем качественной клинической практики (18). Особенно высокие требования к безопасности назначаемого медикаментозного лечения предъявляются в акушерстве и педиатрии.
В то же время все имеющиеся в литературе положения о принципах назначения иммуномодулирующей терапии носят лишь рекомендательный характер и требуют обязательной коррекции у каждого конкретного пациента с учетом многих факторов: возраста, сопутствующих заболеваний и их тяжести, особенностей проводимой базисной терапии по поводу основного заболевания и многие другие (4, 10, 17).
В связи с этим целью настоящего исследования стало:
- проведение сравнительной оценки эффективности применения рекомбинантного a2-интерферона (Виферона) у женщин с различными вирусными инфекциями;
- определение клинических ситуации путем объединения анализа результатов нескольких одновременно проведенных исследований, при которых использование Виферона приводит к достижению несомненного положительного результата.
Следует отметить, что среди задач проведенных исследований отдельно не выделялась оценка безопасности применения Виферона. Многочисленные исследования неоднократно подтверждали высокую безопасность использования Виферона, в т. ч. и у беременных.
Превентивная терапия генитального герпеса у беременных
На первом этапе исследования было проведено изучение возможности профилактического использования рекомбинантного человеческого интерферона – Виферона для профилактики рецидивов генитального герпеса у беременных с целью снижения частоты осложнений гестации, ассоциированных с вирусным поражением, кесарева сечения, связанного с рецидивом генитального герпеса накануне родоразрешения и внутриутробных инфекций.
Принято считать, что у больных с рецидивирующими герпесвирусными инфекциями имеется изолированный или сочетанный дефект противогерпетического иммунитета – специфический иммунодефицит.
В многочисленных исследованиях доказаны нарушения в различных звеньях иммунного ответа во время рецидивов герпетической инфекции: недостаточная выработка противогерпетических гаплотипоспецифических иммуноглобулинов G и/или снижение авидности (прилипчивости) антител-иммуноглобулинов М; на пике виремии при многочисленных рецидивах инфекции уровень γ-интерферона почти в два раза ниже возрастного норматива; нарушение выработки гаплотипоспецифических T-киллеров (11, 12, 19).
Интерфероны наиболее активны по отношению к репродуцирующимся вирионам. В терапевтическом аспекте у интерферонов наиболее выражена профилактическая активность. Интерфероны сдерживают процесс размножения и снижают концентрацию вируса в тканях. Однако экзогенно привнесенные интерфероны обладают кратковременным эффектом, а активность и количественный резерв эндогенных интерферонов у каждого человека генетически индивидуален (11, 25, 27).
Нами выполнено обследование и лечение 74 женщин с генитальным герпесом, диагностированным более чем за год до наступления беременности. До начала лечения из 74 больных, имевших в анамнезе проявления генитального герпеса, только 16,2% предъявляли жалобы на зуд, жжение, боль в очагах поражения, повышение температуры тела во время рецидивов заболевания. Основными жалобами являлись парестезии и высыпания, слабость, головная боль, быстрая утомляемость, которые наблюдались у 91,7% пациентов.
Зарегистрированными морфологическими элементами рецидивов генитального герпеса являлись везикулы на фоне гиперемированной слизистой оболочки и кожных покровах. В 86,4% наблюдений высыпания представляли собой мокнущие эрозии с тенденцией к слиянию. Сочетанное поражение нескольких областей половых органов отмечено в 28,3%. Локализация высыпаний у женщин была представлена слизистой оболочкой вульвы, влагалища и шейки матки, кожей наружных половых органов, ягодиц и бедер.
Количество рецидивов на протяжении последнего года до лечения колебалось от 3 до 14 раз. Частота рецидивов до наступления беременности в среднем составляла 6,23±2,1 в год, во время беременности – 4,88±3,05.
В состав обследования, кроме клинических методов исследования, входило выявление ДНК первого и второго типов ВПГ с помощью полимеразной цепной реакции ежемесячно. Определение титра специфических антител с помощью иммуноферментного анализа в начале исследования дважды с интервалом в 2-3 недели, а затем – каждые два месяца. Также проводили микроскопию вагинальных и уретральных мазков, окрашенных по Граму, диагностику гонореи, трихомониаза, папилломавирусной, микоплазменной и хламидийной инфекции.
Основной противовирусный курс виферонотерапии назначали в 28-30 недель. Назначали Виферон-2 по 1 свече через 12 ч (20 свечей), затем – по 1 свече через 12 ч 2 раза в неделю (10 свечей). Повторно аналогичный курс Виферона применяли в 35-36 недель гестации.
Под воздействием лечения клинические проявления генитального герпеса существенно видоизменялись и принимали абортивное течение. Частота обнаружения типичных высыпаний не превышала 65,2%, при этом атипичная локализация местных проявлений встречалась у 26,1% больных.
Клинические проявления генитального герпеса были более выражены у серонегативных, чем у серопозитивных лиц, что свидетельствует о протективной роли иммуноглобулинов, приводящих к частичной инактивации вирусов.
В ходе проведения исследования было установлено, что имеется корреляция между частотой рецидивов до и после начала лечения (рисунок 1).
Так, у 14 пациенток, частота рецидивов генитального герпеса у которых до начала исследования колебалась от 8 до 11 в год, на фоне проводимой терапии снизилась до 3-4 раз в год. Также, у лиц с исходной частотой обострений 3-4 раза в год на фоне проводимой терапии клинические проявления герпетической инфекции наблюдались 0-2 раза в год. Положительная динамика показателей интерферонового статуса сопровождалась снижением частоты репликативных форм ВПГ-инфекции с 79,3% до 45%. Частота рецидивов генитального герпеса, преимущественно за счет типичной его формы, тяжелого и среднетяжелого течения, сократилась в 2 раза.
То есть, при исходно высокой частоте рецидивов не удается добиться полноценной ремиссии на протяжении беременности. В то же время, использование Виферона в качестве превентивной терапии генитального герпеса сопоставимо по эффективности с назначением противовирусных препаратов (10, 12, 17). Следует также отметить, что применение Виферона больным после неэффективной терапии препаратами ацикловира позволяет уменьшить частоту рецидивов в 2,8 раза.
Кроме того, уменьшилась частота рецидивов бактериального вагиноза у беременных, инфицированных микоплазмами и уреаплазмами – с 51 до 28,8%. В целом снизилось общее число осложнений беременности, таких как, угроза прерывания беременности – с 62 до 31,9%; многоводия – с 30,3 до 10% и маловодия – с 28,4 до 9%.
Определение генома вирусов простого герпеса I и II типов показало, что в межрецидивном промежутке количество лиц с бессимптомным выделением вируса до начала исследования достигало 16,7%. В группе пациентов, получавших Виферон, к окончанию терапии бессимптомное выделение вируса зарегистрировано у 6,5%.
Показатели уровня специфических иммуноглобулинов в обеих группах достоверно не отличались. При этом после первого курса Виферона у всех исходно серопозитивных пациентов уровень иммуноглобулинов класса G не имел тенденции к снижению. Сероконверсия произошла у 14 из 20 пациентов.
Следует подчеркнуть, что на основании имеющихся данных невозможно говорить об элиминации вируса герпеса из организма.
Таким образом, при проведении превентивной терапии генитального герпеса у беременных целесообразно использование интерферонов в комплексе с антиоксидантами, что присуще Виферону, который имеет ряд преимуществ по сравнению с другими препаратами интерферона. Использование Виферона во II и III триместрах гестации позволяет в 3-6 раз снизить частоту рецидивирования генитального герпеса накануне родоразрешения, что приводит к уменьшению осложнений беременности, оперативного родоразрешения и перинатальной заболеваемости.
Использование интерферонов при бактериальных генитальных инфекциях
Протективное действие интерферонов при вирусных инфекциях несомненно. В то же время, среди инфекций, передаваемых половым путем, большую часть занимают бактериальные поражения с внутриклеточной персистенцией возбудителя. Доказано, что комбинация антибактериальных препаратов и интерферонов обладает синергичным противоинфекционным действием. Однако имеются данные о быстром формировании антител к интерферону при его экзогенном введении. Только сочетание интерферона с антиоксидантами (витаминами А и Е) позволяет предупредить подобный негативный эффект, обусловливающий последующую неэффективность терапии (8, 9, 10).
Наиболее типичной среди ИППП с внутриклеточной персистенцией возбудителя является хламидийная инфекция. Было проведено слепое про- и ретроспективное обследование 5430 беременных на базе родильного дома и консультативно-диагностического центра при ГКБ № 7 с 2001 по 2006 год.
Частота встречаемости заболеваний, передаваемых половым путем, составила 17,85% (969). Структура ИППП у беременных была представлена хламидийной (24,56%), микоплазменной (8,36%), уреаплазменной (3,1%), трихомонадной (4,85%), смешанной (59,13%) инфекциями.
Острые и обострения хронических вирусных заболеваний наблюдались в 10,24% (556 случаев) и были представлены герпетическими поражениями (8,34%), цитомегаловирусной инфекцией (0,78%) и папилломавирусной (1,12%) инфекциями.
Высокая частота смешанных инфекций при хламидиозе, наличие малосимптомного и латентного его течения приводят к необходимости комплексной диагностики инфекций, передаваемых половым путем, и нарушений микроценоза влагалища.
Ни один из современных методов диагностики хламидиоза не обеспечивает стопроцентной надежности. Поэтому лабораторная диагностика должна основываться на сочетании минимум двух методов, одним из которых должен являться культуральный. Наиболее достоверным методом диагностики хламидиоза является сочетание культурального исследования и полимеразной цепной реакции (7, 20, 29).
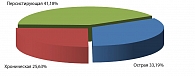
У 238 беременных острая хламидийная инфекция (длительность заболевания менее 2 месяцев) имелась у 79 (33,19%), хроническая (более 2 месяцев) – у 61 (25,63%), персистирующая – у 98 (41,18%) женщин. Таким образом, преобладающим вариантом течения являлась персистирующая и острая хламидийная инфекция (рисунок 2).
Под нашим наблюдением в ходе проспективной части исследования находились 72 беременные со сроком гестации 29-41 неделя, у 33 (45,83%) из которых диагностирована неэффективность лечения в анамнезе острого или хронического хламидиоза, а также 28 (38,89%) женщин – с персистирующей инфекцией и 11 (15,28%) беременных, прекративших ранее начатую терапию по немотивированным причинам. До включения в исследование больные получали различную антибиотикотерапию: в первой подгруппе 16 (57,14%) беременных по поводу хламидийной инфекции принимали эритромицин по 1-3 г в сутки, 9 – джозамицин по 1 г в сутки, 8 – спирамицин по 9 млн ЕД в сутки. Необходимо отметить неадекватность суточной дозы эритромицина и джозамицина для лечения хламидиоза (18).
Интересным представляется факт, что 9 из 11 беременных, прекративших начатое лечение самостоятельно (81%), получали эритромицин и спирамицин. При целенаправленном расспросе в ходе настоящего исследования удалось выяснить, что они мотивировали отказ от терапии «опасностью для ребенка» при приеме «таких высоких доз» антибиотика.
Всем пациенткам лечение назначалось после проведения собеседования, включавшего разъяснение особенностей течения хламидийной инфекции, ее опасности для беременной и плода, необходимости проведения антибактериальной терапии и лечения, направленного на купирование осложнений беременности, действия лекарственных препаратов. Терапия, включавшая пероральный прием препарата джозамицина по 500мг 3 раза в сутки на протяжении 10 дней в сочетании с ректальным введением Виферона-2 по 1 свече (500 000 МЕ) через 12 ч (20 свечей), затем по 1 свече через 12 ч 2 раза в неделю (10 свечей), была проведена 47 беременным. Такой же режим введения антибиотика, но в сочетании с интравагинальным введением препарата Кипферон по 1 свече 2 раза в сутки в течение 10 дней был использован у 25 женщин. Всем половым партнерам больных проводилось обследование и лечение генитальных инфекций.
Контроль эффективности терапии осуществляли на основании результатов полимеразной цепной реакции через 4 недели после лечения. Лечение считали эффективным при отсутствии обнаружения генома Chlamydia trachomatis. При положительных результатах первой ПЦР выполняли культуральное исследование (или ПЦР через 5-6 недель).
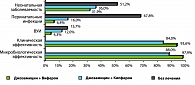
Микробиологическая эффективность применения комплексного лечения, включавшего Виферон у беременных с хламидийной инфекцией по результатам первого контрольного обследования составила 93,06%.
В 3 наблюдениях при положительных результатах первой полимеразной цепной реакции не обнаружено роста C. trachomatis на культуре клеток McCoy. В течение 3 месяцев наблюдения микробиологически верифицированная персистенция хламидий после лечения сохранялась у 2 женщин (2,78%). Таким образом, сочетание адекватной антибактериальной терапии и рекомбинантного интерферона – Виферона, обладает высокой терапевтической эффективностью (97,22%) для лечения урогенитального хламидиоза во время беременности (рисунок 3). Важно отметить, что такие высокие показатели эффективности лечения достигнуты в группе женщин с рецидивирующей и персистирующей хламидийной инфекцией.
В то же время сочетание антибактериальной терапии с интравагинальным введением Виферона приводило к достижению эффективности лечения менее чем у 90% женщин, что недостаточно при ведении случая ИППП. На протяжении исследования не было зарегистрировано отказов от рекомендованного лечения.
В настоящем исследовании большую часть пациенток составили женщины в III триместре беременности. Это привело к незначительному снижению частоты сонографических и морфологических изменений последа после проведенного лечения. В то же время, частота перинатальных инфекций, достигавшая 67,8% у женщин со специфическими инфекциями, снизилась до 6,4% после проведения терапии, включавшей Виферон. При этом общие показатели перинатальной заболеваемости составили 511,5‰ и 319,1‰ соответственно. Не было отмечено случаев хламидийной пневомнии и генерализованной инфекции у новорожденных, матери которых получали комплексное лечение, включавшее Виферон.
Таким образом, при бактериальных инфекциях с внутриклеточной персистенцией возбудителя (хламидиоз) использование препаратов интерферона (Виферон) приводит к ускорению элиминации возбудителя. Препарат Кипферон недостоверно меняет показатели эффективности терапии. Применение препаратов рекомбинантного интерферона, сочетающихся с антиоксидантами, показано в составе комбинированной терапии при бактериальных инфекциях с внутриклеточной персистенцией возбудителя, вирусных инфекциях половых органов, часто рецидивирующих и длительно протекающих ИППП.
Современные интерфероны в лечении папилломавирусной инфекции
В последние годы среди вирусных инфекций, передающихся половым путем, наибольшего внимания заслуживает возрастающая заболеваемость папилломавирусной инфекцией. Высокая контагиозность этой инфекции, подтвержденная роль некоторых разновидностей вируса папилломы человека (ВПЧ) в развитии злокачественных процессов, привлекают внимание врачей различных специальностей: акушеров-гинекологов, урологов, дерматовенерологов, онкологов, иммунологов, вирусологов (1, 6, 13, 20).
Папилломавирусная инфекция часто сочетается с другими заболеваниями, передающимися половым путем. Наиболее существенным является ее сочетание с бактериальным вагинозом, урогенитальным хламидиозом, цитомегаловирусной и герпетической инфекциями (1, 13).
Ни один из существующих методов лечения не обеспечивает полной элиминации вируса из организма больного. Высокая частота рецидивирования клинических форм заболевания и субманифестное его течение чаще обусловлены не реинфицированием, а реактивацией эндогенного вируса, что потенцирует поиск новых эффективных способов терапии.
Проведено комплексное обследование и лечение 68 женщин с различными формами папилломавирусной инфекции в возрасте от 17 до 45 лет. У всех пациенток имелись кондиломы аногенитальной области. Продолжительность существования кондилом по данным анамнеза в среднем составила 22,78 месяца и колебалась от 2 месяцев до 14 лет.
Среди обследованных 36 больным ранее проводились неоднократные попытки лечения папилломавирсуной инфекции, включавшие хирургические методы и местную интерферонотерапию. По данным анамнеза в течение 1 года после проведенного лечения частота рецидивов составила в среднем 36,1%. До начала лечения только 13,2% (9) больных предъявляли жалобы на зуд, жжение, дискомфорт в очагах поражения.
Всем пациенткам проводили клиническое обследование, расширенную кольпоскопию, цитологическое исследование мазков, микроскопию мазков, окрашенных по Грамму, тесты на бактериальный вагиноз, методом полимеразной цепной реакции определяли наличие следующих микроорганизмов: Chlamydia trachomatis, Mycoplasma genitalium, Mycoplasma hominis, Ureaplasma urealyticum, Ureaplasma parvum, Candida albicans, Herpes simplex virus, Cytomegalovirus. По показаниям выполняли биопсию шейки матки с последующим морфологическим изучением биоптатов с окраской по Ван-Гизону. У всех больных методом полимеразной цепной реакции с типоспецифическими маркерами определяли содержание вируса папилломы человека в материале, взятом из очагов поражения. Одновременно учитывали тип и качество онкогенного потенциала выделенных ВПЧ. Высокоонкогенными считали типы 16, 18, 31, 33, 35, 45, 56, а низкоонкогенными – 6, 11, 42, 43, 44.
Смешанные инфекции были диагностированы у 79,4% (54) пациенток. Наряду с папилломавирусной инфекцией в качестве сопутствующих генитальных инфекций у 26,5% (18) больных был обнаружен генитальный кандидоз, у 52,9% (36) – бактериальный вагиноз; 16,2% (11) пациенток были инфицированы хламидиями, 20,6% (14) – микоплазмами, 5,9% (4) – трихомонадами, 11,8% (8) – цитомегаловирусом (рисунок 4). Кроме того 12 женщин (17,6%) ранее имели проявления генитального герпеса. Инфекционные поражения половых органов, вызванные тремя и более возбудителями, отмечены у 27 (39,7%) обследованных.
Всем больным для удаления кондилом вне зависимости от их локализации применяли фотовапоризацию с помощью СО2-лазера. Одновременно начинали введение Виферон-2 по 1 свече через 12 ч (20 свечей), затем по 1 свече через 12 ч 2 раза в неделю (10 свечей). Представленная схема виферонотерапии является основным противовирусным курсом. В указанном режиме Виферон повторно назначается через 1-2 месяца даже при отсутствии рецидивов кондилломатоза. При наличии смешанной инфекции параллельно использовали необходимые методы специфической терапии.
После проведенного лечения на протяжении 1 года проводилось наблюдение за пациентками, включавшее кольпоскопию, цитологические исследования, контроль за элиминацией выделенных микроорганизмов с помощью полимеразной цепной реакции.
В результате проведенной работы было отмечено, что жалобы на зуд и жжение в области половых органов регрессировали у всех больных. Кроме того, через 1 месяц после лечения ни у одной пациентки не было повторного возникновения кондилом. Через 3 месяца после лечения Вифероном только у 5 из 68 больных вновь было отмечено появление аногенитальных бородавок. Эти женщины имели наибольшую частоту рецидивов заболевания в анамнезе.
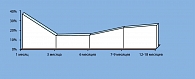
Общая частота рецидивирования клинических проявлений папилломавирусной инфекции составила 14,7%. Определение генома вирусов папилломы человека показало, что даже при отсутствии морфологических элементов на коже и слизистых бессимптомное выделение вируса достигает в первый месяц после лечения 34,8%, к третьему месяцу – 12,7%, а повышение регистрируется к 7-9-му месяцу после лечения и составляет 20,6%. То есть, показатели клинического выздоровления при папилломавирусной инфекции выше, чем вирусологическое подтверждение излеченности (рисунок 5).
Несмотря на невозможность полноценной элиминации папилломавирусов из организма человека, после второго курса введения Виферона нами было достигнуто клинико-этиологическое излечение у 56 (82,3%) из 68 женщин. В результате динамического наблюдения было установлено, что частота рецидивов папилломавирусной инфекции в течение 1 года на фоне комплексной терапии с использованием Виферона сократилась в 2,5 раза.
В результате динамического наблюдения было установлено, что частота рецидивов ВПЧ-инфекции в течение 1,5 лет на фоне комплексной терапии с использованием Виферона-2 сократилась в 2,5 раза.
Таким образом, системное применение рекомбинантного человеческого интерферона – Виферона в составе комплексного лечения папилломавирусной инфекции позволяет добиться клинического и вирусологического выздоровления в 82% наблюдений. Повторное введение Виферона-2 уменьшает частоту рецидивов папилломавирусной инфекции. Корригирующее влияние интерферонов в сочетании с антиоксидантами на несколько этапов иммунного ответа позволяет повысить эффективность лечения папилломавирусной инфекции.
Проведенные исследования показали, что использование современного рекомбинантного интерферона (Виферон) повышает эффективность лечения женщин с вирусными и бактериальными инфекциями половых органов. Применение Виферона у беременных с генитальными инфекциями не только повышает эффективность лечения, но и уменьшает заболеваемость, частоту осложнений оперативного родоразрешения и течения беременности, ассоциированных с инфекциями, улучшает течение родов и показатели здоровья новорожденных.
В результате проведенного исследования целесообразно выделить несколько клинических ситуаций, при которых имеется высокая целесообразность назначения Виферона:
- наличие генитального герпеса в анамнезе – показано назначение Виферона-2 в 28-30 и 35-36 недель гестации (по 1 свече через 12 ч 10 дней, затем по 1 свече через 12 ч 2 раза в неделю – 10 свечей); Возможно использование только Виферона, без супрессивной противовирусной химиотерапии;
- в составе комплексного лечения смешанных вирусно-бактериальных инфекций;
- для повышения эффективности терапии бактериальных инфекций с внутриклеточной персистенцией возбудителя;
- при лечении беременных с осложнениями, связанными с инфекционным поражением (фетоплацентарная недостаточность, синдром задержки роста плода, длительная угроза прерывания беременности, внутриутробное инфицирование, инфекции мочевыводящих путей, острый аппендицит);
- в лечении женщин с папилломавирусной инфекцией (Виферон-2 по 1 свече через 12 ч 10 дней, затем по 1 свече через 12 ч 2 раза в неделю – 10 свечей; повторный курс лечения – через 1-2 месяца).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.