Эффективность патогенетической терапии при ведении беременности у женщин с метаболическим синдромом и тромбофилией
- Аннотация
- Статья
- Ссылки
На I Международном конгрессе по преддиабету и МС (Берлин, 2005), оценивая результаты национальных исследований, австралийский ученый П. Зиммет назвал МС пандемией XXI века. По данным разных авторов, среди населения старше 30 лет распространенность МС составляет 10-30%.
В 1980 г. немецкие ученые M. Hanefeld и W. Leonhardt предложили термин «метаболический синдром». Приоритет в описании МС принадлежит G.M. Reaven, который в 1988 г. впервые на основании собственных наблюдений и обобщения исследований других авторов предложил концепцию МС, в соответствии с которой сочетание нарушения толерантности к глюкозе (НТГ) и компенсаторной гиперинсулинемии (ГИ), повышения уровня триглицеридов (ТГ) и снижения уровня холестерина липопротеинов высокой плотности (ЛПВП) и артериальная гипертензия (АГ) не случайно, а развивается в результате общего патогенетического механизма – снижения чувствительности тканей к инсулину. G.M. Reaven предложил для обозначения этого симптомокомплекса термин «синдром Х». Как полагают, именно инсулинорезистентность (ИР) и компенсирующая ее гиперинсулинемия являются основным патогенетическим звеном развития МС.
В 1989 г. N.M. Kaplan дополнил понятие МС абдоминальным ожирением и привел данные, свидетельствующие о неблагоприятном прогнозе сочетания НТГ, АГ, ожирения и отсроченной дислипидемии, назвав его «смертельным квартетом».
S.M. Haffner в 1992 г. предложил понятие «синдром инсулинорезистентности», который наиболее точно отражает этиологию данного состояния.
В 1998 г. рабочая группа ВОЗ составляющими компонентами МС признала следующий симптомокомплекс: висцеральное (абдоминальное) ожирение, ИР, ГИ, НТГ или инсулиннезависимый сахарный диабет (ИНСД), АГ, дислипидемия, нарушения гемостаза, гиперурикемия, микроальбуминурия (1, 6, 13).
В настоящее время в понятие МС включают гиперандрогению у женщин, синдром поликистозных яичников, гиперлептинемию, лептинорезистентность, гипертрофию миокард, повышение уровня свободных жирных кислот в крови, синдром апноэ во сне, активизацию симпатической нервной системы, наличие оксидативного стресса, провоспалительный статус, протромботический статус: повышение содержания фибриногена в крови, увеличение адгезивной и агрегационной способности тромбоцитов, повышение активности ингибитора активатора плазминогена-1 (PAI-1) (1, 2, 7, 8, 9, 11).
В апреле 2005 г. Международная федерация по диабету определила единые критерии диагностики МС: обязательный критерий – центральный тип ожирения (окружность талии более 94 см у мужчин, и более 80 см у женщин европеоидной расы) плюс минимум 2 из 4 критериев (уровень ТГ 1,7 ммоль/л или выше либо специфическое лечение дислипидемии; уровень ЛПВП ниже 1,03 ммоль/л у мужчин и ниже 1,29 ммоль/л у женщин либо специфическое лечение; АД выше 130/85 мм рт. ст. либо антигипертензивная терапия; уровень глюкозы натощак 5,6 ммоль/л или выше либо ранее выявленный СД 2 типа).
В последнее время особое внимание уделяется изучению тромбофилических осложнений при МС. При МС имеется тенденция к гиперкоагуляции (повышение концентрации фибриногена и активности VII фактора свертывания крови) и нарушению эндогенного фибринолиза, что сопряжено с повышением тромбогенного потенциала и может быть обусловлено несколькими причинами. Люди, страдающие ожирением главным образом абдоминального типа, имеют более высокие уровни PAI-1, фибриногена, VII, VIII факторов свертывания, фактора фон Виллебранда по сравнению с остальной популяцией. Наиболее изучена взаимосвязь МС с недостаточностью фибринолиза, обусловленной повышением уровня PAI-1. Многочисленные исследования свидетельствуют об увеличении плазменного уровня PAI-1, а также его активности при МС. Гиперинсулинемия, способствуя отложению жира, обуславливает усиление синтеза в жировой ткани PAI-1, тем самым снижая фибринолиз и способствуя клеточной агрегации. В контексте повышенного тромбогенного риска PAI-1 обладает по меньшей мере двойным эффектом. С одной стороны, нарушается активация плазминогена и тем самым риск тромбоэмболических осложнений также повышается. С другой стороны, PAI-1 ингибирует апоптоз, а как стало недавно известно, апоптозные клетки представляют фосфолипидные матрицы, необходимые для формирования протромбиназного комплекса и, следовательно, образования тромбина. В норме основными источниками синтеза PAI-1 являются клетки эндотелия, гепатоциты, а также гладкомышечные клетки и тромбоциты. Однако при ожирении основным источником продукции PAI-1 становится жировая ткань. Более того, многочисленные клинические исследования последних десяти лет показали, что снижение веса при ожирении приводило к уменьшению и нормализации уровня и активности PAI-1 в плазме. Чем больше размер адипоцитов и общая масса жировой ткани в организме, тем больший вклад вносит PAI-1 жирового происхождения в общий плазменный уровень PAI-1(3, 9).
Установлено, что при МС имеет место оксидативный стресс, активизация перекисного окисления липидов (ПОЛ). Изменения углеводного и липидного обменов при МС выступают основными факторами усиления процессов свободнорадикального окисления, что обуславливает большую потребность организма в биоантиоксидантах, в том числе и в витаминах-антиоксидантах. В защите организма от свободных радикалов большую роль играют витамины А, С, Е. Активно на энергетические процессы в организме влияет достаточное поступление витаминов группы В (В1, РР, В5, В6), которые являются важными участниками метаболических реакций в организме. По данным ряда авторов, витаминный статус у больных с МС характеризуется дефицитом в организме витаминов А, Е и С, который усиливается при прогрессировании клинико-метаболической декомпенсации и тяжести течения ИНСД. В исследованиях было показано, что использование в комплексной терапии МС витаминных комплексов, антиоксидантов приводит к снижению содержания продуктов ПОЛ в плазме и эритроцитах, способствует более быстрой и полной компенсации нарушений углеводного, липидного обменов, а также уменьшению степени выраженности клинической симптоматики (10, 12, 16).
Также в условиях МС повышен провоспалительный статус. Происходит гиперпродукция специфических и неспецифических медиаторов воспаления: комплемента, лейкотриенов, простагландинов, простациклина, цитокинов (фактор некроза опухоли a – ФНО-a, интерлейкин-1, интерлейкин-6, интерлейкин-8), гистамина, клеточных адгезивных молекул (ICAM-1,VCAM-1), фактора активации тромбоцитов, токсических метаболитов кислорода и других свободных радикалов, кининкалликреиновой системы, что дополнительно приводит к активации системы гемостаза. В данном случае можно говорить о том, что в условиях МС имеет место проявление синдрома системного воспалительного ответа (ССВО) (2, 16).
Установлено, что при МС и СД, как правило, отмечается выраженный дефицит магния (20).
Дефицит магния часто сопровождается дефицитом или предельно низким уровнем витамина В6. Одним из клинических проявлений дефицита магния является склонность к тромбообразованию и нарушениям сердечного ритма, вплоть до фатальных, повышение общего и периферического сосудистого сопротивления, увеличение уровня холестерина в крови и ускорение развития атеросклероза (5).
Магний, как и другие элементы, в организме не синтезируется, а поступает с пищей. Магний служит обязательным кофактором для более 300 ферментов, регулирующих различные функции организма. Магний играет ведущую роль в энергетическом, пластическом и электролитном обмене, участвует в обмене белков, жиров, углеводов, нуклеиновых кислот, выступает в качестве регулятора клеточного роста, необходим на всех этапах синтеза белковых молекул. В частности, от наличия достаточного количества магния в организме зависит нормальное функционирование рибосом и связывание с ними информационной РНК – ключевого механизма биосинтеза белка. Кроме того, магний принимает участие в обмене фосфора, синтезе АТФ, регуляции гликолиза, построении костной ткани и т.д.
Особо важна роль магния в процессах мембранного транспорта, где он является естественным антагонистом кальция. Магний способствует торможению сократительной активности гладкой и поперечной мускулатуры за счет расслабления отдельных клеток (миоцитов) путем блокады кальций-зависимого взаимодействия сократительных белков. Помимо этого, магний служит естественным антистрессовым фактором, тормозит развитие процессов возбуждения в ЦНС и снижает чувствительность организма к внешним воздействиям.
Потребность женщин репродуктивного возраста в магнии – 280 мг/сут. В кишечнике абсорбируется 30% поступившего магния. Усиливает всасывание магния витамин В6 (5, 20).
Провоспалительный статус, оксидативный стресс, витаминно-минеральный дисбаланс являются дополнительными факторами активации системы гемостаза, предрасполагая к тромбозу. Таким образом, данные большинства исследований свидетельствуют о наличии повышенной наклонности к тромбозам, т.е. тромбофилии у лиц с метаболическим синдромом.
Проблема избыточной массы тела и МС весьма актуальна в плане прогноза течения беременности, родов и послеродового периода. Ожирение – это сложное нейроэндокринное и метаболическое заболевание, которое влечет за собой большое число расстройств в репродуктивной системе, осложнений беременности, которые включают бесплодие, повышение АД во время беременности, АГ, преэклампсию, гестационный сахарный диабет, переношенную беременность, а также повышение частоты фетальной макросомии, врожденных уродств плода, родовой травмы новорожденных, материнского травматизма в родах. Врожденные уродства, связанные с ожирением, включают в себя дефекты нервной трубки, дефекты брюшной стенки, пороки развития крупных сосудов. Осложнения в родах и послеродовом периоде включают нарушения родовой деятельности, дистоцию плечиков плода, кровотечения в родах и послеродовом периоде, преждевременное или запоздалое излитие околоплодных вод, высокую частоту оперативных вмешательств, индукцию родов. Часть исследователей полагают, что индукция родов у тучных женщин может запускать каскад всех тех осложнений, которые могут иметь место в родах и послеродовом периоде как со стороны матери, так и со стороны плода (9, 12, 14, 17, 18, 19, 22).
При висцерально-абдоминальном ожирении, характерном для МС, имеет место дефицит прогестерона, который может приводить к нарушению процессов инвазии трофобласта, имплантации, а следовательно, и синдрому потери плода (СПП). Важнейшим гормоном беременности является прогестерон. Главный орган-мишень для этого гормона – матка, где эффекты прогестерона направлены на поддержание децидуальной оболочки. Прогестерон выступает в качестве мощного релаксанта гладкомышечных элементов миометрия, кровеносных сосудов и других органов, обеспечивая их адаптацию к беременности.
В процессе подготовки к имплантации под влиянием прогестерона в эндометрии происходит повышение содержания PAI-1, тканевого фактора и снижение уровня активатора плазмина тканевого и урокиназного типов, металлопротеаз матрикса и вазоконстриктора – эндотелина 1. Эта физиологическая регуляция гемостаза, фибринолиза, экстрацеллюлярного матрикса и сосудистого тонуса направлена на предотвращение образования геморрагий при дальнейшей инвазии трофобласта. Со своей стороны, бластоциста синтезирует активаторы плазминогена тканевого и урокиназного типов и протеазы, которые необходимы для разрушения экстрацеллюлярного матрикса в процессе имплантации. Их синтез, в свою очередь, регулируется хорионическим гонадотропином. Помимо этого, при нормальном содержании прогестерона происходит взаимодействие с киллер-ингибирующими рецепторами через прогестерон-индуцирующий блокирующий фактор (PIBF), что приводит к активации иммунного ответа матери через систему Т-хелперов II типа (Th II). Т-хелперы II типа продуцируют регуляторные цитокины: интерлейкины (ИЛ-3, ИЛ-4, ИЛ-10). Регуляторное действие ИЛ-3 в период имплантации определяет пролиферативную активность цитотрофобласта и фибринолитические процессы в эндометрии (за счет активации урокиназы, превращающей плазминоген в плазмин). Таким образом, прогестерон посредством Th II и ИЛ-3 влияет также на локальные механизмы гемостаза в эндометрии. PIBF стимулирует защиту эндометрия от отторжения эмбриона. При низком содержании прогестерона вырабатывается мало PIBF и происходит активация натуральных киллеров. Клетки трофобласта не резистентны к лизису активированными NK-клетками. Иммунный ответ матери на трофобласт сдвигается в сторону более активного ответа через Т-хелперы 1 типа (Th I), которые продуцируют провоспалительные цитокины: ФНО-α, ИЛ-1, 2, 6, 12, 18. Т-хелперы 1 типа способны активировать прямую протромбиназу, что способствует тромбозу сосудов плаценты (4).
Таким образом, коррекция гормональных нарушений у женщин с МС является обязательной.
Как указывалось выше, у лиц с МС имеет место снижение уровня магния. Гипомагниемия при беременности обусловлена как уже упоминавшейся потребностью в этом элементе, необходимом для обеспечения полноценного роста и развития плода, так и повышенным выделением магния почками. Особенно актуальна данная проблема в III триместре беременности. Наиболее низкие значения концентрации магния в крови беременных женщин выявляются при поздних гестозах, в частности при эклампсии. Важным фактором, усугубляющим гипомагниемию и соответственно клиническое течение патологических состояний, патогенетически тесно связанных с дефицитом магния в организме, является наличие в анамнезе гипертонической болезни. Не менее значима роль дефицита магния в невынашивании беременности. В этих условиях происходит патологическая активация кальцийзависимых контрактильных реакций в миометрии и возрастает угроза прерывания беременности, особенно во II-III триместрах. Кроме того, гипомагниемия способствует развитию повышенной возбудимости ЦНС, что провоцирует центральные механизмы спастической реакции матки. При сопутствующей гипертонической болезни нарушается кровоснабжение плаценты и фетоплацентарного комплекса, повышается содержание в крови вазоконстрикторных факторов (ренин, ангиотензин II, простагландины Р, серотонин), что усугубляет риск невынашивания беременности. Следует помнить, что магний является физиологическим регулятором продукции альдостерона. Недостаточность магния ведет к увеличению секреции альдостерона, задержке жидкости в организме и развитию отеков.
В исследовании J. Takaya и соавт. (2005) показано, что дефицит магния во время беременности может приводить не только к метаболическим нарушениям у матери и плода, но и способствовать развитию внутриутробной задержки роста плода, а после рождения может привести к развитию МС у человека как в детском, так и в более старшем возрасте (15, 21).
Таким образом, коррекция витаминно-минерального дисбаланса у женщин с МС необходима, поскольку дефицит магния на фоне витаминного дисбаланса у данной категории женщин усугубляет эндотелиопатию, протромботический и провоспалительный статус, имеющих место при МС.
Возникают определенные трудности при ведении беременных женщин с ИР и высоким уровнем PAI-1, поскольку уровень PAI-1 играет важную роль в процессе имплантации плодного яйца, а кроме того, является независимым фактором тромбофилии.
Абсолютное большинство генетических и приобретенных форм тромбофилии клинически манифестируют именно в течение гестационного процесса, как оказалось, не только в форме тромбозов, но и в форме типичных акушерских осложнений. Целый ряд осложнений беременности – СПП, гестоз, преждевременная отслойка нормально расположенной плаценты (ПОНРП), синдром задержки развития плода – могут быть связаны с генетическими и комбинированными формами тромбофилии. Патогенез большинства осложнений связан с нарушением процессов имплантации, инвазии трофобласта в децидуальную оболочку, плацентации. Процесс имплантации, инвазии трофобласта и дальнейшее функционирование плаценты представляются многоступенчатым процессом эндотелиально-гемостазиологических взаимодействий, который нарушается при тромботической тенденции и в случае генетических дефектов свертывания.
С точки зрения влияния тромбофилии наиболее ярким примером являются полиморфизм PAI-1 и другие генетически обусловленные дефекты фибринолиза с повышением уровня PAI-1, антифосфолипидных антител (АФА) и гиперфибриногенемией. Тромбофилия, в том числе и генетически обусловленная, усиливает протромботические механизмы. И в условиях гипофибринолиза (как в результате полиморфизма PAI-1, так и других причин) происходит десинхронизация процессов фибринолиза и фибринообразования, что может вести к дефектам имплантации и снижению глубины децидуальной инвазии трофобласта. Дисбаланс маточно-плацентарного фибринолитического контроля при внутриутробной задержке развития плода (ВЗРП) и гестозе в результате повышенной продукции PAI-1 ответственен не только за повышение отложения фибрина в маточных сосудах и снижение маточно-плацентарного кровотока, но также играет важную роль в снижении степени инвазии трофобласта на ранних сроках беременности, что также создает предпосылки для дальнейшего развития гестоза и ВЗРП. Если при этом имеет место и циркуляция АФА, то это усугубляет ситуацию. Неполноценные инвазия трофобласта и ремоделирование спиральных артерий ведут к нарушению плацентарной перфузии. При этом недостаточная инвазия трофобласта в дальнейшем определяет «эндотелиальный» феномен гестоза, что подразумевает эндотелиальный генез развивающихся при этом нарушений (4, 9, 12).
В акушерской практике ожирение и генетически обусловленная тромбофилия входят в ряд основных факторов риска развития тромбоэмболических осложнений. Принимая во внимание тот факт, что МС часто сочетается с тромбофилическими осложнениями, а также роль тромбофилии в акушерской патологии, следует сказать, что женщины с МС входят в группу высокого риска по развитию разнообразной акушерской патологии. Это повышает риск ранних и поздних выкидышей, развитие тяжелых гестозов, ПОНРП, не говоря о риске тромботических осложнений, который присутствует в течение всего гестационного процесса. Таким образом, разработка основных принципов ведения беременности и безопасного родоразрешения у женщин с МС является актуальной проблемой современных исследований в этой области.
Проведенное нами исследование женщин с МС выявило следующую особенность тромбофилии – наличие мультигенной тромбофилии в 100% случаев, особенностью которой явилось превалирование в общей структуре генетических форм тромбофилии полиморфизма гена PAI-1 и высокий процент встречаемости у лиц с МС гомозиготной формы полиморфизма в гене PAI-1. Генетическое исследование демонстрирует у женщин с МС генетическую форму гипофибринолиза, которая, с нашей точки зрения, может играть важную роль в нарушении процессов имплантации, инвазии трофобласта и плацентации. Именно этим, а также отсутствием патогенетической терапии можно объяснить наличие СПП, фето-плацентарной недостаточности (ФПН), гестоза в предшествующие беременности у женщин с МС. В пользу этого говорит факт благополучного вынашивания беременности при применении патогенетической профилактики НМГ в прегравидарном периоде и в течение всей беременности (12).
Согласно нашим данным, назначение антикоагулянтной и/или антиагрегантной терапии у женщин с МС при наличии генетической формы тромбофилии и/или антифосфолипидного синдрома (АФС) уже в фертильном цикле улучшает прогноз во время беременности. Патогенетически обоснованная профилактика с использованием низкомолекулярного гепарина (НМГ), витаминов и антиоксидантов у пациенток с МС и мультигенной тромбофилией с ранних сроков беременности позволила улучшить течение гестационного процесса и перинатальные исходы у беременных с МС, имеющих в анамнезе СПП, гестоз в предшествующие беременности. Чем раньше начата противотромботическая терапия, тем лучше исходы беременности.
Основные принципы профилактики акушерских осложнений у женщин с МС и тромбофилией – снижение массы тела и начало терапии с фертильного цикла.
В фертильном цикле назначали витамин Е или другие антиоксиданты, полиненасыщенные жирные кислоты (омега-3), фолиевую кислоту в дозе не менее 1 мг, а при мутации метилентетрагидрофолатредуктазы С677Т – не менее 4 мг, при указанной мутации и гипергомоцистеинемии – витамины В6, В12, аспирин в дозе 50-75 мг/сут, Магне В6, НМГ – надропарин кальция, далтепарин натрия, эноксапарин натрия в профилактических дозах 1 р/сут п/к (при условии высокого уровня D-димера), препарат натурального прогестерона. В I триместре беременности продолжали терапию, начатую в фертильном цикле. Препарат натурального прогестерона отменяли с 12-20-й недели в зависимости от гормонального фона и клинической картины (при гиперандрогении – с 24-й недели). Во II и III триместрах беременности к ранее проводимой терапии добавляли препараты железа, кальция (по показаниям), корректировали дозу НМГ с учетом данных гемостазиограммы (уровень D-димера), УЗИ, допплерометрии. В послеродовом периоде назначали НМГ не менее 10 дней в профилактических дозах, поливитамины (12).
Проведенные нами исследования свидетельствуют, что на сегодняшний день НМГ являются препаратами выбора у беременных с тромбофилией и МС и позволяют предупредить развитие не только тромбоэмболических осложнений, но и основных акушерских, к каковым относится невынашивание беременности, гестозы, ПОНРП, внутриутробная задержка развития плода, антенатальная гибель плода, фето-плацентарная недостаточность.
Механизм влияния НМГ на систему гемостаза аналогичен таковому нефракционированного гепарина. Гепарин в 1000 раз увеличивает активность антитромбина III, что приводит к эффективному ингибированию тромбина, фактора X и IX. В достаточно высоких концентрациях гепарин способен оказывать дополнительное ингибирующее влияние на тромбин через гепарин-кофактор II. Эффективность применения гепарина у пациентов с АФС обусловлена не только его воздействием на систему гемостаза, но и способностью адсорбировать антифосфолипидные антитела, предотвращать их связывание с клетками-мишенями и ингибировать активность комплемента.
Противотромботическую активность НМГ длительно связывали исключительно с преобладанием анти-Xa-активностью над антитромбиновой активностью. Позднее выяснилось, что только 30% противотромботической активности НМГ осуществляется через антитромбин III (АТ III) и на 70% – через эффекты, связанные с эндотелием, в частности с высвобождением естественного ингибитора внешнего пути свертывания TFPI. Активация тканевого фактора является ключевым этапом развития коагуляции и воспаления и важной частью патогенеза гнойносептических заболеваний при катастрофическом АФС, ДВС-синдроме, гестозах, что объясняет эффективность применения НМГ при этих состояниях. В последнее время пристальное внимание уделяется изучению влияния НМГ на процессы воспаления и возможность его использования для лечения различных заболеваний, включая воспалительные заболевания кишечника, бронхиальную астму, аутоиммунные и сердечно-сосудистые заболевания. Так, НМГ обладают способностью ингибировать лейкоцитарно-эндотелиальные взаимодействия, являющиеся ключевым звеном процессов воспаления. НМГ обладает также антицитокиновым свойством, вследствие подавления продукции важнейшего провоспалительного цитокина ФНО-a.
НМГ обладают рядом преимуществ перед нефракционированным гепарином:
- хорошая биодоступность и быстрое всасывание при подкожном введении;
- более предсказуемое антикоагулянтное действие;
- отсутствие необходимости в регулярном лабораторном контроле в период лечения;
- длительность действия и возможность подкожного введения 1-2 р/сут;
- минимальный риск развития гепарин-индуцированной тромбоцитопении, т.к. НМГ практически не взаимодействует с тромбоцитами и фактором 4 тромбоцитов.
Каждый из низкомолекулярных гепаринов имеет свои биологические, фармакокинетические и терапевтические особенности – эти препараты не взаимозаменяемы.
Поскольку, кроме этого, нет необходимости в постоянном лабораторном мониторинге, НМГ могут применяться амбулаторно, чаще всего инъекциям обучаются сами пациенты, когда необходима длительная терапия. Так, благодаря удобству применения препаратов НМГ (во-первых, инъекция делается подкожно; во-вторых, 1 раз в сутки; в-третьих, препарат расфасован в готовые шприцы) беременные с тромбофилией самостоятельно проводят инъекции НМГ в течение всей беременности.
Что касается дозы НМГ, в зависимости от выраженности тромбофилии она не всегда одинакова и зависит от уровня маркеров тромбофилии (D-димер).
Оценка эффективности длительного применения НМГ должна проводиться с учетом как клинических, так и лабораторных критериев. Об эффективной профилактике свидетельствовали как пролонгирование беременности до сроков доношенной беременности, так и отсутствие задержки внутриутробного развития плода по данным УЗИ, отсутствие внутриутробного страдания плода по данным допплерометрии и кардиотокографии. В процессе ведения беременности мы считаем необходимым исследование молекулярных маркеров тромбофилии, таких, как D-димер, так как они позволяют установить наличие тромбофилии; обосновать противотромботическую профилактику; осуществлять контроль эффективности противотромботической профилактики и коррекцию дозы препарата.
К важнейшим лабораторным критериям эффективности проводимой профилактики относятся снижение вплоть до полной нормализации молекулярных маркеров тромбофилии (D-димер) и нормализация агрегационной активности тромбоцитов.
Противотромботическая терапия показана также при подготовке к любому виду оперативного вмешательства и в послеоперационном периоде для профилактики тромботических и тромбоэмболических осложнений у женщин с МС (4, 9, 10, 12).
Дефицит прогестерона важно корректировать с использованием препарата натурального прогестерона, учитывая уже имеющиеся нарушения. Утрожестан – единственный на сегодняшний день препарат натурального прогестерона (после инъекционной формы – масляного раствора прогестерона), который получают из растительного сырья диоженина (экстрагируется из мексиканского растения дикий ямс). Микронизированная форма обеспечивает максимальную биодоступность препарата как при приеме внутрь, так и при интравагинальном применении.
Метаболизм и клиническое действие препарата натурального прогестерона аналогичны таковым эндогенного прогестерона. Он дает прогестагенный, антиэстрогенный, антиальдостероновый, антиандрогенный, токолитический, успокаивающий и положительный нейротропный эффекты.
Антиэстрогенное действие препарата обусловлено тем, что он осуществляет качественную физиологическую защиту матки, молочных желез, а его естественный метаболит 5альфа-прегнандион препятствует митотической активности, действуя на уровне рецепторов в «органе-мишени» – матке.
Натуральный прогестерон обеспечивает физиологическую регуляцию андрогенов, снижая при гиперандрогении активность мужских половых гормонов в организме женщины. Избыток андрогенов у беременной может неблагоприятно сказаться на течении беременности, обмене веществ. Во время беременности образование андрогенных стероидов в коре надпочечников (наряду с кортикостероидами) активизируется, и они свободно проникают к плоду через плаценту. Кроме того, повышенный уровень эндогенных андрогенов в материнском организме практически неизбежен, если у женщины имеется врожденная гиперплазия коры надпочечников, СПКЯ, МС.
Антиальдостероновое действие препарата натурального прогестерона обеспечивает регуляцию водно-электролитного баланса и способствует выведению из организма жидкости и натрия.
Токолитический эффект препарата состоит в ингибировании возбуждающего эффекта эндогенного окситоцина на миометрий путем блокады окситоциновых рецепторов.
Натуральный прогестерон оказывает защитное действие на сердечно-сосудистую систему с помощью следующих механизмов:
- конкурентное взаимодействие с рецепторами альдостерона в сосудах почек, миокарда;
- защитное влияние в синергизме с эстрогенами на эндотелий сосудов (апоптоз, клеточная адгезия);
- положительное действие на гладкую мускулатуру и соединительную ткань артериальной стенки (эластичность сосудов);
- уменьшение активности макрофагов, снижение образования «пенистых клеток».
Положительным моментом применения Утрожестана у беременных является снижение чувства тревоги за счет анксиолитического эффекта нейростероидов – естественных метаболитов прогестерона, которые образуются в головном мозге. У беременных с МС и АФС использование прогестерона имеет особое значение, поскольку при АФС отмечается влияние на хорионический гонадотропин человека и происходит вторичное снижение концентрации прогестерона. В такой ситуации введение хорионического гонадотропина человека извне неэффективно и единственно возможный путь – замещение дефицита прогестерона.
Как правило, у пациенток с МС и СПКЯ выявляются относительная или абсолютная прогестероновая недостаточность и гиперандрогения.
При беременности наиболее широко Утрожестан применяют интравагинально (по 1 капсуле 2-3 р/сут) вследствие достаточно активного всасывания, первичного прохождения через эндометрий, высокой эффективности и удобства введения. Назначают препарат с 17-го по 26-й день цикла зачатия, при наступившей беременности, как уже указывалось, – до 12-20-й недели в зависимости от уровня гормонов и клинической картины (при гиперандрогении – до 24-й недели).
Пациенткам с гиперандрогенией рекомендуется обязательное применение Утрожестана с момента установления беременности или в циклах зачатия с целью купирования относительной гиперэстрогенемии, обусловленной периферической конверсией андрогенов в эстрогены. Утрожестан обладает бесспорным преимуществом у беременных с МС.
Утрожестан обладает эффектом физиологического контроля уровня андрогенов. Утрожестан, как и натуральный прогестерон, обладает способностью контролировать уровень андрогенов, что имеет принципиальное значение в половой дифференциации плода. Утрожестан не оказывает влияния на половую дифференцировку головного мозга плода, не обладает антигонадотропной активностью, не влияет на липидный профиль, артериальное давление, метаболизм углеводов; не оказывает отрицательного влияния на систему гемостаза. Благодаря умеренному антиальдестероновому эффекту не вызывает задержку жидкости в организме, не вызывает увеличение массы тела. Основные метаболиты Утрожестана неотличимы от метаболитов эндогенного прогестерона. Все эти свойства Утрожестана важны в случае применения его у женщин с ожирением и МС (10).
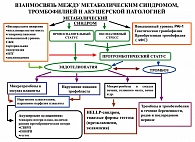
На рисунке 1 мы представляем нашу точку зрения на патогенез основных форм осложнений беременности у женщин с МС.
Наличие основных проявлений МС (ИР, ГИ, АГ, дислипидемия, ожирение), а также наличие оксидативного стресса и провоспалительного статуса, приводит к развитию и прогрессированию эндотелиопатии у лиц с МС. Усугубляет эндотелиопатию, протромботический статус – повышенный уровень фибриногена, повышенный уровень PAI-1, наличие генетической и/или приобретенной (АФС) форм тромбофилии. Помимо этого, протромботический статус является независимым фактором тромбоза у данной категории больных.
Поскольку имплантация, инвазия трофобласта и дальнейшее функционирование плаценты представляются многоступенчатыми процессами эндотелиально-гемостазиологических взаимодействий, то при тромботической тенденции, в случае генетических дефектов свертывания, дисфункции эндотелия, эти процессы объективно нарушаются.
В условиях гипофибринолиза (как в результате полиморфизма PAI-1, так и других причин) происходит десинхронизация локальных процессов фибринолиза и фибринообразования при имплантации. В такой ситуации протеаз, синтезируемых бластоцистой, становится относительно недостаточно, чтобы разрушить экстрацеллюлярный матрикс в эндометрии и внедриться на достаточную глубину.
Если при этом еще имеет место и циркуляция АФА, то это усугубляет ситуацию, поскольку АФА не только усиливают протромботические механизмы и потому десинхронизируют процессы фибринолиза и фибринообразования, но и могут изменять поверхностные предимплантационные характеристики плодного яйца: как заряд, так и конфигурацию. В ряде случаев у пациенток с диагнозом бесплодие могут иметь место ранние преэмбрионические потери, которые клинически маскируются нерегулярным менструальным циклом.
Таким образом, эндотелиопатия, микротромбозы и состояние гипофибринолиза у женщин с МС приводят к нарушению процессов имплантации, инвазии трофобласта и плацентации, в дальнейшем это может привести к развитию гестоза, ФПН, синдрома задержки развития плода, СПП, ПОНРП в течение беременности. Помимо этого, микротромбозы сосудов печени, головного мозга, почек могут приводить к развитию тяжелых форм гестоза (HELLP-синдром, преэклампсия, эклампсия). Также эти пациенты входят в группу высокого риска по развитию тромбозов и тромбоэмболий в течение беременности, родов и послеродового периода.
Принимая во внимание тот факт, что МС часто сочетается с генетическими формами тромбофилии, следует сказать, что женщины с МС входят в группу высокого риска по развитию не только разнообразной акушерской патологии, но и ССЗ, тромбозов и тромбоэмболий. Это диктует необходимость противотромботической профилактики, в том числе в пред- и послеоперационном периоде, в случае родоразрешения путем операции кесаревасечения (12).
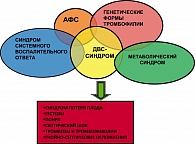
В заключение отметим, что МС является ярким примером одновременного сочетания так называемых «больших» синдромов: МС, ДВС-синдром, синдром системного воспалительного ответа, АФС/АФА, генетические формы тромбофилии, которые лежат в основе формирования разнообразной акушерской патологии (рисунок 2).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.