Тромболитическая терапия при остром коронарном синдроме с подъемом сегмента ST
- Аннотация
- Статья
- Ссылки
Первые успехи применения ТЛТ способствовали организации двух крупных многоцентровых исследований, ставших классическими. Одно из них – GISSI-1 (Gruppo Italiano per lo Studio della Streptochinasi ne nell’Infarto miocardico) – было выполнено в Италии и опубликовано в 1986 г.; второе – ISIS-2 (Second International Study of Infarct Survival) – было международным, и его результаты стали доступны в 1988 г. С начала 1990-х годов ТЛТ вошла в перечень обязательных мероприятий при ОИМ. Улучшение перфузии зоны некроза, уменьшение зоны периинфарктной ишемии за счет антеградного тока крови по артерии при удачной реперфузии, улучшение коллатерального кровообращения, уменьшение тромбообразования в левом желудочке – все это привело к снижению госпитальной летальности с 29% в 1960-е годы до 16% в 1980-е годы (1,9).
Механизм действия
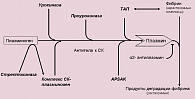
Препараты для ТЛТ, используемые в настоящее время, не разрушают непосредственно фибриновый сгусток, а воздействуют на него через физиологическую систему фибринолиза (рисунок 1). Эта система разрушает нити нерастворимого фибрина до растворимых фрагментов, что приводит к лизису тромба. Физиологический процесс фибринолиза инициируется тканевыми активаторами плазминогена, которые выделяются клетками эндотелия. Активаторы плазминогена превращают плазминоген в плазмин – белок, непосредственно разрушающий фибрин путем гидролиза. Помимо фибрина, плазмин способен разрушать и другие компоненты свертывающей системы крови, такие как фибриноген, V, VIII и XII факторы, а также протромбин. Поэтому повышение уровня плазмина не только лизирует тромб, но и замедляет тромбообразование.
Тромболитические препараты влияют на систему фибринолиза при посредстве различных механизмов. Так, стрептокиназа образует комплекс с плазминогеном, в результате чего открывается его активный участок. Этот участок способствует переходу других молекул плазминогена в плазмин, что ведет к появлению комплексов стрептокиназа-плазмин, которые устойчивы к нейтрализующему воздействию a2-антиплазмина и вызывают фибринолитический эффект.
При этом комплекс стрептокиназа-плазминоген приблизительно в одинаковой степени активирует как связанные с фибриновым тромбом, так и свободные, циркулирующие в крови молекулы плазминогена.
В отличие от стрептокиназы, рекомбинантные тканевые активаторы плазминогена являются фибринспецифичными средствами, т. е. непосредственно способствуют переходу связанного с фибрином плазминогена в плазмин за счет расщепления пептидной связи.
Тромболитические препараты
В настоящее время на отечественном рынке доступны четыре тромболитических препарата: стрептокиназа (стрептаза), проурокиназа (пуролаза), альтеплаза (актилизе) и тенектеплаза (метализе). Следует отметить, что в последнее время наиболее доступный с точки зрения цены тромболитик стрептокиназа практически исчез с рынка и стал труднодоступен.
Стрептокиназа
Стрептокиназа является прямым активатором плазминогена. Это одноцепочечный полипептид, не содержащий углеводов, с молекулярной массой 47000 Д, который вырабатывается из культуры бета-гемолитического стрептококка группы С.
Период полувыведения стрептокиназы – 15-25 минут. Стрептокиназу получают из культуры бактерий, вследствие чего она обладает антигенными свойствами. В крови человека всегда обнаруживаются антитела против стрептокиназы, что связано с большой распространенностью стрептококковых инфекций в общей популяции. Титры антистрептокиназных антител быстро нарастают в течение нескольких дней после ее введения и через несколько недель достигают пика. Этот пик может в 1000 раз превышать исходные титры антител против стрептокиназы. У части больных титры антистрептокиназных антител возвращаются к исходному уровню (до ее введения) через 6 месяцев, однако во многих случаях титры этих антител остаются повышенными у больных, получавших стрептокиназу 2-4 года назад, обусловливая резистентность к повторному введению препарата, а также аллергические реакции.
Как показывают исследования, эффективность стрептокиназы может значительно варьировать, что, по-видимому, связано с различиями в титрах антистрептокиназных антител у некоторых больных. Не удивительно поэтому, что данные литературы относительно оптимальной дозы стрептокиназы у больных острым инфарктом миокарда разноречивы. В настоящее время при лечении острого ИМ стрептокиназа обычно назначается в дозе 1 500 000 ЕД, которая разводится в 100 мл изотонического раствора хлорида натрия или 5% раствора глюкозы и вводится в течение 60 мин. При более быстром введении 1 500 000 ЕД препарата (за 30 мин.) эффективность тромболитической терапии, оцениваемая по частоте проходимости инфаркт-связанной коронарной артерии, увеличивается, но при этом значительно возрастает риск развития гипотонии.
По данным мета-анализа, применение стрептокиназы в первые 6 часов от момента развития ИМ спасает 30 жизней на 1000 пациентов, а при введении препарата в сроки от 7 до 12 часов – 20 жизней на 1000 пациентов (2).
Изучению эффективности стрептокиназы были посвящены 4 крупных рандомизированных исследования: GISSI-1, ISAM, ISIS-2 и EMERAS.
В исследовании GISSI-1 (3), включавшем более 11000 пациентов, было продемонстрировано, что стрептокиназа на 18% снижает госпитальную смертность при ИМ по сравнению со стандартной терапией (10,7% и 13,0% соответственно, р=0,002) и смертность в течение 1 года после ИМ (17,2% и 19,0%; р=0,008). При 10-летнем наблюдении было показано, что введение стрептокиназы спасает 19 жизней на 1000 пациентов.
В исследование ISIS-2 (4) было включено более 17000 пациентов. В группе пациентов, получавших стрептокиназу, было отмечено 25%-ное снижение смертности по сравнению с контрольной группой в течение 35 дней наблюдения. Другим важным результатом исследования было выявление положительного эффекта аспирина при его добавлении к ТЛТ стрептокиназой. В группе пациентов, получавших эти два препарата, смертность снизилась на 42% по сравнению с контрольной группой.
Проурокиназа
Проурокиназа, или одноцепочечный активатор плазминогена урокиназного типа, обладает высокой специфичностью в отношении связанного с фибрином плазминогена (по сравнению со стрепто- и урокиназой), а также более продолжительным периодом полувыведения. Проурокиназа преимущественно активирует фибрин-связанный плазминоген, имеющий иную конформацию по сравнению с циркулирующим плазминогеном. Кроме того показано, что в области тромба проурокиназа не ингибируется специфическими ингибиторами, присутствующими в плазме крови. Сама одноцепочечная молекула проурокиназы под воздействием плазмина превращается в двухцепочечную молекулу урокиназы, более активную, чем проурокиназа. Образуется цепная реакция взаимодействия Пуролазы с плазминогеном тромба, в результате которой тромб разрушается.
Проурокиназу можно выделить из мочи и культуры клеток почек эмбриона человека, однако для клинического применения препарат обычно получают ДНК-рекомбинантным методом.
Первое сообщение о применении проурокиназы у человека сделал Van de Werf в 1986 г. В последующие годы проведен ряд крупных клинических исследований с препаратом, полученным методами генной инженерии с использованием нативной молекулы проурокиназы, – саруплазой (PASS, SESAM, COMPASS), показавших сравнимую с r-tPA эффективность.
Альтеплаза
Тканевый активатор плазминогена (альтеплаза) представляет собой сериновую протеазу с молекулярной массой 72000 Д, которая синтезируется преимущественно эндотелиальными клетками сосудов. В кровяное русло ТАП секретируется в виде одноцепочечной молекулы (молекулярная масса 70000 Д), которая превращается в двухцепочечную под действием плазмина, трипсина, калликреина или фактора Ха свертывающей системы крови. Уникальным свойством ТАП является его очень высокая избирательность в отношении связанного с фибрином плазминогена, что обеспечивает его преимущественную активацию на поверхности фибринового тромба. Правда, эта избирательность в значительной мере утрачивается, когда ТАП используется в терапевтических дозах.
ТАП не обладает антигенными свойствами и не оказывает существенного влияния на гемодинамику; пирогенные и аллергические реакции в ответ на введение ТАП встречаются редко.
Для клинического применения ТАП получают ДНК-рекомбинантным методом. Альтеплаза выпускается под патентованными названиями: активазе (activase) и актилизе (actilyse).
Экспериментальные исследования свидетельствуют о более высокой тромболитической активности ТАП по сравнению со стрепто- и урокиназой. В остром периоде ИМ комбинантный ТАП быстрее и чаще вызывает лизис окклюзирующего тромба в инфаркт-связанной коронарной артерии. ТАП более эффективно снижает раннюю смертность у больных ИМ, чем стрептокиназа, однако чаще вызывает внутричерепные кровоизлияния.
В клинической практике используется главным образом одноцепочечный рекомбинантный ТАП, или альтеплаза, период полувыведения которого составляет 4-8 минут.
Для лечения острого ИМ альтеплазу обычно назначают в общей дозе 100-150 мг в течение 3 ч, причем первые 6-10 мг препарата вводят в виде болюса в течение 2 минут. В связи с тем, что альтеплаза в общей дозе 150 мг часто вызывала геморрагические осложнения, а трехчасовая инфузия слишком поздно приводила к реканализации инфаркт-связанной коронарной артерии, в последние годы были предложены две новые схемы введения рекомбинантного ТАП.
К. Neuhaus и соавт. (1989 г.) предложили схему «ускоренного» введения рекомбинантного ТАП: 100 мг в течение 90 минут, причем первые 15 мг препарата вводят в виде болюса, затем начинают инфузию (50 мг за 30 мин. и 35 мг за остальные 60 мин.).
Схема ускоренного введения альтеплазы была успешно апробирована в одном из самых крупных из исследований по изучению эффективной тромболитической терапии при остром ИМ GUSTO-I (Global Utilization of Streptokinase and Tissue Plasminogen Activator for Occluded Coronary Arteries, 1993 г.). В исследовании GUSTO-I было показано, что при ускоренном введении рекомбинантного ТАП 30-дневная смертность на 15% ниже, чем при лечении стрептокиназой. На 90-й минуте после начала тромболитической терапии инфаркт-связанная коронарная артерия была проходимой у 81% больных, леченых ТАП, но лишь у 57% больных, получавших стрептокиназу, причем полная проходимость наблюдалась в 54% и 31% случаев соответственно. Учитывая, что при обычной схеме введения альтеплазы частота 90-минутной проводимости инфаркт-связанной коронарной артерии составляет в среднем 70%, результаты исследования GUSTO-I можно рассматривать как доказательство большей эффективности ускоренной схемы введения препарата.
Другая схема введения альтеплазы в остром периоде ИМ предложена J. Puruis и соавт. (1994 г.): препарат вводится в виде двух болюсов по 50 мг с интервалом между болюсами в 30 минут. При двухболюсной схеме назначения рекомбинантного ТАП 90-минутная проходимость инфаркт-связанной коронарной артерии отмечалась у 78 из 84 (93%) больных, причем полная проходимость – в 88% случаев.
Таким образом, новые схемы применения рекомбинантного ТАП при остром ИМ оказались значительно более эффективными, чем рекомендовавшаяся ранее схема трехчасового введения препарата.
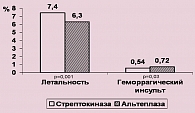
При сравнительной оценке эффективности стрептокиназы и альтеплазы в исследовании GUSTO-I (5), в котором участвовало более 41000 пациентов, было показано, что на фоне применения альтеплазы 30-дневная летальность была ниже на 14% (рисунок 2) при несколько большей частоте геморрагических инсультов.
Тенектеплаза
Препарат тенектеплаза, полученный с применением рекомбинантной ДНК-технологии, является самой удачной попыткой ученых улучшить естественный человеческий ТАП за счет перемен в структуре различных участков молекулы комплиментарной ДНК. В результате структурных модификаций получена молекула с более продолжительным плазменным периодом полувыведения, повышенной специфичностью к фибрину и большей устойчивостью к ингибитору первого типа активатора плазминогена (PAI-1) по сравнению с естественным ТАП. Сравнительный анализ тенектеплазы и альтеплазы показал, что тенектеплаза не потенцирует или потенцирует в незначительной степени коллагенсенсибилизированную агрегацию тромбоцитов, вызывая снижение риска повторной окклюзии после успешного тромболизиса по сравнению с альтеплазой.
Результаты многоцентровых рандомизированных исследований ASSENT-I и ASSENT-II, опубликованные в 1999 году, показали, что оба эти тромболитичекие средства при применении у больных с инфарктом миокарда (ИМ) эквивалентно высоко эффективны. Несомненным преимуществом тенектеплазы при использовании ее у этой категории пациентов является улучшенный профиль безопасности препарата и возможность его однократного болюсного введения (9).
В исследовании ASSENT-II, в котором приняли участие 16949 пациентов с ОИМ, использовали альтеплазу в дозе 100 мг, вводимую в течение 90 минут, и тенектеплазу в дозе от 30 до 50 мг в соответствии с массой тела пациента, назначаемую в виде единичного внутривенного болюса в течение 5-10 секунд. Получены следующие результаты: показатели общей 30-дневной смертности у пациентов, получавших лечение обоими тромболитиками, практически не отличались (6,15% – при назначении альтеплазы и 6,18% – при назначении тенектеплазы), но в отношении критериев безопасности, уменьшения развития неблагоприятных побочных эффектов, риска возникновения внутричерепных кровоизлияний, нецеребральных кровотечений, лучший эффект достигнут в группе тенектеплазы, что имеет важное значение в плане улучшения эффективности и безопасности проводимой терапии.
Практическое применение тромболитической терапии
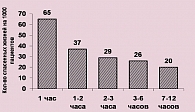
Эффективность ТЛТ сильно зависит от времени ее начала. Расширение зоны некроза при ИМ нарастает лавинообразно, поэтому так справедливо высказывание: «Время – это миокард». По данным Boersma E et al. (6), наибольшее количество жизней удается спасти при начале ТЛТ в пределах часа от возникновения симптомов ИМ (рисунок 3).
Одной из возможностей раннего начала ТЛТ является ее применение на догоспитальном этапе. Особенно это актуально в нашей стране в связи с малой распространенностью лечебных учреждений, способных выполнять экстренную ангиопластику коронарных артерий, а также в связи со значительными размерами нашей страны в сочетании со слабо развитой дорожной сетью.
Более того, несмотря на очевидные преимущества ангиопластики в сроки более 3 часов от момента возникновения симптомов ИМ, в более раннем периоде эффективность ТЛТ сопоставима с эффективностью чрескожных вмешательств на коронарных артериях, а по данным некоторых исследований, превосходит ее.
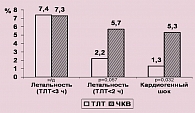
Так, по данным исследования PRAGUE-II (7) 30-дневная смертность при использовании ТЛТ в первые 3 часа от момента начала ИМ была сопоставима со смертностью пациентов, которым было выполнено чрескожное коронарное вмешательство (рисунок 4).
В исследовании CAPTIM (8) при использовании ТЛТ в первые 2 часа после начала ИМ, частота развития кардиогенного шока и 30-дневная летальность была достоверно ниже в группе ТЛТ, чем в группе ЧКВ (рисунок 4).
Таким образом, имеется реальная перспектива снижения летальности при ИМ за счет раннего использования тромболитических средств. Особенно это актуально в отношении тенектеплазы, которая может вводиться болюсно за короткий промежуток времени.
Опыт применения тромболитической терапии в отделении реанимации и интенсивной терапии Клиники кардиологии ММА им. И.М. Сеченова показывает, что даже в Москве пациентам с ИМ ТЛТ проводится в достаточно поздние сроки. Так, среди 433 пациентов, госпитализированных с острым коронарным синдромом с подъемом сегмента ST в период с 2000 по 2006 год, которым была проведена ТЛТ, среднее время «боль-больница» составило 204,5±88,24 мин., а среднее время «боль-тромболизис» – 237,76±88,15 мин. При этом летальность в группе пациентов, получивших ТЛТ, составила 2,5%, а без ТЛТ – 9,7%. Следует отметить, что большинству пациентов ТЛТ не проводится именно вследствие поздней госпитализации (более 12 часов от момента начала болевого приступа).
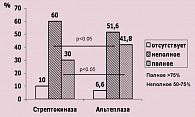
У 34,6% пациентов в качестве тромболитика была использована стрептокиназа, у 57,5% – альтеплаза и у 7,9% – проурокиназа. При этом госпитальная летальность и частота развития ранней постинфарктной стенокардии достоверно не различалась при использовании различных препаратов (12,4% – в группе стрептокиназы и 10,0% – в группе альтеплазы). Однако полное возвращение сегмента ST к изолинии достоверно чаще наблюдалось у больных, получивших альтеплазу (рисунок 5). Следует отметить, что возвращение сегмента ST к изолинии является важным предиктором смертности пациентов с ИМ. По данным многих исследований, пациенты, у которых отсутствовала динамика сегмента ST на фоне применения ТЛТ, имели достоверно более высокую 30-дневную летальность, чем те, у кого он возвращался к изолинии.
При оценке эффективности тромболизиса в различных подгруппах было выявлено, что риск смерти и развития ранней постинфарктной стенокардии был достоверно выше у женщин, чем у мужчин (ОР 2,8; р=0,012), у пациентов с фракцией выброса левого желудочка менее 40% (ОР 3,5; р=0,001) и у пациентов с повторным ИМ (ОР 4,0; р=0,0001).
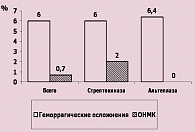
Осложнения ТЛТ возникали относительно редко (рисунок 6). Наиболее часто на фоне применения ТЛТ возникали геморрагические осложнения (около 6% случаев, независимо от типа тромболитика). При этом не было зарегистрировано кровотечений, потребовавших хирургического вмешательства или гемотрансфузии. Частота геморрагических инсультов была недостоверно ниже при применении альтеплазы, чем при применении стрептокиназы (0% и 2% соответственно).
Сегодня ТЛТ входит во все стандарты и рекомендации по лечению острого коронарного синдрома с подъемом сегмента ST. И хотя в последние годы все шире внедряются чрескожные коронарные вмешательства, до повсеместного их применения в нашей стране еще очень далеко, поэтому роль ТЛТ в спасении жизни пациентов с ИМ остается главенствующей. И здесь стоит особо подчеркнуть, что помимо широкого внедрения ТЛТ в клиническую практику больниц (а на сегодняшний день далеко не все российские стационары применяют ТЛТ при ИМ), важным является как можно более раннее назначение тромболитиков. Последнее достижимо только путем использования тромболитических препаратов на догоспитальном этапе, и здесь актуально не только обучение врачей показаниям и противопоказаниям к проведению ТЛТ, но и соответствующее оснащение бригад «Скорой медицинской помощи» необходимой аппаратурой – кардиографами, дефибрилляторами и системами мониторирования.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.