Цетуксимаб в лечении метастатического колоректального рака
- Аннотация
- Статья
- Ссылки



B. Vincenzi и соавт. [2], измерив уровень циркулирующих VEGF у 45 пациентов с колоректальным раком (КРР), получавших комбинированную терапию цетуксимабом и иринотеканом, показали, что медиана уровня VEGF достоверно снижается непосредственно после одного введения цетуксимаба. Такое снижение уровня VEGF сохранялось и через 3 мес. после терапии [2]. Доклинические исследования показали синергизм противоопухолевой активности цетуксимаба в сочетании с цитостатиками и радиотерапией [1].
Цетуксимаб в первой линии химиотерапии КРР
Изучение цетуксимаба в первой линии терапии КРР в комбинации с цитостатиками проводилось в ряде международных исследований. Рандомизированные исследования применения цетуксимаба и химиотерапии (ХТ) в первой линии терапии показали увеличение эффективности лечения при добавлении цетуксимаба к ХТ у больных с диким (немутированным) типом гена KRAS (табл. 1). В исследовании OPUS в общей популяции пациентов режим «FOLFOX4 + цетуксимаб» достоверно усиливал ответ опухоли на лечение против режима FOLFOX4 (46% и 36% соответственно). Наибольшее увеличение частоты общего ответа (61%) было достигнуто в популяции больных с диким типом гена KRAS (37% – в популяции с мутацией гена в опухоли) [3, 4].
В исследовании CRYSTAL установлено, что ответ на лечение в общей группе (1198 больных) составил 38,7% против 46,9% для подгрупп FOLFIRI и «FOLFIRI + цетуксимаб» соответственно. Ретроспективный анализ исследования показал эффективность цетуксимаба при опухолях с немутированным типом гена KRAS в кодонах 12 и 13, который был выявлен у 64% всех пациентов с исследованным KRAS-статусом [5]. Эти данные подтверждают полученные ранее результаты нерандомизированных [6–9] и рандомизированных исследований применения цетуксимаба [3, 10]. Эффективность цетуксимаба при лечении больных с немутированным типом гена KRAS была подтверждена статистически значимым снижением риска прогрессирования заболевания (медиана выживаемости без прогрессирования (ВБП) 9,9 мес. против 8,4 мес.; отношение рисков (ОР) 0,696; p = 0,0012), повышением общей выживаемости (ОВ) (медиана 23,5 мес. против 20,0 мес.; ОР 0,796; p = 0,0093) и увеличением вероятности достижения ответа на лечение (общий ответ 57,3% против 39,7%; отношение шансов (ОШ) 2,069; p < 0,001) по сравнению с группой, получавшей только FOLFIRI.
Частота оперативных вмешательств по поводу метастазов и частота полных резекций (R0) были выше у пациентов с диким типом гена KRAS, получавших цетуксимаб + FOLFIRI, по сравнению с больными, получавшими только FOLFIRI (7,9% против 4,6%; p = 0,0633 и 5,1% против 2,0%; p = 0,0265 соответственно). Статистически значимой оказалась связь между статусом KRAS и ВБП (p = 0,0028), ОВ (p = 0,0463) и лучшим объективным ответом (p = 0,0005). У больных с мутированным типом гена KRAS добавление цетуксимаба к схеме FOLFIRI не увеличивало ВБП, ОВ или частоту объективного ответа. Совместное использование бевацизумаба и цетуксимаба в исследовании CAIRO2 даже при отсутствии мутации в гене KRAS не улучшало результаты лечения. Не рекомендовано применение двух антител одновременно.
Цетуксимаб во второй и последующих линиях химиотерапии
Цетуксимаб в ряде исследований показал эффективность при резистентности опухоли к химиотерапии, которая была подтверждена результатами рандомизированного исследования NCIC CO.17. Лечение цетуксимабом резистентных к химиотерапии больных достоверно увеличивало продолжительность жизни и выживаемость без прогрессирования болезни (p < 0,0001) по сравнению с контрольной группой, получавшей симптоматическую терапию (BSC). В исследовании BOND (329 больных) было показано, что эффективность цетуксимаба выше в комбинации с иринотеканом (22,9% против 10,8%), чем в монотерапии после развития резистентности к иринотекану [11].
В многоцентровом неконтролируемом исследовании MABEL 1147 пациентов получали иринотекан и цетуксимаб после прогрессирования болезни на фоне иринотекана [12]. Пациенты получали различные схемы лечения иринотеканом, 68–72% всех пациентов прежде получали лечение оксалиплатинсодержащими режимами. Около половины больных (43–64%) получали три или более линии химиотерапии. Отсутствие прогрессирования болезни в течение 12 недель отмечалось у 61% больных, 1-летняя выживаемость составила 38%, медиана выживаемости – 9,2 мес. В рандомизированном исследовании EPIC 1298 больных после лечения оксалиплатинсодержащим режимом получали цетуксимаб + иринотекан или иринотекан 350 мг/м2 1 раз в 3 недели. Добавление цетуксимаба к иринотекану достоверно увеличило ВБП (4,0 мес. против 2,6 мес.) и объективный ответ (16,4% против 4,2% соответственно) [13]. Медианы выживаемости достоверно не различались, так как пациенты из контрольной группы в дальнейшем получали цетуксимаб.
Исследование EVEREST [14] показало увеличение эффективности при увеличении дозы цетуксимаба, доказало наличие корреляции между кожной токсичностью и эффективностью препарата. Тем не менее при увеличении дозы токсичность не усиливалась, но увеличивалась эффективность лечения. Увеличение эффективности лечения при увеличении дозы цетуксимаба без усиления токсичности дает возможность преодолеть резистентность к препарату у части пациентов.
Цетуксимаб в неоадъювантной терапии метастатического КРР
У 80% больных метастатическим КРР (мКРР) диагностируют нерезектабельные метастазы в печень. В настоящее время наилучшие результаты в лечении метастатического КРР достигнуты при использовании химиотерапии и хирургических методов. По данным двух клиник США (Клиника Майо и Онкологический центр им. М.Д. Андерсона, 1990–2006 гг.), медиана ОВ пациентов с мКРР в 1990–1997 гг. была 14,2 мес. и увеличилась до 18 мес., 18,6 мес. и 29,3 мес. в периоды 1998–2000, 2001–2003 и 2004–2006 гг. соответственно. Увеличение ОВ с 1998 по 2004 г. произошло за счет увеличения числа резекций печени, которые составили 20% от числа пациентов с метастазами. Увеличение ОВ в период с 2004 по 2006 г. связано с приходом в практику современных химиопрепаратов. Пятилетняя выживаемость зарегистрирована у 55,2% пациентов с резекцией метастазов в печень и у 19,5% пациентов без резекции. ОВ составила 65,3 мес. и 26,7 мес. соответственно [15].
R. Adam и соавт. (2007 г.) сообщили о результатах комбинированного лечения больных с метастазами в печень колоректального рака. После проведения химиотерапии резекция метастазов была выполнена у 12,5% больных, 5-летняя выживаемость отмечена у 33% прооперированных пациентов [16]. Применение современных режимов FOLFOX, FOLFIRI позволило прооперировать 9–40% ранее нерезектабельных метастазов печени [17–19]. В других работах сообщается о проведении R0 резекций при использовании различных схем в 5–60% случаев (табл. 2). В связи с развитием хирургических техник, появлением новых лекарственных препаратов и, как следствие, возможностью излечения больных с метастазами в печень стали исследоваться режимы с использованием 5-ФУ/ЛВ, иринотекана и оксалиплатина (триплеты), применяться хрономодулированные режимы. Однако токсичность триплетов достаточно высока. Добавление к дуплетам таргетных препаратов, в частности цетуксимаба, позволило значительно повысить эффективность лекарственной терапии у больных с немутированным типом гена KRAS, сохраняя удовлетворительное качество их жизни.
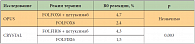
Специальный отбор пациентов осуществлялся во всех исследованиях, кроме первого, второго и четвертого. В двух рандомизированных исследованиях первой линии терапии OРUS и CRISTAL в группе с цетуксимабом процент радикальных резекций оказался выше по сравнению с контрольной группой [20]. Число радикальных резекций печени в обоих исследованиях оказалось в 2 раза выше в группах, получавших цетуксимаб (табл. 3). Среди пациентов с немутированным типом гена KRAS частота полных резекций (R0) была выше у пациентов, получавших цетуксимаб + FOLFIRI, по сравнению с больными, получавшими только FOLFIRI (5,1% против 2,0%; p = 0,0265 соответственно). В других исследованиях данные о влиянии цетуксимаба в сочетании с химиотерапией на увеличение частоты резекций метастазов подтвердились.
В исследование POCHER было включено 43 пациента с нерезектабельными метастазами в печень. У 9 пациентов размеры метастазов превышали 5 см, у 29 больных имели место множественные метастазы (> 4); у 1 пациента метастазы были расположены в воротах печени, у 4 – метастазы в печени и легких. Пациенты получали цетуксимаб 400 мг/м2 в 1-й день, далее 250 мг/м2 еженедельно. Первые 17 пациентов получали иринотекан 130 мг/м2 во 2-й день, оксалиплатин 20 мг/м2, 5-ФУ 600 мг/м2 и лейковорин 150 мг/м2 в 3–6-й дни 14-дневного цикла. В последующем доза иринотекана была снижена до 110 мг/м2, оксалиплатина – до 15 мг/м2, 5-ФУ – до 550 мг/м2. Первая оценка проводилась после 4 курсов. При частичной регрессии или стабилизации проводили еще 4 курса, далее планировали резекцию метастазов или лечение до прогрессирования [21].
Частичная регрессия (ЧР) была достигнута у 34 из 43 (79%) пациентов, стабилизация болезни – у 5 больных. 26 больных радикально прооперированы (R0 резекции), у 2 пациентов была R1 резекция, и у 6 больных после эксплоративной лапароскопии метастазы признаны нерезектабельными. Зафиксировано два полных патологических эффекта. У 30 из 37 больных определялся немутированный тип гена KRAS. Планировалось не менее 8 предоперационных курсов. Тем не менее медиана числа курсов до операции оказалась меньше – 6 (3–15), что было связано с быстрым уменьшением размеров опухоли. Медиана курсов после операции составила 5 (1–6). 20 больных завершили 14 курсов лечения, как планировалось в исследовании. Редукция доз не оказала влияния на эффект и резектабельность метастазов. Медиана ВБП для всех пациентов составила 14 мес., для прооперированных больных – 15 мес., у больных без операции – 9 мес. При медиане наблюдения 22 мес. у 7 из 43 пациентов признаков рецидива болезни не наблюдалось, у 17 – наблюдались проявления болезни. Предполагаемая ОВ для всех пациентов составила 37 мес., 2-летняя выживаемость составила 68,2% [21].
В рандомизированном исследовании II фазы CELIM оценивали резектабельность метастазов после неоадъювантной терапии с включением цетуксимаба [22]. В исследование были включены 144 больных, получавших лечение в 17 медицинских центрах Германии и Австрии. 141 больной с технически нерезектабельными метастазами или с пятью и более метастазами в печень были рандомизированы в две группы. Все пациенты получали цетуксимаб и один из режимов ХТ: FOLFOX6 (группа А) или FOLFIRI (группа В). Результаты лечения оценивали каждые 8 недель. Повторную оценку резектабельности метастазов проводили через 16 недель и далее каждые 2 мес. до конца лечения. Если метастазы становились операбельными, больным предлагали операцию через 4–6 недель после окончания химиотерапии. Объективный ответ был зафиксирован у 36 из 53 (68%) больных в группе А и у 30 из 53 (57%) в группе В (табл. 3).
Медиана курсов химиотерапии перед операцией была равна 8. Анализ томограмм с участием экспертов показал, что перед началом химиотерапии операбельными были признаны 22 пациента из 68 (32%), после химиотерапии резектабельным был признан 41 случай (60%). Таким образом, резектабельность метастазов после проведения химиотерапии увеличилась на 28%. Всего резекции R0 и R1 и радиочастотные абляции были проведены у 49 из 106 человек (46%). Анализ типа гена KRAS провели в 99 опухолях, немутированный тип гена KRAS был обнаружен в 70 (71%) опухолях, и в 68 опухолях немутированным был и тип гена BRAF (68%). Было показано, что ответ опухоли на лечение у больных с немутированным геном KRAS отмечался чаще (70%), чем с мутированным геном (41%). Еще выше был показатель ответа на лечение в группе больных с немутированными типами генов KRAS и BRAF – 72%.
В другом исследовании 27 пациентов с метастазами КРР в печень, резистентные к первой линии химиотерапии, были пролечены цетуксимабом в комбинации с химиотерапией. У 9 пациентов перед лечением цетуксимабом была проведена одна линия химиотерапии, у 10 больных – две линии и у 7 больных – три линии. 20 больным были назначены иринотекан и цетуксимаб, 4 пациентам – оксалиплатин и цетуксимаб, 1 больному – оба цитостатика и цетуксимаб. Радикальное хирургическое лечение после 4–12 курсов (медиана равна 6) было выполнено 25 больным. Через 16 мес. наблюдения были живы 23 пациента, из них 10 человек – без проявлений болезни. Медианы ОВ и ВБП составили 20 мес. и 13 мес. соответственно [23].
В исследовании G. Masi и соавт. ответ на лечение бевацизумабом и FOLFOXIRI составил 80%, резекция R0 – 40% [24]. Применение бевацизумаба в ряде исследований показало повышение риска перфорации органов желудочно-кишечного тракта (ЖКТ) [25]. Бевацизумаб улучшал выживаемость и ВБП в комбинации с FOLFOX во второй линии химиотерапии. На фоне терапии бевацизумабом отмечаются специфические побочные эффекты, такие как гипертензия, протеинурия, артериальные тромбозы, кровотечение, перфорация органов ЖКТ и проблемы с заживлением ран [26]. Пациенты старше 65 лет с артериальными тромбозами в анамнезе имеют повышенный риск артериального тромбоза при лечении бевацизумабом.
Безопасность применения цетуксимаба
Наиболее частыми побочными эффектами в рандомизированном исследовании OPUS при лечении цетуксимабом были поражения кожи, подкожной клетчатки (90%) и нарушения со стороны желудочно-кишечного тракта (78%) в группе «цетуксимаб + FOLFOX4». В группе пациентов, получавших только FOLFOX4, осложнения со стороны ЖКТ составили 73%, миелотоксичность – 71%. Наиболее частыми побочными явлениями были нейтропения 3–4-й степени (30% против 34%), сыпь (11% против 0,6%), диарея (8% против 7%) в группах с цетуксимабом и без него соответственно. Наиболее частыми причинами прекращения использования цетуксимаба стали реакции гиперчувствительности (4%) и сыпь (4%). Не было отмечено смертельных исходов, связанных с цетуксимабом [3].
Частота нежелательных явлений 3–4-й степени тяжести в исследовании CRYSTAL [5] составила 79,3% в группе «цетуксимаб/FOLFIRI» и 61% в группе FOLFIRI (p < 0,001). Частота таких явлений, за вычетом кожных реакций, в группе «цетуксимаб/FOLFIRI» составила 74%. В этой группе частота кожных реакций любого типа и частота угреподобной сыпи была значительно выше, чем в группе FOLFIRI (19,7% против 0,2%; p < 0,001 и 16,2% против 0,0%; p < 0,001 соответственно). Кожных реакций 4-й степени тяжести не наблюдалось. Медиана выживаемости без прогрессирования в группе «цетуксимаб/FOLFIRI» повышалась с увеличением тяжести сыпи. В этой группе также была выше частота диареи 3–4-й степени (15,7% против 10,5% в группе только FOLFIRI; p = 0,008) и реакций на инфузию (2,5% против 0%; p < 0,001), однако эти побочные эффекты поддавались коррекции. Частота связанных с лечением тяжелых нежелательных явлений составила 26% в группе «цетуксимаб/FOLFIRI» и 19,3% в группе FOLFIRI. Связанных с цетуксимабом смертельных исходов отмечено не было.
Предикторы эффективности цетуксимаба
В метаанализ, обобщивший данные о влиянии мутаций генов KRAS и BRAF на эффективность терапии цетуксимабом, были включены данные 22 клинических исследований (2188 пациентов). Восемнадцать исследований были ретроспективными, а 4 – проспективными. В трех исследованиях изучалась эффективность цетуксимаба в первой линии химиотерапии, в девятнадцати – во второй и последующих линиях [27]. Среди больных мКРР с мутированным типом гена KRAS частота объективного ответа (ЧОО) составила 14% (119/829), в то время как ЧОО у больных с диким (немутированным) типом гена KRAS была 39% (529/1359) [27].
О влиянии мутаций KRAS на ВБП сообщалось в 17 исследованиях, объединивших 1981 пациента. Медиана ВБП при мутированном и диком типах гена KRAS составила 3,0 мес. и 5,8 мес. соответственно. Мутации KRAS оказывали негативный эффект на ВБП (ОР = 1,94; 95% ДИ 1,62–2,33; p < 0,01). Данные по ОВ были доступны в 13 исследованиях с общей когортой 1618 пациентов. Медиана ОВ при мутированном и немутированном типах гена KRAS составила 6,9 мес. и 13,5 мес. соответственно. Согласно данным метаанализа, мутации KRAS оказывали негативный эффект на ОВ (ОР = 2,17; 95% ДИ 1,72–2,74; p < 0,01).
В обсуждении полученных результатов авторы поясняют, что анализ в различных по дизайну исследованиях (ретроспективное, проспективное) и подгруппах больных (первая, вторая и последующие линии терапии, монотерапия или комбинированный режим с цетуксимабом) принципиально не изменили результаты, что означает достоверность данных и выводов. Данные метаанализа подтверждают данные двух рандомизированных исследований, в которых проводился анализ биомаркеров и изучение их влияния на эффективность лечения цетуксимабом. В исследовании CRYSTAL мутации гена KRAS в кодонах 12 и 13 были выявлены у 397 из 1063 пациентов. У больных без мутаций в опухоли гена KRAS, получавших цетуксимаб + FOLFIRI, снижался риск прогрессирования (медиана ВБП составила 9,9 мес. против 8,4 мес.;
Прогностическое и клиническое значение мутаций гена BRAF
Ген BRAF, кодирующий нижележащий эффектор KRAS в пути активации митогензависимых протеинкиназ [23], также подвержен мутациям у ряда больных мКРР [28–30]. Клиническое значение мутаций гена BRAF изучалось в расширенной популяции больных с немутированным типом гена KRAS. В исследовании CRYSTAL мутации BRAF V600E были выявлены в 60 (6%) образцах опухолей, протестированных на наличие мутаций BRAF и KRAS. Только в одном случае мутации BRAF и KRAS присутствовали одновременно. У 625 больных с немутированным геном KRAS и мутацией гена BRAF оценивали эффективность применения цетуксимаба и схемы FOLFIRI. У пациентов без мутаций в обоих генах отмечалось статистически значимое снижение риска прогрессирования (ОР 0,637; p = 0,0013) и статистически значимое повышение вероятности достижения ответа (ОШ 2,175; p < 0,001) по сравнению с группой больных, получавших только FOLFIRI.
При лечении цетуксимабом больных с немутированным типом гена KRAS и мутированным BRAF повышение ВБП (медиана ВБП составила 8,0 мес. против
5,6 мес.; p = 0,87) и ОВ (медиана ОВ составила 14,1 мес. против 10,3 мес.; p = 0,74) не было достоверным. Признаков влияния мутации BRAF на эффективность лечения не наблюдалось. Исследование не позволило признать мутацию гена BRAF предиктором эффективности применения цетуксимаба и FOLFIRI. Тем не менее наличие мутации BRAF указывало на плохой прогноз в обеих группах лечения [23, 31]. В рандомизированных исследованиях FOCUS и CAIRO2 проведенный анализ биомаркеров также выделил мутации гена BRAF как неблагоприятный прогностический фактор для ОВ больных мКРР [23, 28].В исследовании OPUS небольшое количество опухолей, несущих мутацию гена BRAF (4%), не позволило сделать выводы о прогностическом значении мутации. В работе F. Di Nicolantonio были проанализированы образцы опухолей 113 больных. Мутации гена KRAS сопровождались резистентностью к панитумумабу и цетуксимабу. При наличии мутации гена BRAF все пациенты были резистентны к лечению моноклональными антителами (МКА), имели худший прогноз [32]. В ряде работ обсуждается прогностическое значение высокого уровня экспрессии лигандов, активирующих EGFR, амфирегулина и эпирегулина [33–35], а также мутационный статус гена PIK3CA [36, 37].
Кожная токсичность
Во многих исследованиях была установлена связь между выраженностью кожной реакции и эффективностью лечения (частотой объективного ответа, общей выживаемостью). У пациентов с выраженной кожной сыпью (3-й степени) показатели выживаемости и ответа опухоли на лечение выше по сравнению с пациентами с менее выраженной степенью сыпи или ее отсутствием. У пациентов с немутированным KRAS в группе «цетуксимаб + FOLFIRI», у которых развилась ранняя угреподобная сыпь (n = 207), медиана ОВ была более длительной (26,4 мес. против 19,1 мес.) по сравнению с больными, у которых ранней угреподобной сыпи не отмечалось (n = 101) [5].
Быстрое снижение уровня магния как предиктор ответа на лечение цетуксимабом
Статус гена KRAS является необходимым, но недостаточным предиктором эффективности лечения. Ряд авторов указывают статус гена BRAF, с наличием мутации в котором связывают не только плохой прогноз болезни, но и резистентность опухоли к моноклональным антителам. В связи с тем что ни один из известных биомаркеров не является полностью надежным, поиск маркеров резистентности продолжается. В настоящее время опубликованы работы, в которых уровень магния в плазме крови рассматривается как предиктивный маркер эффективности лечения цетуксимабом.
В исследовании B. Vincenzi и соавт. изучены скорость снижения уровня магния и влияние уровня магния на ЧОО, ВБП и ОВ. У 143 пациентов, получавших лечение в третьей линии химиотерапии иринотеканом и цетуксимабом, резистентных к оксалиплатину и иринотекану, измеряли уровень магния в плазме крови в 1, 7, 14, 21 и 28-й дни после инфузии препаратов. Медиана уровня магния в плазме крови после начала лечения статистически достоверно снижалась. Пациенты с быстрым снижением уровня магния до величины более 50% от начального уровня имели более высокую частоту ответа опухоли на лечение (55,8% против 16,7%; p < 0,0001), выше ВБП (6,3 мес. против 3,6 мес.; p < 0,0001) и OВ (11,0 мес. против 8,1 мес.; p = 0,002). Возможно, раннее снижение уровня магния служит предиктором эффективности уже проводимого лечения МКА [38].
В продолжающихся исследованиях по применению антител к EGFR запланировано дальнейшее изучение биомаркеров в образцах опухоли и определение их прогностической значимости. Возможно, знания о новых прогностических и предсказывающих молекулярных маркерах позволят выделить группу больных, получающих наибольшую пользу от лечения цетуксимабом.
