Ведение пациентов с хронической болью
- Аннотация
- Статья
- Ссылки





Актуальность проблемы терапии боли не вызывает сомнения, поскольку боль – это самый отчетливо осознаваемый симптом у взрослых пациентов. Ежегодно теме боли посвящено около 55% публикаций по медицине.
Заведующий онкологическим отделением паллиативной помощи ГКБ № 11 Департамента здравоохранения г. Москвы к.м.н. М.А. ВАЙСМАН привел данные, согласно которым более 70% больных страдают хронической болью на протяжении 3 лет, а около трети пациентов – более 10 лет. В мире насчитывается 25 млн онкологических больных, из них от 14% до 100% испытывают острую или хроническую боль. От 20% до 75% больных испытывают боль при установлении онкологического диагноза, от 17% до 57% – при проведении специального лечения, от 23% до 100% – при распространении и генерализации опухолевого процесса. По данным ВОЗ (1996 г.), 22% впервые обратившихся в поликлинику больных страдают от хронической боли. Среди основных симптомов, побудивших пациента обратиться к врачу до установления онкологического диагноза, боль составляет 31%.
Анализ качества жизни пациентов с онкологическими заболеваниями показал, что многие из них не удовлетворены терапией боли. Так, 50% считают, что врач не учитывает их качество жизни, 38% сообщили, что врач предпочитает лечить их рак, а не их боль. Еще 33% недовольны тем, что у врача не хватает времени побеседовать с ними о боли, а 26% уверены, что врач не знает, как купировать их боль. 27% сообщили, что врач не спрашивает их о наличии боли, 13% чувствуют недопонимание, что боль для них представляет
серьезную проблему.
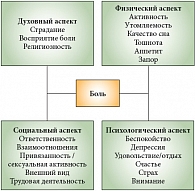
Таким образом, к лечению боли необходимо подходить комплексно, учитывая, что боль оказывает влияние на все аспекты качества жизни пациентов – физический, эмоциональный, социальный, психологический (рис. 1).
Основными лекарственными средствами для системной терапии боли являются неопиоидные и опиоидные анальгетики. В 21 стране Европы для лечения умеренной хронической онкологической боли назначают кодеин – в 8% случаев, трамадол – 8%, декстропропоксифен – 5%, дигидрокодеин – 2%; при интенсивной боли – морфин в 50% случаев, трансдермальную терапевтическую систему (ТТС) фентанила – 14%, оксикодон – 4%, метадон – 2% и др.1 В России, как правило, в терапии умеренной боли применяется трамадол, при сильной боли – морфин.
Необходимо подчеркнуть, что препарат должен быть не только эффективным и безопасным, но и удобным в применении. В этом отношении значительным преимуществом обладают препараты, которые можно вводить неинвазивно. Неинвазивные методы безболезненны, устраняют риск инфицирования, не требуют использования инструментария и участия медицинского персонала. Именно поэтому на сегодняшний день большое внимание уделяется трансдермальным терапевтическим системам третьего поколения как оптимальному способу введения обезболивающих препаратов. Для трансдермальной доставки идеально подходит высокоэффективный синтетический опиоидный анальгетик фентанил, поскольку он легко растворим в липидах и имеет низкий молекулярный вес.
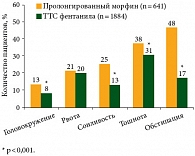
Так, согласно данным, полученным в ходе клинических исследований, продемонстрирована эффективность ТТС фентанила у пациентов (70–95%), ранее принимавших слабые или сильные опиоиды2, 3, 4. Объединенный анализ данных 8 исследований с совокупным участием 1220 пациентов показал достоверное (р < 0,001) преимущество терапии ТТС фентанила по сравнению с терапией пролонгированным препаратом морфина в отношении переносимости терапии (рис. 2)5.
Трансдермальный пластырь фентанила (например, ТТС Фендивия, компания “Takeda”) сочетает в себе удобство и простоту применения. Фендивия наносится на неповрежденную кожу туловища или верхних отделов рук, может использоваться пожилыми пациентами и ухаживающими лицами без медицинского образования. Что касается удобства применения, этот ультратонкий пластырь эластичен и комфортен для кожи, а уникальная прорезь S-формы облегчает удаление защитной пленки. Силиконовая формула адгезива не вызывает неприятных ощущений при кожном контакте и позволяет принимать душ.
На сегодняшний день проблема доступности обезболивающих препаратов актуальна не только для России, но и для многих стран мира. До сих пор существуют барьеры (политические, правовые и экономические), ограничивающие доступность опиоидных анальгетиков для лечения хронической боли. В нашей стране уже предпринят ряд мер, направленных на улучшение ситуации. Федеральный закон РФ от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в РФ» содержит статью о паллиативной медицинской помощи. Паллиативная помощь подразумевает комплекс медицинских вмешательств, направленных на избавление от боли и облегчение других тяжелых проявлений заболевания, в целях улучшения качества жизни неизлечимо больных граждан. Разрабатываются организационно-методологические подходы к развитию системы паллиативной медицинской помощи. Ведется большая научно-
практическая работа. Естественно, что оказание эффективной паллиативной помощи невозможно без повышения квалификации медицинских работников. Кроме того, существует необходимость обеспечения опиоидными анальгетиками всех нуждающихся пациентов не только в стационаре, но и в амбулаторных и домашних условиях. «В этом, – подчеркнул М.А. Вайсман, – может помочь внедрение в клиническую практику современных неинвазивных технологий лечения боли, таких как ТТС фентанила, доказавших свою эффективность и безопасность».
О возможностях оказания адекватной паллиативной помощи онкологическим больным продолжила говорить д.м.н. Г.Р. АБУЗАРОВА (руководитель Центра паллиативной помощи онкологическим больным Московского научно-исследовательского онкологического института им. П.А. Герцена).
В нашей стране 433 тысячи онкологических больных нуждаются в обезболивающей терапии. Если на начальной стадии опухолевого процесса болевой синдром развивается в 50% случаев, то на распространенной от боли страдают от 75% до 80% пациентов, а на терминальной – уже от 90% до 100%.
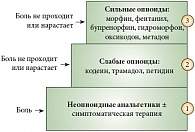
Основным руководством, в котором отражены принципы терапии боли у онкологических больных, являются рекомендации ВОЗ6. Согласно этому документу, обезболивающие препараты следует назначать «по восходящей» (так называемая трехступенчатая лестница ВОЗ): от неопиоидных анальгетиков до сильных опиоидов. Главными принципами терапии ВОЗ провозглашает также пероральное назначение обезболивающих, прием препаратов по часам (с целью опережения пиков боли), подбор лекарств с учетом индивидуальных особенностей пациента и сопутствующей симптоматической терапии (рис. 3).
Дополняют рекомендации ВОЗ клинические рекомендации Европейского общества медицинских онкологов по лечению болевого синдрома у онкологических больных (European Society for Medical Oncology, ESMO, 2010–2011). В них отдельно прописано лечение рефрактерной и нейропатической боли, которое включает инвазивные методы и нейрохирургические вмешательства. Кроме того, в них рассматривается терапия рефрактерной боли в конце жизни, когда препараты не могут обеспечить адекватное обезболивание и врач принимает решение о седации пациента, назначая нейролептики, бензодиазепины и пропофол.
Европейская ассоциация паллиативной помощи (European Association for Palliative Care, ЕАPC) предлагает свои рекомендации «Использование опиоидных анальгетиков для обезболивания при злокачественных новообразованиях: доказательные рекомендации ЕАPC», состоящие из 16 разделов, каждый из которых основан на данных кокрановских исследований. В рекомендациях указаны препараты для терапии и умеренной, и сильной боли. Подтверждена целесообразность ротации опиоидных анальгетиков с целью повышения эффективности и безопасности терапии, а также в случаях если невозможно повысить дозу опиоида из-за выраженности побочных эффектов. Была также изучена роль адъювантных препаратов (антидепрессантов и антиконвульсантов) в лечении нейропатической боли.
Г.Р. Абузарова отметила, что в России не все больные обеспечены опиоидными анальгетиками. Медицинское потребление наркотических средств в России составляет 107 на 1 млн человек в сутки (в 180 раз меньше, чем в Германии, в 151 раз меньше, чем в Австрии, и в 63 раза ниже, чем во Франции). Эта статистика была приведена в докладе Международного комитета по контролю над наркотиками (Организация объединенных наций, 2010). Тем не менее наметились позитивные тенденции. Российские врачи располагают некоторыми препаратами 2-й и 3-й ступени обезболивания (нестероидными противовоспалительными средствами, НПВС). Слабые опиоиды представлены трамадолом. К сожалению, этот слабый опиоидный анальгетик зачастую назначается для лечения сильной боли, в результате боль не купируется. Из сильных опиоидов используются морфин (таблетки) и ТТС фентанила. Для морфина характерны ярко выраженные побочные эффекты, особенно со стороны желудочно-кишечного тракта (ЖКТ). Его альтернатива – ТТС фентанила – позволяет осуществлять стабильный контроль боли в течение 72 часов. Наркогенный потенциал ТТС фентанила ниже, чем у истинных опиатов. Недостатком ТТС фентанила можно назвать длительный подбор дозы, который, однако, облегчается наличием различных дозировок препарата.
Фентаниловые пластыри впервые стали использоваться в 1990-х гг. Использование ТТС 1-го поколения было сопряжено с высоким риском передозировки фентанила из-за возможного повреждения резервуара с действующим веществом. У пластырей 2-го поколения риск передозировки был ниже, но имелся другой недостаток – большее количество действующего вещества оставалось в использованном пластыре. При разработке 3-го поколения все недоработки были учтены. Так, в ТТС Фендивия фентанил содержится в виде микрокапель, что обеспечивает лучшее поступление его в кожу, риск передозировки минимален.
Интенсивность боли – важный, но не единственный фактор, определяющий выбор лекарственного препарата и его эффективность. Необходима диагностика патогенетического типа боли и соответствующая специальная ее терапия. Дело в том, что 40% онкологических больных страдают нейропатической болью, следовательно, им можно помочь не только обезболивающими средствами, но и другими препаратами.
В центре паллиативной помощи было проведено постмаркетинговое, открытое, рандомизированное исследование с участием 662 пациентов, 343 мужчин и 319 женщин в возрасте от 18 до 88 лет (средний возраст составил 55,1 ± 13,5 лет), с длительностью хронического болевого синдрома (ХБС) 5,1 ± 5,0 месяцев. Пациенты были разделены на две группы: недифференцированной терапии боли (n = 345) и дифференцированной терапии боли (n = 317). В группе дифференцированной терапии боли пациенты с нейропатической болью получали терапию антидепрессантами последнего поколения.
Исследование продемонстрировало, что подход с применением дифференцированной патогенетической терапии болевых синдромов позволяет улучшить качество обезболивания, снизить дозы опиоидных анальгетиков, сократить время подбора эффективной дозы анальгетиков, уменьшить число сильно выраженных побочных эффектов, способствует повышению физической активности у пациентов, не получавших сильных опиоидов.
Таким образом, по мнению д.м.н. Г.Р. Абузаровой, выбор терапии хронического болевого синдрома у онкологических больных должен быть обусловлен не только интенсивностью боли, но и ее характером. При ноцицептивной боли следует использовать обычный алгоритм терапии, при нейропатической – возможно включение в терапию антидепрессантов (рис. 4). Это позволит максимально эффективно и быстро облегчить состояние онкологических больных.
Причины болевого синдрома онкологических больных могут быть различны, как отметил д.м.н., профессор В.В. БРЮЗГИН (зав. поликлиникой Российского онкологического научного центра им. Н.Н. Блохина). Боли могут быть обусловлены непосредственно опухолевым процессом – в 75% случаев – или проводимым противоопухолевым лечением – 15%. Кроме того, в 10% случаев боль не связана с опухолью, а значит, лечение такой боли должно быть иным, чем лечение больных с опухолевым процессом.
Независимо от того, чем вызвана боль, основным видом купирования хронического болевого синдрома у онкологических больных является медикаментозное лечение, которое позволяет достичь комфортного состояния больного и повысить качество его жизни.
Согласно лестнице обезболивания ВОЗ, лечение рекомендуется начинать с неопиоидных (НПВС) и адъювантных препаратов в зависимости от природы болевого синдрома. Если боль усиливается или эффективность препаратов первой ступени исчерпывается, назначаются препараты второй ступени – слабые опиоиды, на следующей ступени назначаются уже сильные опиоиды. Профессор В.В. Брюзгин подчеркнул, что и на второй, и на третьей ступенях возможно использование НПВС и адъювантов. Для эффективного купирования болевого синдрома препарат должен обладать следующими качествами:
- обратимо ингибировать циклооксигеназу (ЦОГ);
- оказывать быстрое анальгетическое действие;
- иметь невысокий риск возникновения нежелательных реакций и осложнений в месте введения;
- иметь различные формы выпуска и дозировки, обеспечивая удобство применения и гибкость дозирования.
Всем перечисленным требованиям отвечает препарат оксикамового класса НПВС лорноксикам (Ксефокам). Ксефокам – мощный, сбалансированный ингибитор ЦОГ-1 и ЦОГ-2 и имеет выраженное анальгетическое и противовоспалительное действие. Кроме того, Ксефокам – это единственный в России препарат класса оксикамов, имеющий короткий период полувыведения, что исключает его накопление в плазме, снижая риск дозозависимых побочных реакций.
Ксефокам имеет различные формы выпуска – для парентерального применения (лиофилизат для приготовления раствора для в/м и в/в инъекций) и перорального приема (стандартные таблетки, быстро абсорбируемые таблетки Ксефокам Рапид). Ксефокам Рапид действует так же быстро, как и внутримышечная инъекция. Все формы препарата Ксефокам быстро всасываются и имеют равную биодоступность: нет необходимости в корректировке дозы при переключении с инъекционной терапии на пероральную форму. Не требуется коррекция дозы у лиц пожилого возраста с сохранной функцией почек и печени.
Были проведены исследования эффективности Ксефокама в купировании послеоперационной боли, в которых было показано, что применение Ксефокама позволяет снизить дозу опиоидов. При этом Ксефокам в дозе 8 мг и выше так же эффективен для купирования боли, как морфин 20 мг в/м7. Кроме того, побочные эффекты на фоне терапии Ксефокамом были значительно менее выраженными и проявлялись в умеренной или слабо выраженной симптоматике.
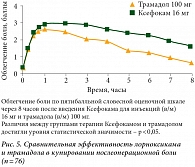
После хирургической операции на крестообразной связке внутримышечное введение Ксефокама 16 мг в течение 8 часов оказало обезболивающее воздействие такой же выраженности, как и внутримышечное введение трамадола (рис. 5)8.
Обезболивающая эффективность внутривенной инъекции Ксефокама (общая максимальная доза 32 мг) и морфина (максимально 40 мг) сопоставлялась на протяжении 24-часового периода после амбулаторной операции. Оценка обезболивания проводилась ежечасно. Был сделан вывод, что Ксефокам обладает аналогичным морфину обезболивающим потенциалом после дискэктомии, но имеет более слабые побочные эффекты (рис. 6)9.
Результаты рандомизированного двойного слепого исследования в параллельных группах показали, что Ксефокам 4 мг 3 раза в сутки более эффективен у онкологических больных с костными метастазами, чем 500 мг напроксена дважды в сутки. Однако надо учитывать, что суточная доза Ксефокама не должна превышать 16 мг, а дозу необходимо разделять на 3–4 приема10.
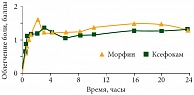
Отечественное исследование эффективности и безопасности лорноксикама у онкологических больных (n = 130) показало, что интенсивность болевого синдрома значительнее снижалась при использовании Ксефокама, чем других обезболивающих. У пациентов 1-й группы для купирования болевого синдрома применяли Ксефокам Рапид по 8 мг в суточной дозе, не превышающей рекомендуемую: 24 мг в первые сутки и 16 мг в последующие дни. Во 2-й группе применяли стандартные лекарственные препараты: у 27 пациентов (41,55%) – трамадол в дозе от 200 до 400 мг; у 21 (32,3%) – баралгин в дозе 5 мл 2–3 раза в сутки; у 17 (26,2%) – просидол в дозе 20 мг 1–2 раза в стуки. После первого назначения препаратов у онкологических больных достоверной разницы во времени наступления обезболивания не отмечено: так, в 1-й группе оно составило 19,7 ± 4,8 минуты, во 2-й – 21,6 ± 6,8 минуты (p > 0,05). Продолжительность обезболивания была больше у пациентов 1-й группы (6,3 ± 0,4 часа против 4,2 ± 0,6 часа, p < 0,05). В течение семи суток эта закономерность продолжала наблюдаться (рис. 7)11.
«Таким образом, – подытожил профессор В.В. Брюзгин, – приведенные данные свидетельствуют об эффективности и безопасности Ксефокама. Применение Ксефокама улучшает качество жизни больных, а также позволяет отсрочить назначение или сократить дозу наркотических анальгетиков. Все это позволяет считать Ксефокам эффективным препаратом для лечения боли».
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.