Вегетативная невропатия при сахарном диабете и метаболическом синдроме: клинические проявления, диагностика и лечение
- Аннотация
- Статья
- Ссылки
- English
Ранняя диагностика вегетативных нарушений у лиц с диабетом и метаболическим синдромом с помощью пульсоксиметрической оценки вариабельности сердечного ритма и своевременно назначенная нейротропная терапия позволяют предотвратить развитие тяжелых форм заболевания.
Ранняя диагностика вегетативных нарушений у лиц с диабетом и метаболическим синдромом с помощью пульсоксиметрической оценки вариабельности сердечного ритма и своевременно назначенная нейротропная терапия позволяют предотвратить развитие тяжелых форм заболевания.


Введение
Самой частой причиной развития вегетативной невропатии является сахарный диабет (СД). В 2014 г. распространенность последнего составила 8,4% населения развитых стран. При этом тенденция к увеличению заболеваемости сохраняется.
Поражения внутренних органов при СД давно описаны в отечественной [1] и зарубежной [2–4] литературе. В частности, указываются сердечно-сосудистые, желудочно-кишечные, мочеполовые и терморегуляторные расстройства, трофические нарушения, псевдопарезы и дисрегуляция зрачка. Однако только современные методы диагностики вегетативной нервной системы позволили оценить реальный масштаб бедствия.
Поражение вегетативных волокон, приводящее к развитию диабетической вегетативной невропатии (ДВН), наблюдается у 60% пациентов, страдающих СД более 15 лет [5].
Сегодня распространенность ДВН при СД варьируется от 20% (в общей популяции больных) до 60% (у пациентов с длительным течением СД) [5, 6].
К сожалению, в Российской Федерации на амбулаторном этапе оказания медицинской помощи больным СД диагноз ДВН не ставится [7]. Однако среди пациентов с впервые выявленным СД поражение вегетативных волокон обнаруживается в 11,7% случаев.
Поражение вегетативных волокон фиксируется даже у лиц с метаболическим синдромом. Так, при нарушении толерантности к глюкозе таковое наблюдается в 5,9% случаев, при изолированном повышении гликемии натощак – в 8,1%. В популяции пациентов с метаболическим синдромом признаки вегетативной невропатии отмечаются в 11,4% случаев, в то время как в популяции 55–74-летних с нормальной толерантностью к глюкозе – только в 4,5% (снижение вариабельности сердечного ритма) [8].
Механизмы развития вегетативной невропатии при метаболическом синдроме до конца не установлены. Снижение вариабельности сердечного ритма не коррелирует с показателями эндотелиальной дисфункции в плазме [9].
Факторами риска развития ДВН при СД 2 типа признаны возраст, длительное течение заболевания, плохой контроль гликемии, ожирение и курение [10, 11], при СД 1 типа – плохой контроль гликемии, артериальная гипертензия, ретинопатия и дистальная сенсомоторная полиневропатия [12].
Диабетическая вегетативная невропатия, как и многие другие полиневропатии, сопровождается клиническими или субклиническими признаками поражения вегетативной нервной системы.
Наиболее часто поражение вегетативной нервной системы происходит при невропатиях малых волокон (тонких, плохо миелинизированных А-дельта- и немиелинизированных С-волокон) [13].
Вегетативная нервная система регулирует функцию висцеральных органов, гладкой мускулатуры сосудистой стенки, эндокринных и экзокринных желез, иммунной системы и трофику мягких тканей. Сердечно-сосудистые и трофические нарушения признаны одними из главных причин инвалидизации и смерти больных вегетативной невропатией.
Наличие симптомов ДВН рассматривается как прогностически неблагоприятный фактор развития терморегуляторных и судомоторных нарушений, мочеполовых расстройств и других осложнений СД, например ретинопатии и инсулинорезистентности [14], диабетической стопы и связанных с ней осложнений [15]. Кроме того, таковые ассоциируются с многократным повышением риска сердечно-сосудистой смертности [4, 5, 16, 17]. Установлено, что восьмилетняя выживаемость при других равных сердечно-сосудистых рисках у пациентов с ДВН составляет 77%, у пациентов с СД, но без ДВН – 97% [18].
Необходимо отметить, что строгий контроль гликемии у больных ДВН приводит к повышению смертности, связанной с бессимптомными гипогликемическими состояниями [19]. Экспериментально подтвержденная связь между предрасположенностью к летальным аритмиям и наличием признаков повышенной симпатической или пониженной парасимпатической активности обусловила проведение исследований количественных показателей вегетативной активности для ранней диагностики вегетативной невропатии.
Клинические проявления
К основным клиническим сердечно-сосудистым проявлениям ДВН относятся постоянная умеренная тахикардия и фиксированная частота сердечных сокращений (ЧСС), ортостатическая гипотензия, безболевая ишемия и инфаркт миокарда, снижение циркадных влияний на ритм сердца, повышение риска развития аритмий, диабетическая кардиомиопатия и нарушение сократительной функции миокарда, осложнения при проведении анестезии и операции (неожиданная остановка дыхания и сердцебиения) [20].
Развитие тахикардии в начале заболевания обусловлено поражением блуждающего нерва (вагуса) при относительном преобладании активности симпатического отдела вегетативной нервной системы [3, 21]. Это связано с тем, что при ДВН первыми поражаются наиболее длинные нервы (то есть блуждающий). По мере прогрессирования заболевания снижается активность и симпатического отдела вегетативной нервной системы. На этой стадии отмечается отсутствие тахикардий в ответ на функциональные пробы и эмоциональный стресс – денервированное сердце. При ДВН безболевая ишемия или безболевой инфаркт миокарда регистрируются в 45–65% случаев, при СД без признаков ДВН – в 4%.
Отсутствие характерных клинических признаков нарастающей ишемии – фактор риска инфаркта миокарда и внезапной смерти.
В основе развития безболевой ишемии лежит ряд механизмов. Главные – дисфункция кардиальных афферентных нервных волокон и измененный порог болевой чувствительности. Известно, что кардиальная форма вегетативной невропатии служит прогностическим фактором безболевой ишемии миокарда [18].
Методы диагностики
Ввиду высокой медико-социальной значимости кардиоваскулярной ДВН выявление вегетативной дисфункции становится одной из приоритетных задач современной неврологии и диабетологии.
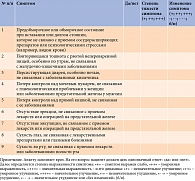
Для определения вегетативной дисфункции разработан ряд опросников [22, 23]. Один из таких представлен в табл. 1. Однако все они являются субъективными, полученные с их помощью данные носят ориентировочный характер и не могут использоваться для верификации диагноза ДВН. Это предопределяет целесообразность применения инструментальных методов исследования.
Характерными признаками кардиоваскулярной ДВН на электрокардиограмме (ЭКГ) считаются дисперсия интервала ST, удлинение интервала QT, инверсия положительного зубца Т, псевдокоронарный подъем сегмента ST [24, 25]. Однако указанные изменения отмечаются только на поздних стадиях заболевания, когда терапия уже малоэффективна.
Для проведения ранней диагностики вегетативной невропатии рекомендуются пять стандартных тестов [4].
Первый тест – изменение ЧСС при медленном глубоком дыхании (шесть ударов в минуту). Наблюдаемое в норме ускорение ЧСС на вдохе и урежение на выдохе нивелируется по мере прогрессирования недостаточности парасимпатической иннервации сердца. Разница между минимальной и максимальной ЧСС в десять ударов и менее свидетельствует о нарушении парасимпатической иннервации сердца (n > 15 мм рт. ст.).
Второй – тест Вальсальвы. В норме при повышении внутрилегочного давления (пациент натуживается – дыхание в мундштук, соединенный с манометром, для поддержания давления в спирометре на уровне 40 мм рт. ст. в течение 10–15 секунд) ЧСС увеличивается с последующей компенсаторной брадикардией. При нарушении парасимпатической регуляции сердечной деятельности этот феномен отсутствует. Отношение величины максимального RR-интервала в первые 20 секунд после пробы к минимальному во время пробы менее 1,2 свидетельствует о наличии заболевания.
Третий – тест Шелонга (ортостатическая проба). Пациент лежит на спине в течение десяти минут, после чего измеряется его артериальное давление (АД). Затем больной встает, АД измеряется на второй, четвертой, шестой и десятой минутах. Снижение АД на 30 мм рт. ст. и более считается патологическим и свидетельствует о наличии заболевания и нарушении симпатической иннервации (n < 10 мм рт. ст.).
Четвертый – тест 30:15 – увеличение ЧСС при вставании с максимальным значением к 15-му удару, далее она снижается и достигает минимального значения к 30-му удару. Отношение 15-го RR-интервала к 30-му при ортопробе менее 1,0 считается признаком вегетативной невропатии (n > 1,04 мм рт. ст.).
Пятый – проба с изометрической нагрузкой. Сжатие динамометра в течение трех минут до одной трети максимальной силы руки приводит к подъему диастолического АД. Его повышение менее чем на 10 мм рт. ст. свидетельствует о вегетативной невропатии с недостаточной симпатической иннервацией (n > 16 мм рт. ст.).
Указанные выше тесты признаны золотым стандартом диагностики ДВН. Ранее их применение было сопряжено с рядом трудностей, связанных с невозможностью мгновенного измерения ЧСС. ЭКГ с подсчетом RR-интервалов требует достаточного времени, наличия специальной аппаратуры и расходных материалов. Развитие современных технологий, в частности разработка таких гаджетов, как пульсоксиметр, позволило проводить тест глубокого дыхания, тест Вальсальвы и тест 30:15 при минимальных затратах времени во время амбулаторного приема.
В основе наиболее простого в практическом применении пульсоксиметрического теста глубокого дыхания лежит методика регистрации и оценки высокочастотных дыхательных колебаний сердечного ритма, предложенная T. Wheeler и P.J. Watkins [2]. Вследствие высокой чувствительности и селективности методика пульсоксиметрической оценки вариабельности сердечного ритма при глубоком дыхании позволяет диагностировать ДВН уже на доклинической стадии и определить степень вегетативного дефицита.
Суть тестирования заключается в следующем: обследуемый по команде начинает дышать глубоко с частотой шесть раз в минуту (пять секунд вдох и пять секунд выдох). В это время определяется вариабельность ритма сердца. Такая частота дыхания в наибольшей степени стимулирует блуждающий нерв, поэтому проба используется для оценки реактивности парасимпатического отдела вегетативной нервной системы [26]. При данном варианте проведения пробы определяется разница между максимальной и минимальной ЧСС во время дыхательного цикла, или экспираторно-инспираторное отношение.
У здоровых лиц интервал времени от начала одного сердечного сокращения до начала другого неодинаков. Первым это обнаружил A. Haller в 1760 г. [27]. Периодические составляющие вариабельности ритма сердца, выделенные на основании кратковременных записей в состоянии покоя, представлены высокочастотными, низкочастотными и очень низкочастотными колебаниями, как правило имеющими периодичность в 0,2–0,4, 0,04–0,15 и 0,003–0,040 Гц соответственно (табл. 2). Низкочастотные колебания связаны с активностью постганглионарных симпатических волокон и отражают модуляцию сердечного ритма симпатической вегетативной нервной системой. Генез очень низкочастотных колебаний до сих пор неясен, вероятно, он обусловлен влиянием надсегментарных (в первую очередь гипоталамических) центров вегетативной регуляции. Высокочастотные колебания сопряжены с дыханием и отражают преимущественно влияние парасимпатической вегетативной нервной системы на сердечную мышцу. Именно эти колебания анализируются при оценке вариабельности сердечного ритма и позволяют диагностировать даже субклинические формы ДВН [28].
Взаимосвязь высокочастотных дыхательных колебаний с изменением длительности RR-интервалов – одна из нерешенных задач современной физиологии. Однако установлено, что эфферентным звеном является блуждающий нерв [29]. Доказательством тому служит исчезновение дыхательной модуляции сердечного ритма после назначения блокаторов М-холинорецепторов или тотального перерезания блуждающего нерва [30].
Предполагают, что дыхание влияет на вариабельность сердечного ритма не через изменение тонуса nervus vagus при вдохе и выдохе, а через усиление респираторно-зависимой вагусной модуляции сердечного ритма. Существует несколько гипотез образования дыхательной модуляции сердечного ритма. Согласно первой из них ЧСС изменяется по механизму «аксон – рефлекс». При вдохе происходит возбуждение рецепторов растяжения легких, которое затем передается по блуждающему нерву к сердцу. Процесс возбуждения не выходит за пределы одного и того же аксона и благодаря антидромному проведению способствует выбросу биологически активных веществ в волокнах, вызывающих соответствующие реакции этого же или соседнего органа, находящегося в той же зоне иннервации [31]. Согласно второй гипотезе ведущим является центральный механизм [32]. Возбуждение нейронов дыхательного центра, генерирующих потенциалы в ритме дыхания, передается преганглионарным кардиомоторным вагусным нейронам. При вдохе эти структуры тормозятся, при выдохе – возбуждаются. В соответствии с вагусным ритмом ЧСС на вдохе увеличивается, на выдохе – уменьшается. Данная гипотеза объясняет феномены, отмечаемые при анализе высокочастотных компонентов вариабельности сердечного ритма, такие как несовпадение частоты высокочастотного пика и частоты дыхания, уменьшение ЧСС во время вдоха. Указанное выше можно объяснить тем, что возбуждение дыхательного центра передается сосудодвигательному нерву через группы специальных нейронов (в ретикулярной формации продолговатого мозга), которые могут изменить частоту разрядов, а также вызвать фазовый сдвиг вплоть до противоположного.
Еще одна гипотеза объясняет развитие дыхательной аритмии за счет барорецепторного механизма [33]. Дыхание изменяет сопротивление сосудов малого круга. Это отражается на величине ударного объема и, как следствие, амплитудах дыхательных волн АД. Последнее изменяет поток импульсов артериальных барорецепторов и разрядов, идущих по волокнам блуждающего нерва к синусовому узлу.
Дыхательная аритмия может развиться в результате изменения газового состава крови. Увеличение концентрации углекислого газа приводит к активации не только дыхательного, но и сосудодвигательного центра. Вследствие этого происходит вдох и увеличивается ЧСС. В пользу данной гипотезы свидетельствуют результаты исследований кардиореспираторных отношений в зависимости от содержания в крови кислорода и углекислого газа [34]. Кроме того, во время дыхательного цикла изменяется кровенаполнение предсердий, что также может влиять на сокращение сердца.
Проведение количественного вегетативного тестирования имеет ряд особенностей. Не надо требовать от обследуемого слишком больших усилий, так как это может привести к активации не парасимпатического, а симпатического отдела вегетативной нервной системы. Существует линейная связь между изменчивостью сердечного ритма и объемом легких: величина экспираторно-инспираторного отношения возрастает при увеличении глубины дыхания. С повышением частоты дыхания экспираторно-инспираторное отношение снижается (включаются симпатические модулирующие влияния – симпато-вагальный индекс увеличивается). Резонансной в системе «сердце – легкие» считается частота дыхания пять-шесть циклов в минуту.
Тест Вальсальвы, пробы с глубоким дыханием, ортостатическая проба повышают экспираторно-инспираторное отношение в положении стоя, пробы с глубоким дыханием и охлаждением лица – в положении лежа, блокада бета-адренергических рецепторов (введение пропранолола и других бета-адреноблокаторов) при модуляции дыхания с собственной частотой не оказывает существенного влияния на экспираторно-инспираторное отношение [29].
В случае увеличения массы тела на 10% отмечается значительное уменьшение экспираторно-инспираторного отношения, при снижении массы тела – его увеличение [35].
Все параметры вариабельности сердечного ритма значительно уменьшаются при необходимости вспомнить и решить арифметические задачи. Эти изменения обусловлены снижением вагусной модуляции. В результате умственной нагрузки экспираторно-инспираторное отношение даже при модулированном дыхании значительно уменьшается [36].
После 20 минут физической нагрузки и последующего отдыха в течение того же времени реакция сердечного ритма в ответ на умственную нагрузку снижается.
Физическая активность и спорт способствуют уменьшению ЧСС и повышению вариабельности ритма сердца за счет высокочастотных колебаний. Детренированность, ухудшение самочувствия, как правило, ассоциируются с увеличением ЧСС и снижением вариабельности сердечного ритма, вялыми реакциями на физический и иные виды стресса. Указанные выше изменения вариабельности сердечного ритма у детренированных – прямое следствие и диагностический признак уменьшения вегетативного тонуса.
Психологический стресс индуцирует заметные изменения вегетативного баланса – при тревожности показатели экспираторно-инспираторного отношения выше, чем при покое [37].
Парасимпатическая активность и соответственно высокочастотные колебания увеличиваются в ночное время, во сне и под влиянием гипноза, симпатическая модуляция вариабельности сердечного ритма (низкочастотные колебания) уменьшается. Данные изменения коррелируют со степенью гипнабельности [38].
Курение также отражается на показателях вариабельности сердечного ритма. Уже через три минуты после первой сигареты кардиореспираторное взаимодействие снижается, мощность низкочастотных колебаний, модулируемых симпатическим отделом вегетативной нервной системы, заметно возрастает. Эти изменения более существенны в положении стоя. К исходным значениям показатели возвращаются не ранее чем через десять минут. При длительном курении изменения в вариабельности сердечного ритма закрепляются [39].
Прием алкоголя сопровождается незначительным уменьшением вариабельности сердечного ритма. При этом у непьющих через час после приема алкоголя отмечаются более значительные изменения, чем у регулярно принимающих алкоголь. Алкоголь воздействует на два звена вегетативной нервной системы: симпатическое и парасимпатическое. Увеличение ЧСС под действием алкоголя объясняется снижением парасимпатической активности [40].
Все эти факторы, оказывающие влияние на вегетативную активность, необходимо учитывать при проведении вегетативного количественного тестирования и последующем анализе результатов.
Снижение параметров вариабельности сердечного ритма прогностически неблагоприятно и предваряет клинические проявления ДВН, которая характеризуется в первую очередь поражением парасимпатического отдела вегетативной нервной системы. Последнее проявляется снижением высокочастотного компонента вариабельности сердечного ритма [21, 28]. По мере прогрессирования вегетативной невропатии изменяется не только высокочастотный, но и низкочастотный компонент вариабельности сердечного ритма [24]. Таким образом, при ДВН поражаются как симпатические, так и парасимпатические нервные волокна [41].
Лечение
Базисная терапия ДВН кардинально не отличается от терапии сенсомоторной диабетической полиневропатии. На первом месте по значимости стоит компенсация СД. Однако даже жесткий контроль гликемии не гарантирует отсутствие риска развития осложнений со стороны нервной системы. В то же время таковой, безусловно, замедляет их развитие [10, 42].
Гипергликемия запускает каскад метаболических и сосудистых нарушений, приводящих к сенсомоторной диабетической невропатии и ДВН. Окислительный стресс, усиленное образование конечных продуктов гликозилирования, активация перекисного окисления липидов, индуцибельной NO-синтазы приводят к избыточному образованию свободных радикалов – молекул, обладающих повышенной реагентной способностью. Свободные радикалы нарушают целостность клеточных структур, в первую очередь эндотелия, вызывая эндоневральную гипоксию и, как следствие, развитие невропатии. Активность антиоксидантной системы организма (в частности, супероксиддисмутазы, каталазы, глутатиона и др.) при СД снижается.
Для преодоления окислительного стресса необходимо применение экзогенных антиоксидантов. Первое место среди антиоксидантов и препаратов, использующихся для патогенетического лечения ДВН, занимает альфа-липоевая (тиоктовая) кислота. Это естественный липофильный антиоксидант. В начале лечения оптимальным считается внутривенное капельное введение альфа-липоевой кислоты (препарата Тиогамма®). Режим применения – 600 мг в виде готового раствора объемом 50 мл в течение 15 дней с последующим приемом 600 мг препарата в виде таблеток один раз в день за 30–40 минут до еды в течение двух месяцев [43]. Целесообразность назначения антиоксидантов при ДВН подтверждена результатами рандомизированного плацебоконтролируемого исследования DEKAN. У пациентов с СД 2 типа и ДВН на фоне перорального приема альфа-липоевой кислоты в дозе 800 мг в сутки в течение четырех месяцев наблюдалось улучшение вариабельности сердечного ритма [44].
Витамины группы В также оказывают патогенетическое влияние. Они способствуют регенерации нерва.
Для активации регенеративных процессов в периферических нервах используются нейротропные комплексы, содержащие большие дозы витаминов группы В (В1, В6, B12), например Мильгамма®.
Одновременное применение тиамина (В1), пиридоксина (В6) и цианокобаламина (В12) стимулирует аксоплазматическую часть транспорта структурных элементов мембраны или миелиновой оболочки, например холин. Тиамин способствует ремиелинизации через активацию фосфолипазы A. В результате усиливается гидролиз эфиров жирных кислот. Кроме того, посредством усиления энергообеспечения (аденозинтрифосфат) поддерживается аксоплазматический транспорт, что особенно важно для восстановления трофической функции нерва у пожилых пациентов. Пиридоксин участвует в синтезе транспортных белков и сфингозина – структурного элемента мембраны нервного волокна и нейромедиаторов антиноцицептивной системы (серотонина, норадреналина). Цианокобаламин обеспечивает доставку жирных кислот в клеточную мембрану и миелиновую оболочку. Применение витамина В12 способствует не только ремиелинизации (за счет активации трансметилирования, обеспечивающего синтез фосфатидилхолина – важного компонента мембраны нервных клеток), но и снижению интенсивности болевого синдрома (за счет собственного антиноцицептивного действия).
Применение нейротропных комплексов витаминов группы В улучшает скорость проведения нервного импульса, репаративные процессы в периферическом нерве.
Добавление к раствору Мильгаммы 20 мг лидокаина обеспечивает безболезненность внутримышечного введения. Это способствует повышению комплаентности лечению.
Инъекционное введение Мильгаммы позволяет преодолеть синдром мальабсорбции и достичь терапевтической концентрации метаболитов тиамина, пиридоксина и цианокобаламина в плазме. Однако постоянное введение цианокобаламина нецелесообразно из-за его способности накапливаться в тканях печени и селезенки. Именно поэтому после короткого курса внутримышечного введения препарата (от пяти до 15 инъекций в зависимости от выраженности болевого синдрома и степени неврологического дефицита) рекомендуется продлить патогенетическую терапию нейротропными комплексами, не содержащими витамин В12. К таковым относятся раствор Нейрогаммы или таблетки Мильгамма® композитум, содержащие витамины В1 и В6. Лечение продолжается до достижения значимого регресса дефицитарных невропатических расстройств.
Антихолинэстеразные препараты также используются в патогенетической терапии ДВН. В основе механизма их действия лежит блокада проницаемости мембраны для K и обратимое ингибирование холинэстеразы, что стимулирует проведение импульса в нервно-мышечном синапсе. Вследствие полисинаптического действия ипидакрин (Ипигрикс, Нейромидин) влияет как на пре-, так и на постсинаптические звенья передачи импульса в центральной, периферической и вегетативной нервной системе. Анальгезирующие эффекты препарата обусловлены воздействием на проницаемость мембраны для Na [45, 46].
Наиболее сложной задачей терапии ДВН является симптоматическое лечение ортостатической гипотензии. При ортостатической гипотензии назначаются минералокортикоиды (флудрокортизона ацетат в дозе 0,1–1,0 мг в сутки). К препаратам второго ряда (при неэффективности флудрокортизона или невозможности его назначения) относятся синтетические аналоги вазопрессина: десмопрессина ацетат, лизин-вазопрессин. Эритропоэтин, кофеин и ингибиторы циклооксигеназы (индометацин, флурбипрофен, ибупрофен, напроксен) не используются в монотерапии и назначаются в качестве дополнительных препаратов.
Существуют и нефармакологические методы компенсации состояния:
- медленное, постепенное изменение положения тела;
- избегание напряжения, натуживания и изометрических упражнений;
- использование компенсаторных физических упражнений;
- отмена гипотензивных лекарственных средств;
- сон с приподнятой головой, скрещивание ног;
- соблюдение диеты с высоким содержанием Na (поваренной соли);
- ношение компрессионного белья и специально разработанных комбинезонов, сдавливающих нижнюю часть тела.
Наличие ортостатической гипотензии или синдрома мальабсорбции значительно затрудняет терапию сопутствующего диабетической полиневропатии болевого синдрома. Так, при скелетно-мышечной боли, сопровождающейся повышением мышечного тонуса, применение отдельных групп миорелаксантов (тизанидина, толперизона), вызывающих расширение периферических сосудов и снижение АД, может усугубить ортостатическую гипотензию. Мальабсорбция обусловливает снижение биодоступности пероральных анальгетиков, вследствие чего может потребоваться повышение их дозы.
В лечении невропатического болевого синдрома широко используются ингибиторы обратного захвата моноаминов, увеличивающих концентрацию медиаторов в синапсах антиноцицептивной системы. Они активируют антиноцицептивную систему и подавляют проведение боли.
Наименее селективные трициклические антидепрессанты (ТЦА) – амитриптилин и имипрамин, демонстрирующие максимальный анальгетический эффект при хронической боли, характеризуются широким спектром побочных реакций. Ортостатическая гипотензия, сухость во рту, тошнота, рвота, повышение внутриглазного давления, запор, задержка мочеиспускания обусловлены антихолинергическим действием ТЦА, тахикардия, аритмия – адренергическим. Кроме того, данные препараты обладают выраженным седативным эффектом, вызывают головокружение. Это ограничивает их применение при ДВН.
Антидепрессанты двойного действия – селективные ингибиторы обратного захвата серотонина и норадреналина (СИОЗСиН) (венлафаксин и дулоксетин) показали высокую анальгетическую активность при невропатических болях различной этиологии, сопоставимую с таковой ТЦА. При этом спектр побочных эффектов СИОЗСиН значительно уже, чем у ТЦА, из-за отсутствия антихолинергического действия. Доказано преимущество венлафаксина медленного высвобождения (препарат Ньювелонг) перед венлафаксином быстрого высвобождения. Благодаря инновационной системе постепенного выделения действующего вещества через осмотический насос в капсуле достигается постоянная равновесная концентрация активного метаболита О-десметилвенлафаксина [47]. Применение Ньювелонга позволяет снизить частоту развития и выраженность побочных реакций СИОЗСиН, таких как тошнота, увеличение потовыделения и сердцебиения. Как следствие, повышаются безопасность терапии невропатической боли у пациентов с ДВН и комплаентность лечению.
Селективные ингибиторы обратного захвата серотонина (СИОЗС) – сертралин, флуоксетин, пароксетин и другие реже вызывают выраженные побочные реакции. Однако анальгетическая активность большинства СИОЗС при хронических болевых синдромах не превышает таковую плацебо [48, 49].
Наркотические анальгетики (фентанил, бупренорфин) и синтетические опиоиды (трамадол, буторфанол) редко применяются для лечения болевого синдрома при диабетической невропатии. Данные препараты блокируют проведение боли на уровне задних рогов спинного мозга, воздействуя через сегментарные и нисходящие ингибиторные нейроны желатинозной субстанции и подавляя высвобождение альгогенного нейромедиатора – субстанции Р.
Целесообразность назначения наркотических анальгетиков таким больным остается дискуссионным вопросом. Их эффективность в отношении болевого синдрома при диабетической полиневропатии существенно ниже, чем в отношении ноцицептивной боли. При этом отмечаются выраженные побочные эффекты (атаксия, зуд), усугубляющие симптомы ДВН (нарушение перистальтики желудочно-кишечного тракта, ортостатическая гипотензия, апноэ во время сна вследствие угнетения дыхательного и сосудодвигательного центра и т.д.) и развитие лекарственной зависимости.
Лучше переносятся габапентиноиды: габапентин (Габагамма) и прегабалин – жирорастворимые аминокислоты, схожие по химическому строению с эндогенным тормозным медиатором гамма-аминомасляной кислотой (ГАМК) (нейротрансмиттером, участвующим в передаче и модуляции боли). В основе развития различных видов спонтанной и стимулзависимой боли у пожилых лиц лежат механизмы, связанные с растормаживанием генерации болевой афферентации на уровне задних рогов спинного мозга и таламуса, то есть сенситизация алгогенных структур ноцицептивной системы. Именно эти процессы являются мишенью для габапентина.
Выделяют следующие механизмы действия габапентина:
- взаимодействует с альфа-2-дельта-2-субъединицами потенциалзависимых Са2+-каналов и тормозит вход ионов Са2+ в нейроны, вследствие чего снижается гипервозбудимость клеточных мембран, уменьшается сенситизация ноцицептивных нейронов;
- увеличивает синтез ГАМК (ее продукция с возрастом снижается), что стимулирует активность глутаматдекарбоксилазы. В результате повышается активность антиноцицептивной системы;
- ингибирует синтез глутамата (возбуждающего нейромедиатора, обладающего эксайтотоксичностью). Это снижает возбудимость структур ноцицептивной системы и предотвращает гибель нейронов;
- модулирует активность ионотропного рецептора глутамата, селективно связывающего N-метил-D-аспартат (NMDA-рецептор). Таким образом препарат воздействует на формирование болевой памяти.
Габапентин значимо уменьшает выраженность болевого синдрома, в то же время частота побочных эффектов при его применении минимальна.
Наш собственный клинический опыт использования габапентина (Габагаммы) в лечении невропатического болевого синдрома при дистальной сенсомоторной диабетической полиневропатии и других видов невропатической боли свидетельствует об эффективности препарата в отношении всех видов спонтанных и стимулзависимых невропатических болей. Частота и выраженность побочных эффектов, характерных для антиконвульсантов (тошнота, головокружение, сонливость, тремор, нистагм, сухость во рту), оказались значительно ниже, чем у других препаратов этой группы.
Неоспоримым преимуществом Габагаммы перед другими габапентиноидами является гибкая линейка доз. Наличие промежуточной дозы 400 мг позволяет выбрать наиболее оптимальную в каждом клиническом случае. Начальная доза габапентина в первый день составляет 300 мг, во второй – 600 мг (в два приема) и в третий – 900 мг (в три приема). В дальнейшем доза увеличивается на 300 мг до достижения оптимальной суточной дозы 1800 мг. Для достижения максимального эффекта и нормальной переносимости суточную дозу можно повысить до 2400 мг с 15-го дня применения, до 3600 мг – с 21-го дня.
Однако, по нашим наблюдениям, крупным (выше среднего роста и/или страдающим ожирением) пациентам прием Габагаммы лучше начинать с 400 мг и добавлять по 400 мг в сутки. В первую неделю титрования доза должна составить 1200 мг в сутки. При недостаточной эффективности терапии в первую неделю – 2400 мг в сутки во вторую и 3600 мг в сутки в третью неделю. Это позволяет быстрее достичь максимально эффективной суточной дозы без снижения комплаентности лечению и повышения риска развития выраженных побочных реакций.
При ночной экзацербации болевого синдрома (даже для пациентов обычного телосложения) более эффективна следующая схема применения Габагаммы: 400 мг вечером, 300 мг утром и 300 мг днем во избежание дневной сонливости. На второй неделе терапии возможно повышение суточной дозы до 2000 мг, на третьей – до 3000 мг.
Габагамма даже при максимальной дозе 3600 мг в сутки хорошо переносится как пожилыми пациентами, так и пациентами, принимающими другие лекарственные средства. Однако наш опыт свидетельствует, что большинству пациентов с невропатической болью при полиневропатиях бывает достаточно 900 или 1000 мг в сутки (при ночной экзацербации боли). Субмаксимальная или максимальная доза Габагаммы требуется только пациентам с декомпенсированным СД. Это можно объяснить изменением пространственной конфигурации альфа-2-дельта-2-субъединицы потенциалзависимых Са2+-каналов вследствие их неферментативного гликозилирования при гипергликемии. После проведения патогенетического лечения диабетической полиневропатии (Тиогаммой и Мильгаммой), активирующего транскетолазу и снижающего неферментативное гликирование белков-рецепторов, дозы Габагаммы, необходимые для контроля болевого синдрома, снижаются как минимум вдвое.
В целом габапентиноиды (габапентин, прегабалин) демонстрируют более высокую эффективность в лечении спонтанной невропатической боли при диабетических полиневропатиях, однако включение прегабалина в перечень лекарственных средств для медицинского применения, подлежащих предметно-количественному учету согласно приказу № 634н от 10.09.2015 «О внесении некоторых изменений в некоторые приказы Министерства здравоохранения и социального развития РФ и Министерства здравоохранения РФ», привело к существенным сложностям административного характера при назначении данного препарата. Габапентин (Габагамма) не вызывает лекарственной зависимости и не входит в перечень препаратов для медицинского применения, подлежащих предметно-количественному учету, поэтому его назначение при невропатической боли в настоящий момент является оптимальным при наличии у пациентов ДВН [49].
Заключение
Диабетическая вегетативная невропатия представляет собой сложную, но решаемую медико-социальную проблему. Для сохранения нормального качества жизни больных СД требуется регулярное (раз в год) неврологическое обследование и исследование вариабельности сердечного ритма, а при выявлении поражения нервной системы – как можно более раннее назначение патогенетической терапии.
A.N. Barinov
I.M. Sechenov First Moscow State Medical University
Contact person: Aleksey Nikolayevich Barinov, mmom-mc@mail.ru
The autonomic neuropathy – a widespread complication of diabetes mellitus and other metabolic disorders. The disease not only reduces the quality of the life of patients, but also increases the risk of death. Besides, it is associated with the manifestation of the significant side effects of some pain killers, as well as with the resistance to a number of oral medications due to malabsorption.
The early diagnosis of autonomic disorders in persons with diabetes and the metabolic syndrome with pulsoximetry assessment of heart rate variability and the timely prescription of the neurotropic therapy allow preventing the development of severe forms of the disease.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.