Влияние дипиридамола на содержание сосудистых факторов роста и функциональное состояние миокарда у больных стабильной стенокардией
- Аннотация
- Статья
- Ссылки



Стимулирующим фактором ангиогенеза является накопление эндогенного аденозина в условиях гипоксии (15), последнее способствует пролиферации эндотелиальных клеток (11, 14) и стабилизирует матричную РНК VEGF (10). В свою очередь известно, что дипиридамол стимулирует накопление эндогенного аденозина в плазме, интерстиции миокарда и в кардиомиоцитах, в основе которого лежит ингибирование транспорта аденозина через клеточную мембрану и ингибирование аденозиндезаминазы (2, 3, 9).
В связи с этим целью нашего исследования явилось определение возможности влияния дипиридамола на содержание сосудистых факторов роста в крови и функциональное состояние миокарда в динамике у больных стабильной стенокардией.
Материалы и методы
Нами обследовано 50 пациентов мужского пола в возрасте от 45 до 68 лет (средний возраст – 56 ± 1,3 лет) с ИБС. Особенностью всех пациентов при обследовании были низкий коронарный и миокардиальный резерв на фоне активной антиангинальной терапии. Были выделены 2 группы по 25 человек, которым в дополнение к стандартной терапии ИБС (нитраты, бета-блокаторы, блокаторы Са-каналов, ингибиторы АПФ, статины, аспирин) был назначен дипиридамол в суточной дозе 300 мг (Курантил N фирмы «Берлин Хеми/ Группа Менарини», Германия). Первую группу составили пациенты без аневризмы левого желудочка (ЛЖ), вторую группу – пациенты с аневризмой левого желудочка. В исследование были включены пациенты со стенокардией напряжения ФК 3 и 4, которые перенесли в анамнезе ИМ, 76% пациентов в каждой группе страдали мультифокальным атеросклерозом, 65% – артериальной гипертензией. По возрасту, полу и основным клиническим параметрам обе группы были сопоставимы.
Cредний порог толерантности в обеих группах составил 2,04 ± 0,16 и 1,2 ± 0,18 ступень по Bruce (p* < 0,05) соответственно (при этом показатель р* обозначает сравнение значений I и II группы между собой, а показатель р – сравнение значений в каждой группе). По результатам коронароангиографии все обследованные пациенты имели многососудистое поражение коронарных артерий. Все пациенты обследовались по единому протоколу, включавшему ЭКГ, холтеровское мониторирование ЭКГ, ЭхоКГ в покое, стресс-ЭхоКГ с физической нагрузкой на тредмиле, коронароангиографию. Через 1 и 3 месяца от начала исследования проводилась повторная стресс-ЭхоКГ с физической нагрузкой на тредмиле.
Проба с физической нагрузкой проводилась на тредмиле «MARQUETTE CENTRA» фирмы Siemens (Германия). Для определения порога толерантности был применен метод непрерывной ступенчато возрастающей нагрузки в течение 3 мин. на каждой ступени. В зависимости от выполненной максимальной нагрузки, оценивалась толерантность к физической нагрузке: I ступень – низкая, II ступень – средняя, III ступень и выше – высокая толерантность к физической нагрузке. Ультразвуковые исследования проводились на аппаратах «Sonos-2500» и «Sonos-5500» фирмы Hewlett-Packard, США, с использованием трансторакальных датчиков 3,5/2,7 Мгц. Использовали стандартные проекции: парастернально по длинной и короткой оси, апикально 2-, 4- и 5-камерные позиции. При анализе ЭхоКГ в покое и на высоте нагрузки оценивалась общая фракция выброса ЛЖ (ОФВ). Для количественной оценки нарушений сократительной функции рассчитывался индекс нарушения сегментраной сократимости (ИНСС) ЛЖ (сократимость каждого сегмента мы оценивали в баллах: нормальная сократимость – 1 балл, гипокинезия – 2, акинезия – 3, дискинезия – 4 балла; сумму баллов делили на общее число исследованных сегментов).
Для выяснения вопроса и характера поражений коронарного русла, аорты, магистральных и периферических артерий, всем больным было проведено ангиографическое исследование. Ангиография выполнялась на установке «Integris V-3000» (Рhilips, Голландия), цифровую и математическую обработку проводили на аппарате «Easy Vision R/F» (Рhilips, Голландия). Использовали методику Judkins с введением катетера путем чрескожной пункции бедренной артерии по методу Seldinger. В качестве контрастного вещества применяли Омнипак. Селективную коронарографию проводили в нескольких проекциях. Гемодинамически значимым показателем считали сужение коронарной артерии более 50%.
Всем пациентам исходно через 1 и 3 месяца проводился иммуноферментный анализ (ИФА) крови из периферической вены с целью определения уровня VEGF и основного FGF (bFGF).
Дополнительно нами была сформирована группа здоровых добровольцев (13 мужчин) в возрасте от 41 до 66 (средний возраст 54 ± 6,3) лет. Концентрация bFGF в плазме крови у них составила 1,8 ± 0,5 пкг/мл, VEGF – 25,3 ± 0,3 пкг/мл. В результате проведенных исследований было установлено, что базальный уровень ангиогенных факторов в группе контроля значительно уступает исходному значению в плазме у больных ИБС.
Изучение уровня VEGF и bFGF производилось методом иммуноферментного анализа на микропланшетном анализаторе «Anthos 2020» (Австрия) с помощью набора реактивов фирмы «R&D systems» (Великобритания) для bFGF (чувствительность 0,25 пкг/мл) и реактивов фирмы Сytimmune (США) для VEGF (чувствительность 18,6 пкг/мл).
Статистическую обработку результатов проводили с помощью компьютерной программы Excell 2000. Достоверность различий определяли по критерию t Стьюдента и данные считались статистически достоверными при значении p < 0,05. При корреляционно-регрессионном анализе использовали коэффициент линейной корреляции Пирсона (r).
Результаты исследования
На первом этапе обследования (до назначения терапии) средний функциональный класс стенокардии по канадской классификации кардиологов (CCS) в группах составил соответственно 2,8 ± 0,15 и 3,2 ± 0,18, p* > 0,05 (при этом показатель р* обозначает сравнение значений I и II группы между собой, а показатель р – сравнение значений в каждой группе).
При проведении стресс-ЭхоКГ, которая была выполнена всем больным, положительный результат пробы отмечался в 100% случаях (50 больных). Cредний порог толерантности в обеих группах составил 2,04 ± 0,16 и 1,2 ± 0,18 ступень по Bruce (p* < 0,05) соответственно. Время выполнения физической нагрузки в обеих группах составило 4,92 ± 0,43 и 2,98 ± 0,43 мин. соответственно (р* < 0,05). Результаты показателей размеров и сократимости миокарда до и на стресс-тесте представлены в таблице 1.
Как видно из таблицы 1, по результатам ЭхоКГ-обследования в покое выявлено, что в среднем по группам общая сократительная способность миокарда была снижена и составила в покое 51,32 ± 1,09% и 46,34 ± 1,07% соответственно (р* < 0,05), на высоте нагрузки наблюдается достоверное снижение ОФВ в обеих группах, которая составила 44,96 ± 1,46% и 38,75 ± 0,94% соответственно (р*< 0,05). ИНСС в покое составил 1,37 ± 0,06 и 1,41 ± 0,03 (р*< 0,05) соответственно, а за счет появления новых и усугубления имевшихся зон асинергии, ИНСС после нагрузки увеличился и составил 1,59 ± 0,09 и 1,71 ± 0,05 соответственно (р*< 0,05). Таким образом, обе рассматриваемые группы пациентов имели тяжелую форму коронарной недостаточности с низким порогом ишемии и распространенной зоной риска ишемии.
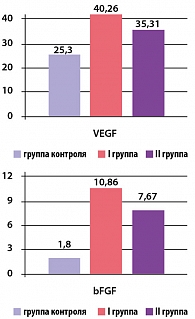
Исходная концентрация VEGF в I и II группах составила 40,26 ± 4,64 пкг/мл и 35,31 ± 5,53 пкг/мл, соответственно (p*> 0,05), а концентрация bFGF равна 10,86 ± 2,62 пкг/мл и 7,67 ± 2,58 пкг/мл соответственно (p*> 0,05), что сравнительно выше по сравнению с контрольной группой (рисунок 1).
На фоне лечения дипиридамолом через 1 месяц большинство пациентов I группы отметили улучшение субъективного самочувствия. Средний ФК стенокардии по CCS в I группе составил 2,4 ± 0,13 (p < 0,05), во II группе – 3 ± 0,12 (p > 0,05, p* < 0,05). При приеме дипиридамола у 11 пациентов отмечались некоторые побочные явления (головная боль, гипотензия, тошнота, диарея), которые не требовали специального лечения и прошли через одну неделю его приема.
При проведении стресс-ЭхоКГ средний порог толерантности в I группе составил 2,44 ± 0,27 (p < 0,05) и во II – 1,4 ± 0,22 (p > 0,05, p* < 0,05). Отмечалось также увеличение времени выполнения физической нагрузки в I группе, которое составило 5,36 ± 0,55 мин. (р < 0,05) и 3,21 ± 0,25 мин. (p < 0,05) соответственно (р*< 0,05). Результаты показателей размеров и сократимости миокарда в покое и на стресс-пробе по данным ЭхоКГ в двух группах через 1 месяц лечения дипиридамолом представлены в таблице 2.
Как видно из таблицы 2, через 1 месяц лечения ОФВ в покое в обеих группах сохранилась сниженной и составила в покое 52,36 ± 1,01% (p > 0,05) и 47,42 ± 1,31% (p > 0,05) соответственно (р* < 0,05), на высоте нагрузки ОФВ равна 51,8 ± 1,87% (p > 0,05) и 38,64 ± 1,07% (p > 0,05) соответственно (р* < 0,05). ИНСС составил в обеих группах в покое 1,25 ± 0,06 (p > 0,05) и 1,38 ± 0,04 (p > 0,05, р* < 0,05), после нагрузки – 1,4 ± 0,08 (p > 0,05) и 1,67 ± 0,04 (р > 0,05, p* < 0,05) соответственно, т.е., на высоте нагрузки наблюдалось появление меньшего количества сегментов с асинергией миокарда в I группе по сравнению с II.
Таким образом, у пациентов I группы, получавших дипиридамол, через 1 месяц лечения наблюдается тенденция к увеличению времени выполнения нагрузки и среднего порога толерантности к физической нагрузке, по сравнению со II группой. Также у них отмечается меньшее снижение ОФВ на высоте нагрузки, чем у больных II группы.
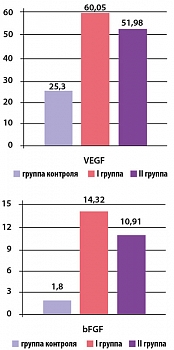
Концентрация VEGF в I и II группах составила 60,05 ± 5,68 пкг/мл (p < 0,05) и 51,98 ± 4,48 пкг/мл (p < 0,05) соответственно (p* < 0,05), а концентрация bFGF – 14,32 ± 1,29 пкг/мл (p < 0,05) и 10,91 ± 1,15 пкг/мл (p > 0,2) соответственно (p* < 0,05) (рисунок 2).
На фоне лечения дипиридамолом через 3 месяца средний ФК стенокардии в I и II группе составил 2,16 ± 0,19 (р < 0,001) и 3 ± 0,11 соответственно (р > 0,05, р* < 0,001). Таким образом, отмечается достоверное снижение ФК стенокардии у больных I группы, что может свидетельствовать об эффективности применения дипиридамола у больных без аневризмы ЛЖ.
При проведении стресс-ЭхоКГ средний порог толерантности в I группе составил 2,48 (p < 0,05) и в II – 1,4 ± 0,22 (p > 0,05, p* < 0,05). Время выполнения физической нагрузки в I и II группах также статистически достоверно не изменилось по сравнению с фазой 2 исследования и составило 6,04 ± 0,53 мин. (p< 0,001) и 3,23 ± 0,21 мин. соответственно (р > 0,05, p* < 0,001). Результаты ЭхоКГ показателей размеров и сократимости в покое и на стресс-пробе через 3 месяца лечения дипиридамолом представлены в таблице 3.
Как видно из таблицы 3, ОФВ в I группе составила в покое 52,43 ± 1,1%, что было несколько выше, чем исходно (р > 0,05). Тогда как во II группе через 3 месяца лечения ОФВ почти не изменилась и составила 48,35 ± 1,1% (р > 0,05, р* < 0,05). На высоте нагрузки в I группе на фоне увеличения общего времени выполнения нагрузки ОФВ составила 52,36 ± 2,13% (р > 0,05), что свидетельствует об улучшении кровоснабжения в ранее гипокинетичных сегментах, о чем позволяет судить также ИНСС, который в I группе в покое равен 1,23 ± 0,06 р < 0,05), а после нагрузки – 1,37 ± 0,08 (р < 0,05). Во II группе на высоте нагрузки отмечалось примерно такое же снижение ОФВ, как и через 1 месяц от начала лечения (ОФВ – 39,75 ± 1,17%, р > 0,05, р* < 0,05), ИНСС в покое – 1,37 ± 0,05 (р > 0,05, р* < 0,05), при нагрузке – 1,67 ± 0,01 (р > 0,05, р* < 0,05).
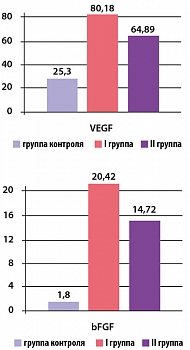
При проведении иммуноферментного анализа отмечалось повышение концентрации VEGF и bFGF в обеих группах по сравнению с исходными значениями. Результаты анализа представлены на рисунке 3.
Таким образом, через 3 месяца от начала исследования концентрация VEGF в обеих группах составила 80,18 ± 5,93 (p < 0,05) и 64,89 ± 4,68 пкг/мл (p < 0,05) соответственно (p* < 0,05), а bFGF – 20,42 ± 2,57 (p < 0,05) и 14,72 ± 3,21 пкг/мл (p > 0,05) соответственно (р* < 0,05).
Через 3 месяца от начала лечения дипиридамолом пациенты I группы отметили существенное улучшение в своем физическом состоянии, а с учетом результатов, полученных при иммуноферментном анализе и показывающих достоверное увеличение концентрации сосудистых факторов роста (VEGF и bFGF), возможно предположить об активации ангиогенеза у пациентов обеих групп. Повышение уровня сосудистых факторов роста у пациентов с аневризмой ЛЖ, возможно, связано с наличием жизнеспособного миокарда в области аневризмы ЛЖ, также с этим может быть связано незначительное повышение ОФВ при ЭхоКГ и меньшее ее падение на высоте нагрузки, однако небольшой положительный эффект применения дипиридамола у пациентов этой группы свидетельствует о малой активности ангиогенеза в зоне рубцового поражения миокарда, что позволяет нам судить о незначительной клинической эффективности добавления препарата к традиционному лечению больных ИБС с аневризмой ЛЖ.
Обсуждение полученных результатов
Дипиридамол, достаточно известный и широко используемый препарат, применяется в клинической практике с 1959 г. В связи с развитием синдрома коронарного обкрадывания препарат ранее считали опасным для применения у пациентов с ИБС. При классической форме стенокардии (стенокардия напряжения) на фоне выраженного атеросклероза коронарных сосудов коронарорасширяющие средства могут ухудшать состояние больного, так как расширяют, в основном, относительно здоровые коронарные сосуды. При этом происходит перераспределение крови в относительно здоровые участки миокарда (синдром коронарного обкрадывания). Интересно отметить, что точкой приложения действия дипиридамола являются не магистральные коронарные артерии, а интрамуральные артериолы. Этим объясняется феномен «обкрадывания» у больных с коронарным атеросклерозом после применения дипиридамола. Однако синдром коронарного обкрадывания может развиться только при внутривенном введении препарата в высоких дозах. Использование дипиридамола у пациентов с ИБС хорошо переносится и безопасно, что также доказано результатами нашего исследования, а применение пероральных форм препарата предотвращает развитие этого побочного явления лечения, который может развиться только при внутривенном введении препарата в высоких дозах (2, 6, 12, 16). Наблюдавшиеся у некоторых пациентов побочные эффекты проходили через 1-2 недели без специального лечения.
При длительном приеме препарата может улучшаться коронарный кровоток в областях миокарда, кровоснабжаемых стенозированными коронарными артериями, что подтвердилось исследованиями на крысах и кроликах (13, 20). E. Picano (4) и R. Belardinelli et al. (5) отмечали улучшение перфузии у больных со стабильной стенокардией, оцениваемой при использовании сцинтиграфии и позитронно-эмиссионной томографии миокарда, однако клинического улучшения состояния у больных практически не происходило, как и в результатах нашего исследования у пациентов II группы.
Возможно, положительное действие препарата связано с прекондиционированием миокарда, с прямым эффектом на кардиомиоциты из-за высокого сродства А1-аденозиновых рецепторов (9), также можно предположить, что одним из механизмов терапевтического действия больших доз дипиридамола является ангиогенез, связанный с накоплением эндогенного аденозина в условиях гипоксии (15, 18).
Аденозин стимулирует пролиферацию эндотелиальных клеток (11, 14), а гипоксия и другие, пока еще мало изученные, факторы способны стимулировать синтез и выделение VEGF, FGF и других (7,8). С этим предположением, возможно, связано достоверное увеличение уровня VEGF и bFGF в нашем исследовании. Несомненно, необходимы дальнейшие исследования с использованием дипиридамола у пациентов с ИБС.
Выводы
- Добавление дипиридамола в суточной дозе 300 мг к традиционной антиангинальной терапии способствует улучшению клинической картины заболевания и уменьшению функционального класса стенокардии у больных ИБС. Наиболее значимое улучшение состояния достигается у пациентов с ИБС младше 60 лет с ОФВ более 50% без аневризмы ЛЖ.
- Применение больших доз дипиридамола безопасно у больных ИБС, при этом у некоторых пациентов в первый месяц лечения могут наблюдаться побочные действия препарата (головная боль, тошнота, диарея, гипотензия), которые не требуют специального лечения.
- При использовании дипиридамола у больных без аневризмы ЛЖ в течение 3 месяцев отмечается увеличение порога толерантности к физической нагрузке, увеличение времени выполнения нагрузки (∆ общего времени выполнения нагрузки 1.12 мин.), уменьшение зон асинергии по данным стресс-ЭхоКГ на высоте нагрузки.
- Дипиридамол стимулирует гуморальную экспрессию сосудисто-эндотелиального фактора роста и основного фактора роста фибробластов у больных ИБС, что позволяет косвенно судить об активизации ангиогенеза в гипоперфузированных областях миокарда, находящихся в зоне стенозированной коронарной артерии.
Дипиридамол является эффективным средством в комплексной терапии у больных со стабильной стенокардией без аневризмы ЛЖ на фоне диффузного поражения коронарного русла.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.