Влияние морфофункционального состояния эндометрия на исход беременности
- Аннотация
- Статья
- Ссылки
Термин «простагландины» впервые употребил шведский физиолог У. Эйлер, обнаруживший их в секрете предстательной железы (prostate gland). В дальнейшем они были обнаружены во всех органах и тканях и стали предметом пристального внимания исследователей. Ученик Эйлера Бергстрем выделил в кристаллическом виде простагландины, образующиеся в органах репродуктивной системы: простагландин F2a, названный так за его растворимость в фосфатном буфере, и простагландин Е2 (от ester – эфир, которым извлекался этот простагландин) (1, 2).
Простагландины участвуют во всех процессах, происходящих в репродуктивной системе, – регуляции менструального цикла, перистальтике маточных труб, овуляции, продвижении яйцеклетки, подвижности сперматозоидов, тонусе матки.
За исследования в области простагландинов ученикам Эйлера была присуждена Нобелевская премия.
Простагландины Е2 и F2a имеют одинаковый молекулярный вес и очень сходное строение, но в корне различаются биологическими свойствами. Простагландин Е2 способствует улучшению микроциркуляции в тканях, оксигенации крови, расщеплению коллагена за счет активизации протеолитических ферментов, что приводит к размягчению и расширению шейки матки. Простагландин F2a обладает противоположным действием: вызывает спазм сосудов, нарушение гемоциркуляции, ишемию тканей, повышает чувствительность миометрия к окситоцину, что обусловливает повышение тонуса матки (1, 2, 9).
Стимуляторами их продукции являются катехоламины, брадикинин, ангиотензин, а также ишемия и механическое повреждение клеток. Ингибируют продукцию простагландинов глюкокортикоиды, прогестерон, нестероидные противовоспалительные средства.
Учитывая большую роль простагландинов в регуляции функции репродуктивной системы, представляет большой интерес определение их участия в генезе репродуктивных потерь и возможность коррекции нарушения их продукции.
Целью настоящего исследования явилось определение роли морфофункционального состояния эндометрия в генезе невынашивания беременности на основании выяснения особенностей продукции простагландинов Е2 и F2a при ее нормальном и осложненном течении.
Материал и методы
Проведено комплексное обследование 100 пациенток в возрасте от 18 до 41 года с помощью общеклинических, бактериологических, ультразвукового, морфологического, иммуноферментного (определение плацентарных гормонов, простагландинов Е2 и F2a в эндометрии и сыворотке крови) методов.
Все пациентки были разделены на три группы: I (основную) группу составили 50 женщин с прерыванием беременности в первом триместре (IА подгруппа – 25 женщин с неразвивающейся беременностью и IБ подгруппа – 25 женщин с самопроизвольным абортом); II (основную) группу составили 25 беременных с угрозой невынашивания в первом триместре; III (контрольную) группу составили 25 практически здоровых женщин, которым производился медицинский аборт.
Результаты исследования
Пациентки сравниваемых групп не имели достоверных различий в возрасте. Однако наличие экстрагенитальных заболеваний чаще отмечалось у женщин I и II групп по сравнению с контрольной: хронический тонзиллит был у 30,0%, 28,0% и 16,0% соответственно; хронический пиелонефрит у 10,0%, 8,0% и 4,0% соответственно, заболевания желудочно-кишечного тракта у 8,0%, 4,0% и 2,0% соответственно. Хронические воспалительные заболевания органов малого таза в анамнезе преобладали у пациенток I группы (64,0%) по сравнению со II (32,0%) и III (10,0%) группами. Гормональные нарушения функции яичников в анамнезе также доминировали у пациенток I (30,0%) и II (28,0%) групп по сравнению с контрольной (4,0%).
Прерывание беременности у пациенток I группы происходило в сроки от 6 до 12 недель. Причем у 27 (54,0%) женщин это была повторная потеря беременности. Гистологическое исследование материала соскоба из полости матки показал, что основными причинами неразвивающейся беременности (IА подгруппа) был хронический эндометрит в сочетании с неполной гестационной перестройкой эндометрия (68,0%) и гормональные нарушения, приводящие к его неполной децидуальной трансформации (28,0%).
При спонтанном аборте (IБ подгруппа) выявлялись обратные соотношения этих этиологических факторов (32,0% и 54,0% соответственно). Патологических изменений эндометрия у пациенток контрольной группы не наблюдалось.
Сравнительный анализ содержания простагландинов Е2 и F2a в эндометрии показал, что их максимальные значения определялись при спонтанном аборте (17612,5 ± 675,3 пкг/мл и 19881,8 ± 348,6 пкг/мл соответственно), в то время как при неразвивающейся беременности (IА подгруппа) их уровень был ниже, чем в контрольной группе (8180,4 ± 112,3 пкг/мл и 10338 ± 598,6 пкг/мл; 11831 ± 232,5 пкг/мл и 14925 ± 738,9 пкг/мл соответственно). Возможно, это является одной из причин отсутствия отторжения хориального мешка из полости матки при неразвивающейся беременности.
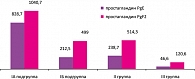
Аналогичные соотношения содержания простагландинов Е2 и F2a наблюдались в сыворотке крови пациенток IА и IБ подгруппп (828,7 ± 36,4 пкг/мл и 1040,7 ± 28,4 пкг/мл; 212,5 ± 64,5 пкг/мл и 499,0 ± 87,7 пкг/мл), тогда как в контрольной группе уровень обоих видов простагландинов составлял 46,6 ± 7,4 пкг/мл и 120,6 ± 13,5 пкг/мл соответственно (рисунок 1). Следует отметить, что при неразвивающейся беременности по типу анэмбрионии содержание простагландинов в эндометрии и сыворотке крови было ниже, чем при неразвивающейся беременности по типу гибели эмбриона.
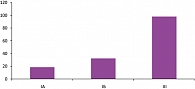
Потеря беременности сопровождалась снижением уровня прогестерона в сыворотке крови, наиболее выраженным при спонтанном аборте (18,4 ± 2,2 нмоль/л), чем при неразвивающейся беременности (32,2 ± 3,6 нмоль/л). При физиологическом течении беременности содержание прогестерона в сыворотке крови составляло 97,8 ± 8,6 нмоль/л, что достоверно выше, чем в IА и IБ подгруппах (р < 0,05) (рисунок 2).
Представляет интерес тот факт, что у пациенток II группы, беременность которых протекала с угрозой невынашивания, среднее сывороточное содержание простагландина Е2 составляло 238,7 ± 53,6 пкг/мл и простагландина F2a – 514,3 ± 48,7 пкг/мл. Причем повышение уровня простагландинов при угрозе прерывания беременности коррелировало с клиническими проявлениями этого гестационного осложнения (интенсивность болевого симптома) и данными ультразвукового исследования (повышение тонуса миометрия, уменьшение размеров желтого тела, спазм спиральных артерий и яичниковой артерии на стороне формирования желтого тела). Кроме того, выявлена обратная корреляционная связь между сывороточным содержанием прогестерона и простагландинов, что указывает на гормональную регуляцию их продукции. Так у 20 (80,0%) пациенток II группы выявлено снижение уровня прогестерона до 48,4 ± 3,9 нмоль/л.
Следует отметить, что повышение сывороточного уровня простагландинов является более достоверным признаком угрозы невынашивания, поскольку оно наблюдалось у всех пациенток с этим гестационным осложнением.
Прогестероновая недостаточность компенсировалась натуральными гестагенами. С нашей точки зрения, препаратом выбора является Утрожестан – натуральный микронизированный прогестерон в капсулах. Этот препарат не обладает андрогенным, глюкокортикоидным, эстрогенным и метаболическим эффектами.
Как уже было отмечено, повышение концентрации простагландинов связано со снижением уровня эндогенного прогестерона в сыворотке крови. Как известно, Утрожестан на 100% по своей химической формуле и фармакологическим эффектам идентичен эндогенному прогестерону. Эндогенный прогестерон, как и его стопроцентный аналог, Утрожестан обладают следующими клиническими эффектами: прогестагенный, антиэстрогенный, антиальдостероновый, антиандрогенный (физиологическая регуляция уровня андрогенов), токолитический, успокаивающий, положительный нейротропный, иммунокорригирующий. Утрожестан нормализует структуру и функцию эндометрия, снижает тонус миометрия (токолитический эффект), улучшает гемодинамику в миометрии и формирующейся плаценте. Именно поэтому применение натурального микронизированного прогестерона (Утрожестан) является оптимальным для таких пациенток.
Также немаловажным преимуществом Утрожестана является возможность его применения как интравагинально, так и перорально. За счет микронизации прогестерона удалось сохранить абсолютную идентичность химической формулы и обеспечить оптимальную всасываемость и биодоступность молекулы прогестерона как при пероральном, так и при вагинальном пути введения, что подтверждено клиническими исследованиями. Микронизация – высокотехнологичный процесс физического воздействия на субстанцию, в результате которого крупные и острые кристаллы субстанции становятся меньших размеров и практически сферической формы, что позволяет повысить всасываемость и биодоступность препарата.
При вагинальном пути введения биодоступность препарата к матке и эндометрию наиболее высока, так как уровень прогестерона в плазме крови постепенно возрастает, достигая максимального значения через 2-6 часов. Средняя концентрация прогестерона сохраняется на уровне 9,7 нг/мл в течение 24 часов. При пероральном введении максимальная концентрация в крови достигается уже через 1-3 часа после приема препарата, после чего уровень прогестерона постепенно начинает снижаться.
Особенности фармакокинетики препарата следует учитывать, подбирая тот или иной путь введения препарата для своих пациенток. В данном исследовании мы назначали Утрожестан интравагинально в дозе 200-300 мг в сутки с ранних сроков беременности до 20 недель.
Клинические наблюдения показали, что улучшение самочувствия (исчезновение болевого синдрома) у пациенток II группы отмечалось уже через 4-5 дней от начала терапии.
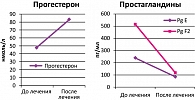
Контрольное исследование, проведенное через 2 недели, показало значительное увеличение уровня прогестерона в сыворотке крови (до 86,7 ± 3,3 нмоль/л). На этом фоне существенно снизилось сывороточное содержание простагландинов Е2 и F2a до 86,4 ± 16,1 пг/мл и 120,6 ± 11,4 пг/мл соответственно.
Полученные данные наглядно свидетельствуют о прогестагензависимой продукции простагландинов (рисунок 3).
В результате проведенной терапии беременность в I триместре удалось пролонгировать у всех 25 пациенток. У 1 (4,0%) пациентки произошел самопроизвольный выкидыш в сроке 16-17 недель на фоне первичной хламидийной инфекции, у 2 (8,0%) больных произошли преждевременные роды в сроке 34-35 недель. У остальных 22 пациенток II группы произошли роды в 38-40 недель живыми доношенными детьми.
Таким образом, рациональное лечение угрозы прерывания беременности с адекватной коррекцией гипопрогестеронемии способствует снижению сывороточного уровня простагландинов и в большинстве случаев (92,0%) обеспечивает пролонгирование беременности до 38-40 недель и рождение живого доношенного ребенка.
Сравнивая сывороточные уровни простагландинов Е2 и F2a у пациенток трех групп, можно определить дополнительные диагностические и прогностические критерии невынашивания беременности: признаком угрозы прерывания беременности является повышение уровня простагландинов выше 50 пкг/мл, а увеличение их значений более 700 пкг/мл является прогностически неблагоприятным критерием благополучного исхода беременности.
Выводы
- Одним из патогенетических механизмов спонтанного аборта является повышение продукции простагландинов Е2 и F2a на фоне преобладания воспалительных процессов в эндометрии.
- Отсутствие отторжения хориального мешка из полости матки при неразвивающейся беременности обусловлено сниженным уровнем этих простагландинов по сравнению с физиологической беременностью.
- Определение сывороточного уровня простагландинов Е2 и F2a во время беременности позволяет прогнозировать ее исход.
- Применение Утрожестана для лечения угрозы прерывания беременности позволяет уменьшить продукцию простагландинов Е2 и F2a и снизить частоту репродуктивных потерь.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.