Возможна ли повторная адъювантная терапия меланомы?
- Аннотация
- Статья
- Ссылки
- English
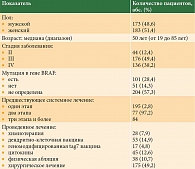
Материал и методы. В исследование включено 356 пациентов с меланомой – 173 (48,6%) мужчины и 183 (51,4%) женщины, получавших лечение в Национальном медицинском исследовательском центре онкологии им. Н.Н. Петрова с 1988 по 2019 г. У 12,4% больных отмечалась II стадия заболевания, у 49,4% – III, у 38,2% – IV стадия. 49,2% пациентов получали хирургическое лечение, 7,9% – химиотерапию, 14,9% – дендритно-клеточную вакцину (ДКВ), 4,8% – модифицированную геном tag7 аутологичную вакцину (Tag7), 12,6% – терапию цитокинами, 10,7% больных – методы физической абляции – стереотаксическую лучевую или фотодинамическую терапию. Оценивались общая выживаемость (ОВ) и выживаемость без прогрессирования (ВБП).
Результаты. Медиана ОВ в общей когорте больных составила 34,1 месяца (95%-ный доверительный интервал (ДИ) 21,6–42,5), медиана ВБП – 5,4 месяца (95% ДИ 4,2–6,6.). Важными прогностическими факторами в многофакторном анализе служили стадия (р = 0,011 для ОВ и 0,115 для ВБП), уровень лактатдегидрогеназы (р = 0,014 для ОВ и > 0,1 для ВБП), проведенное лечение (р = 1,72 × 10Е-5 для ВБП и 1,4 × 10E-10 для ОВ) и наличие первично-множественной опухоли (p = 0,556 для ВБП и 1,7 × 10Е-6 для ОВ). Наиболее эффективным подходом оказалась вакцинотерапия. Медиана ОВ для ДКВ составила 91,3 месяца, для Tag7 не достигнута. Одногодичная ОВ составила 85 и 74% соответственно. После года наблюдения у больных, получавших Tag7, наблюдалось плато ВБП на уровне 45%, при ДКВ после трех лет – на уровне 37%. Относительный риск (ОР) прогрессирования для ДКВ составил 0,372 (р = 2,1 × 10E-4), для Tag7 – 0,282 (p = 0,004). ОР смерти для ДКВ – 0,698 (p = 0,067), для Tag7 – 0,546 (p = 0,176). Проведение физической абляции при учете прочих факторов прогноза повысило ОР прогрессирования до 3,275 (р < 0,001), риск смерти до 1,05 (р = 0,141).
Заключение. АТ после ранее проведенной системной терапии позволяет увеличить как ОВ, так и ВБП.
Материал и методы. В исследование включено 356 пациентов с меланомой – 173 (48,6%) мужчины и 183 (51,4%) женщины, получавших лечение в Национальном медицинском исследовательском центре онкологии им. Н.Н. Петрова с 1988 по 2019 г. У 12,4% больных отмечалась II стадия заболевания, у 49,4% – III, у 38,2% – IV стадия. 49,2% пациентов получали хирургическое лечение, 7,9% – химиотерапию, 14,9% – дендритно-клеточную вакцину (ДКВ), 4,8% – модифицированную геном tag7 аутологичную вакцину (Tag7), 12,6% – терапию цитокинами, 10,7% больных – методы физической абляции – стереотаксическую лучевую или фотодинамическую терапию. Оценивались общая выживаемость (ОВ) и выживаемость без прогрессирования (ВБП).
Результаты. Медиана ОВ в общей когорте больных составила 34,1 месяца (95%-ный доверительный интервал (ДИ) 21,6–42,5), медиана ВБП – 5,4 месяца (95% ДИ 4,2–6,6.). Важными прогностическими факторами в многофакторном анализе служили стадия (р = 0,011 для ОВ и 0,115 для ВБП), уровень лактатдегидрогеназы (р = 0,014 для ОВ и > 0,1 для ВБП), проведенное лечение (р = 1,72 × 10Е-5 для ВБП и 1,4 × 10E-10 для ОВ) и наличие первично-множественной опухоли (p = 0,556 для ВБП и 1,7 × 10Е-6 для ОВ). Наиболее эффективным подходом оказалась вакцинотерапия. Медиана ОВ для ДКВ составила 91,3 месяца, для Tag7 не достигнута. Одногодичная ОВ составила 85 и 74% соответственно. После года наблюдения у больных, получавших Tag7, наблюдалось плато ВБП на уровне 45%, при ДКВ после трех лет – на уровне 37%. Относительный риск (ОР) прогрессирования для ДКВ составил 0,372 (р = 2,1 × 10E-4), для Tag7 – 0,282 (p = 0,004). ОР смерти для ДКВ – 0,698 (p = 0,067), для Tag7 – 0,546 (p = 0,176). Проведение физической абляции при учете прочих факторов прогноза повысило ОР прогрессирования до 3,275 (р < 0,001), риск смерти до 1,05 (р = 0,141).
Заключение. АТ после ранее проведенной системной терапии позволяет увеличить как ОВ, так и ВБП.



Введение
В последние годы существенно изменились методы адъювантной терапии меланомы. Исследования показали, что на фоне применения ингибиторов BRAF и MEK у пациентов с мутацией в гене BRAF или анти-PD1-препаратов увеличивается не только выживаемость без прогрессирования (ВБП) заболевания, но и общая выживаемость (ОВ). Все указанные препараты включены в современные клинические рекомендации. Однако в исследованиях участвовали только пациенты, ранее не получавшие системного лекарственного лечения. Вместе с тем при прогрессировании процесса локальные рецидивы или олигометастатическое поражение – явление не редкое [1–3]. Клинических исследований на эту тему проводилось мало. Мы проанализировали эффективность адъювантной терапии у больных меланомой, получавших ранее системное лекарственное лечение.
Материал и методы
Участниками исследования стали 356 пациентов НМИЦ онкологии им. Н.Н. Петрова с меланомой II–IV стадий, получавшие хирургическое лечение или адъювантную терапию после системного лечения, проведенного в условиях реальной клинической практики с 1988 по 2019 г. Характеристика больных представлена в табл. 1. Как видим, в исследование вошло значительное количество пациентов, получавших только одну линию системного лечения. Более половины пациентов имели II или III стадию процесса, то есть стадии, при которых хирургическое лечение является основным и из-за высокого риска рекомендуется адъювантная терапия [2]. Пациентов с редкими формами меланомы (меланома глаза – один случай, акральная меланома – один случай, меланома слизистых оболочек – четыре случая) было немного, поэтому отдельный анализ результатов для них не проводился.
Мы оценивали показатели общей выживаемости (ОВ) – время от хирургического лечения до смерти по любой причине и выживаемость без прогрессирования (ВБП) – время от хирургического вмешательства до появления первых симптомов прогрессирования опухолевого процесса. Определялись как медианы, так и статические показатели выживаемости.
Медиана времени наблюдения составила 25,7 месяца (от одного до 210 месяцев). 52 (15,2%) пациента к моменту анализа были потеряны для наблюдения, 138 (38,8%) цензурированы по ОВ, 51 (14,3%) – по ВБП.
Мы использовали метод Каплана – Майера и метод пропорциональных рисков Кокса, а также таблицы дожития для анализа ОВ. Анализ выполнен в программе SPSS v19.
Результаты
Показатели ОВ и ВБП у больных меланомой, получавших адъювантную терапию, представлены в табл. 2 и на рис. 1А и 2А.
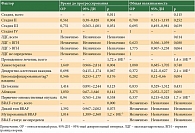
В общей когорте больных ВБП достигла 5,4 месяца, ОВ – 34,1 месяца. Эффективность адъювантной иммунотерапии, представленной в нашем исследовании вакцинами и интерфероном (ИФН) альфа, превосходила только хирургическое лечение. Физические методы воздействия на очаги, представленные только стереотаксической лучевой терапией или фотодинамической терапией при олигометастатическом процессе, показывали наихудшие результаты, что может быть связано с применением этих методик у больных преимущественно с IV стадией заболевания. Чтобы оценить влияние других прогностических факторов и вклад того или иного метода лечения в развитие эффекта, мы построили модели прогнозирования ОВ и ВБП методом пропорциональных рисков Кокса (табл. 3, рис. 1Б и 2Б).
Лекарственное лечение было значимым фактором прогноза как ОВ, так и ВБП. Иммунотерапия с использованием противоопухолевых вакцин оказалась наиболее эффективным подходом, способствовавшим увеличению как ВБП, так и ОВ, независимо от прочих прогностических факторов. При этом статистической значимости эффект достиг только при учете ОВ, что свидетельствует о возможном взаимодействии такой иммунотерапии с последующим лечением. Наличие мутации в гене BRAF увеличило вероятность прогрессирования процесса (относительный риск (ОР) 1,84), но не оказало влияния на риск смерти. Дальнейшее изучение роли данного фактора требует анализа пациентов, получавших анти-BRAF-терапию, которые не вошли в наше исследование.
Интересно, что уровень лактатдегидрогеназы (ЛДГ) характеризовался прогностической значимостью только при оценке ОВ. Стадия процесса, как и ожидалось, стала важным прогностическим фактором при оценке как ВБП, так и ОВ. В ходе исследования выявлено значительное позитивное прогностическое значение первично-множественного характера опухоли. При этом данный фактор не влиял на ВБП.
Обсуждение
При выполнении многофакторного анализа важными прогностическими факторами помимо системной терапии стали стадия заболевания, уровень ЛДГ (только для ВБП) и первично-множественный характер опухоли. Первые два фактора считаются общепризнанными для меланомы кожи [4]. Необычным оказался лишь факт меньшей значимости уровня ЛДГ, что, возможно, отражает значительную долю пациентов с II и III стадией заболевания, у которых данный показатель часто не определялся и имеет меньшее прогностическое значение. Положительная роль первично-множественного характера опухоли в исследовании, напротив, противоречит некоторым литературным данным. Так, в исследовании C.J. Rowe и соавт. [5] показана негативная роль первично-множественного характера опухоли только при отсчете от последнего выявленного первичного очага при анализе меланомы I и II стадий. Причины такого явления и значимость подобного наблюдения для дальнейших исследований требуют дополнительного изучения.
Нам не удалось выявить публикаций, в которых описывалась бы эффективность адъювантной терапии после ранее проведенного системного лечения. Поэтому разделить вклад предлеченности, отсутствия строгого отбора больных и селекционное смещение, обусловленное одноцентровым характером исследования, не представляется возможным. Тем не менее мы сопоставили наши данные с результатами исследований в области адъювантной терапии меланомы.
В нашем исследовании хирургическое лечение использовалось в качестве референсного метода, поскольку больным не проводилась адъювантная терапия после полной циторедукции. Полученные нами данные оказались хуже, чем полученные в исследовании COMBI-AD [6], в котором у 56% пациентов с III стадией не наблюдалось прогрессирование в течение года, а у 46% – в течение трех лет. Аналогичные результаты продемонстрировало исследование KeyNote-054 [7]: одногодичная ВБП достигла 61% (95%-ный доверительный интервал (ДИ) 56,5–65,1).
В более ранних исследованиях одногодичная ВБП при использовании хирургического лечения или терапии ИФН в любых дозах составила около 60% [8], что также превышает полученные нами результаты. Вероятно, такие результаты отражают снижение эффективности последующих этапов локального лечения в сочетании с методами системной терапии или без них. Включение 38,2% пациентов c IV стадией заболевания вряд ли оказывало существенный эффект на снижение показателей ОВ и ВБП. Так, в исследовании IMMUNED [9], участники которого получали адъювантную терапию по поводу меланомы кожи IV стадии, ВБП при хирургическом лечении достигла 32%, трехлетняя – 14%. Подобное снижение либо соответствует условиям реальной клинической практики, либо объяснятся предлеченностью пациентов.
J.C. Mozer и соавт. [10] сравнивали результаты применения современных методов терапии в клинических исследованиях с результатами лечения пациентов вне клинических исследований. Показано снижение медианы ОВ на десять месяцев на фоне применения ингибиторов BRAF в первой линии терапии по сравнению с данными регистрационного исследования. Каждый из этих факторов должен учитываться при интерпретации результатов нашего исследования.
При оценке относительных рисков наступления прогрессирования или смерти в нашем исследовании установлено, что адъювантная химиотерапия статистически значимо увеличивает риск наступления этого события. При анализе данных литературы нами не выявлено исследований, в которых были бы получены подобные результаты. Напротив, в исследованиях Н.Н. Трапезникова и соавт. [11] увеличение ОВ наблюдалось у больных, получавших химиотерапию.
В исследовании E.F. McClay и соавт. [12] отмечалось увеличение ВБП, но не ОВ на фоне адъювантной терапии меланомы.
В более поздних исследованиях [13, 14] преимущества применения химиотерапии в адъювантном режиме не зафиксированы.
Сегодня проведение адъювантной химиотерапии, в соответствии с утвержденными Минздравом России клиническими рекомендациями, запрещено [2]. Таким образом, наше исследование подтверждает возможное ухудшение результатов лечения больных меланомой с применением адъювантной химиотерапии и обеспечивает дополнительную доказательную базу для существующих клинических рекомендаций.
Адъювантная терапия с применением цитокинов, прежде всего ИФН-альфа, не влияла на показатели ОВ и ВБП. В настоящее время роль ИФН как средства адъювантной терапии все чаще подвергается сомнению. В крупном метаанализе рандомизированных исследований с использованием ИФН-альфа эффект наблюдался лишь у больных с изъязвлением первичной опухоли [15]. ОР прогрессирования при этом снижался на 14%, ОР смерти – на 10%. При выполнении многофакторного анализа мы наблюдали тренд к повышению риска смерти на фоне снижения риска прогрессирования заболевания, которые, однако, были статистически незначимы. Подобные результаты позволяют предположить, что адъювантная терапия ИФН-альфа, назначаемая после ранее проведенного системного лечения, неэффективна.
При выполнении многофакторного анализа в нашем исследовании выявлено увеличение ВБП и снижение риска прогрессирования при применении геномодифицированной tag7 вакцины (Tag7) (ОР 0,282; 95% ДИ 0,12–0,627) и дендритно-клеточной вакцины (ДКВ) (ОР 0,372; 95% ДИ 0,22–0,627). Полученные результаты не транслировались в статистически значимое снижение ОВ, хотя очевидный тренд в этом направлении наблюдался. Возможной причиной стал небольшой объем выборки, отражающий post-hoc-характер данного анализа. Необходимо отметить, что ОР прогрессирования процесса в случае Tag7 и ДКВ был менее 0,77. Согласно данным, полученным S.C. Suciu и соавт. [16], подобный уровень эффекта при адъювантной терапии позволяет рассчитывать на увеличение ОВ. Еще одним важным фактором подобного результата является отсроченный характер эффекта. Так, от 37 до 45% пациентов в нашем исследовании, получавших вакцины, не нуждались в продолжении лекарственного лечения, у них не отмечалось прогрессирования заболевания после трех лет наблюдения. Результаты такого плато после трех лет отмечались и в более ранних исследованиях интерлейкина 2 [17] и ипилимумаба [18]. Таким образом, можно предположить наличие стойкого и отсроченного эффекта терапии вакцин, что делает рациональным их дальнейшее изучение с поиском биомаркеров эффективности и разработкой комбинированных подходов. Последнее подтверждается данными ряда исследований [19, 20], в которых предшествующая терапия ДКВ значительно влияла на эффективность последующего лечения.
Мы сравнили результаты нашего исследования с данными исследования CheckMate 238 [21], в котором изучали эффективность адъювантной терапии ниволумабом и ипилимумабом, и результатами упоминавшегося исследования IMMUNED [9]. Одногодичная ВБП при использовании вакцин была сопоставима с таковой при монотерапии ипилимумабом или ниволумабом. Результаты, полученные при комбинированной терапии анти-PD1 и анти-CTLA-4, выходили за пределы доверительных интервалов статических показателей ВБП в нашем исследовании и превышали результаты применения вакцин.
Полученные в нашем исследовании низкие показатели ОВ и ВБП при использовании методов физической абляции обусловлены прежде всего значительной долей стереотаксической лучевой терапии, проводимой при наиболее неблагоприятном прогнозе – стадии заболевания M1d. Кроме того, применение стереотаксической радиохирургии без последующего системного лечения является менее эффективным подходом к терапии, что показал метаанализ рандомизированных исследований [22].
Заключение
Повторное адъювантное лечение после ранее проведенной системной терапии позволяет влиять как на показатели ОВ, так и на показатели ВБП. Показатели эффективности лечения при этом могут быть снижены.
Для оценки возможностей отдельных видов лекарственной терапии на втором и последующем этапах системного лечения необходимо проведение клинических исследований. При их планировании можно ориентироваться на обобщенные результаты лечения пациентов: медиану ВБП 6,6 месяца, одногодичную ВБП 23,3%, трехлетнюю ВБП 17,3% и пятилетнюю ВБП 14,9%. В нашем исследовании оцененные иммунотерапевтические режимы оказались наиболее перспективными методами при необходимости повторного проведения адъювантной терапии у больных, ранее получавших системное лечение. Целесообразным представляется использование данного подхода совместно с другими современными методами иммунотерапии.
A.V. Novik, PhD, A.A. Shulyateva, A.I. Semyonova, PhD, T.L. Nekhayeva, PhD, N.P. Pipia, PhD, Ye.V. Yaremenko, N.A. Avdonkina, A.B. Danilova, PhD, G.M. Teletayeva, PhD, D.Kh. Latipova, A.Yu. Zozulya, S.A. Protsenko, PhD, Prof., I.A. Balduyeva, PhD
N.N. Petrov National Medical Research Center of Oncology
Saint-Petersburg State Pediatric Medical University
Contact person: Alexey V. Novik, anovik@list.ru
Introduction. Local progression is a frequent clinical case in melanoma. We conducted an observational single-center study to assess the efficacy of the adjuvant therapy in melanoma patients previously treated with systemic drug therapy.
Material and methods. We have included 356 patients (48.6% – men, 51.4% – women) treated in N.N. Petrov National Medical Research Center of Oncology from 1988 to 2019. Among them, 12.4% had stage II, 49.4% – stage III, 38.2% – stage IV. Patient received surgery (49.2%), chemotherapy (7.9%), dendritic cell vaccine (DCV, 14.9%), modified with tag-7 gene autologous tumor cells vaccine (Tag7, 4.8%), cytokines (12.6%), and physical ablation methods (PA: stereotactic radiosurgery or photodynamic therapy – 10.7%). Overall survival (OS) and time to progression (TTP) were assessed.
Results. Median OS in overall population was 34.1 months (95% CI 21.6–42.5), median TTP – 5.4 months (95% CI 4.2–6.6). Significant prognostic factors included stage (р = 0.11 for OS, р = 0.115 for TTP), LDH level (р = 0.014 for OS, > 0.1 for TTP), presence of primary multiple tumor (р = 1.72 × 10Е-5 for TTP, 1.4 × 10E-10 for OS), and treatment given (р = 1.72 × 10Е-5 for TTP, 1.4 × 10E-10 for OS). Vaccines were the most effective approach. Median OS for DCV was 91.3 months, Tag7 – not reached; 1-year OS – 85 и 74%, respectively. The plato was reached after one year for patients receiving Tag7 at 45% level and after 3 years at 37% for DCV. HR for disease progression in DCV group was 0.372 (95% CI 0.22–0.627), in Tag7 HR 0.282 (95% CI 0.12–0.66). HR for death was 0,698 (p = 0.067) in DCV patients, HR 0.546 (p = 0.176) in Tag7 group. PA approach was less effective and increased HR for progression to 3.275 (р < 0.001), and risk of death to 1.05 (р = 0.141).
Conclusion. Adjuvant therapy can improve OS and TTP in melanoma patients previously treated with systemic drug therapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.