Тридцатилетний опыт лекарственного лечения меланомы в НМИЦ онкологии им. Н.Н. Петрова: важные уроки для будущих исследований
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Выполнен пулированный персонифицированный анализ больных меланомой, участвовавших в исследованиях, проведенных в Национальном медицинском исследовательском центре онкологии им. Н.Н. Петрова. Проанализированы методы адъювантной (n = 606) и паллиативной (n = 769) лекарственной терапии, которые назначались больным в различных учреждениях с 1988 г.
Результаты. При проведении адъювантной терапии меланомы применение противоопухолевых вакцин оказалось эффективной стратегической опцией, продемонстрировавшей преимущества по выживаемости без прогрессирования (ВБП) и общей выживаемости (ОВ) (р < 0,01). Химиотерапия в адъювантном режиме (вопреки рекомендациям) способствовала увеличению относительного риска (ОР) прогрессирования до 2,15 (p < 0,01) и ОР смерти до 1,47 (p = 0,07).
При паллиативном лечении применение таргетных препаратов, анти-PD-1 или анти-CTLA4, позволило улучшить ОВ и ВБП. Анти-PD-1-препараты оказались наиболее эффективными.
В многофакторных моделях комбинированный характер лечения, стадия заболевания по TNM, уровень лактатдегидрогеназы служили независимыми факторами прогноза при любых показаниях к системной лекарственной терапии. При паллиативной терапии важным оказался учет механизма иммунологического действия препаратов (p для модели = 1,3× 10-10). Выявлено благоприятное прогностическое значение первично-множественного характера опухоли при всех показаниях к системному лечению. Отмечался тренд к улучшению ОВ у пациентов с редкими локализациями меланомы в отдельных моделях (ОР 0,863; p = 1,4 × 10-7).
Выводы. Системное противоопухолевое лечение является важным фактором прогноза ОВ и ВБП при меланоме. Необходимо учитывать стадию заболевания, характер опухоли, механизмы иммунологического воздействия лечения, пол пациента, предшествующую терапию при планировании будущих исследований.
Материал и методы. Выполнен пулированный персонифицированный анализ больных меланомой, участвовавших в исследованиях, проведенных в Национальном медицинском исследовательском центре онкологии им. Н.Н. Петрова. Проанализированы методы адъювантной (n = 606) и паллиативной (n = 769) лекарственной терапии, которые назначались больным в различных учреждениях с 1988 г.
Результаты. При проведении адъювантной терапии меланомы применение противоопухолевых вакцин оказалось эффективной стратегической опцией, продемонстрировавшей преимущества по выживаемости без прогрессирования (ВБП) и общей выживаемости (ОВ) (р < 0,01). Химиотерапия в адъювантном режиме (вопреки рекомендациям) способствовала увеличению относительного риска (ОР) прогрессирования до 2,15 (p < 0,01) и ОР смерти до 1,47 (p = 0,07).
При паллиативном лечении применение таргетных препаратов, анти-PD-1 или анти-CTLA4, позволило улучшить ОВ и ВБП. Анти-PD-1-препараты оказались наиболее эффективными.
В многофакторных моделях комбинированный характер лечения, стадия заболевания по TNM, уровень лактатдегидрогеназы служили независимыми факторами прогноза при любых показаниях к системной лекарственной терапии. При паллиативной терапии важным оказался учет механизма иммунологического действия препаратов (p для модели = 1,3× 10-10). Выявлено благоприятное прогностическое значение первично-множественного характера опухоли при всех показаниях к системному лечению. Отмечался тренд к улучшению ОВ у пациентов с редкими локализациями меланомы в отдельных моделях (ОР 0,863; p = 1,4 × 10-7).
Выводы. Системное противоопухолевое лечение является важным фактором прогноза ОВ и ВБП при меланоме. Необходимо учитывать стадию заболевания, характер опухоли, механизмы иммунологического воздействия лечения, пол пациента, предшествующую терапию при планировании будущих исследований.



Введение
За последнее десятилетие лекарственная терапия меланомы претерпела существенные изменения. Появилось множество новых терапевтических опций, позволяющих положительно влиять на судьбу больного. Ингибиторы BRAF, PD-1, CTLA-4 практически вытеснили все остальные варианты терапии. Вместе с тем возникла проблема выбора оптимальных режимов лечения и последовательности их применения. Сегодня принятие решений базируется на данных рандомизированных исследований, проведенных среди отобранных категорий больных. Эти пациенты представляют лишь незначительную часть больных, которые часто встречаются в реальной клинической практике. В проспективных исследованиях редко анализируется предшествующая терапия, способная повлиять на результат текущего лечения. Кроме того, указанные методы, несмотря на высокую эффективность, не позволяют вылечить значительную часть пациентов. Это требует разработки новых терапевтических подходов. Мы попытались частично восполнить недостающую информацию и провели пулированный анализ эффективности всех этапов лекарственной терапии у больных меланомой, принимавших участие в научно-исследовательских работах (НИР), проведенных в Национальном медицинском исследовательском центре (НМИЦ) онкологии им. Н.Н. Петрова (исследование РЕПРИЗА).
Материал и методы
В исследование РЕПРИЗА были включены пациенты старше 18 лет с морфологически верифицированным диагнозом меланомы, получавшие терапию с 1988 г. по настоящее время в НМИЦ онкологии им. Н.Н. Петрова и других учреждениях после подписания информированного согласия. Мы обобщили результаты нескольких НИР, одобренных этическим комитетом НМИЦ онкологии им. Н.Н. Петрова. Первичной конечной точкой исследования являлась оценка общей выживаемости (ОВ), вторичными – оценка выживаемости без прогрессирования (ВБП) и частоты объективного ответа (ОО). Проведен анализ пациентов, получавших:
- ингибиторы BRAF (вемурафениб и дабрафениб в монотерапии или сочетании с кобиметинибом или траметинибом соответственно);
- химиотерапию (с включением дакарбазина, препаратов платины, паклитаксела, производных нитрозомочевины в монотерапии или комбинациях);
- противоопухолевые вакцины (немодифицированные инактивированные аутологичные опухолевые клетки, геномодифицированные геном tag7 аутологичные опухолевые клетки, дендритно-клеточные вакцины);
- анти-CTLA-4-препараты (ипилимумаб, тремилимумаб);
- анти-PD1 (ниволумаб, пембролизумаб);
- цитокины (интерферон альфа, интерлейкин 2, фактор некроза опухоли – тимозин альфа в монотерапии или сочетании с химиотерапией – химиоиммунотерапия);
- стереотаксическую лучевую терапию;
- фотодинамическую терапию;
- хирургическое лечение (без системного противоопухолевого лечения).
Проанализированы все этапы лечения больных независимо от выбранного нами лечения в том или ином исследовании. В данной работе допускалось повторное включение пациентов, получавших разные виды лечения (одно включение на каждый из видов лечения). Характеристика больных, включенных в исследование, представлена в табл. 1.
В анализ вошли все этапы лечения пациентов с меланомой. Большая часть этих этапов проводилась в условиях реальной клинической практики в региональных онкологических учреждениях.
В ходе исследования проанализированы ОО по системе RECIST 1.1, ВБП и ОВ от начала соответствующего лечения. Проведена независимая оценка эффективности терапии на основании медицинских данных, имеющихся в НМИЦ онкологии им. Н.Н. Петрова. Медианы ВБП и ОВ и их доверительные интервалы определяли методом Каплана – Майера. При сравнении методов лечения и установлении важных прогностических параметров использовали метод пропорциональных рисков Кокса. В прогностические модели Кокса переменные добавлялись при p < 0,05, исключались из модели при p > 0,1. Расчеты осуществлялись с помощью программы SPSS v19.
Эффективность адъювантной терапии меланомы
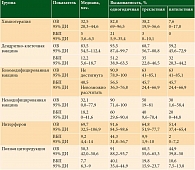
У включенных в исследование больных проанализированы все методы адъювантной терапии, фактически применявшиеся до 2017 г. в клинической практике, независимо от корректности проведения и наличия показаний к применению. Современные препараты (таргетная терапия, анти-PD1-препараты) не были зарегистрированы в указанный период для адъювантной терапии. Показатели ОВ и ВБП у больных меланомой, получавших адъювантную терапию, представлены в табл. 2.
Как видим, эффективность адъювантной лекарственной терапии существенно отличалась в зависимости от вида проведенного лечения (Log-rank p = 8 × 10-5). При этом наихудшие результаты были достигнуты на фоне адъювантной химиотерапии (ХТ), то есть при нарушении рекомендаций [1]. Наилучшие результаты наблюдались при использовании вакцины на основе аутологичных опухолевых клеток, геномодифицированных геном tag7. Медиана ОВ не была достигнута. Работа по изучению этих вакцин проводилась совместно со специалистами Института биологии гена РАН под руководством акад. Г.П. Георгиева. Функции дожития представлены на рис. 1.
При построении модели пропорциональных рисков Кокса важными факторами для прогнозирования ОВ были стадия заболевания, наличие первично-множественной опухоли и проведенное лечение. Относительный риск (ОР) смерти снижался на 69,6, 55,3 и 40% при I, II, III стадиях заболевания соответственно по сравнению с IV стадией (p = 1,9 × 10-8). ХТ в адъювантном режиме имела негативное прогностическое значение и ассоциировалась с повышением риска смерти на 47% (95%-ный доверительный интервал (ДИ) 0,969–2,23; p = 0,07) по сравнению с хирургическим лечением. Применение в нашем исследовании интерферона (ИФН) альфа, равно как и немодифицированных вакцин (НМВ), не влияло на риск смерти (p = 0,834 и p = 0,194 соответственно). При использовании дендритно-клеточной вакцины (ДКВ) собственного производства значимо снижался риск смерти на 49,1% (95% ДИ 22–66,7; p = 0,006). Еще более активным вариантом лечения оказалась геномодифицированная вакцина (ГМВ), продемонстрировавшая снижение риска смерти на 76,9% (95% ДИ 50,2–89,2; p = 1,9 × 10-4). Изъязвление первичной опухоли не являлось значимым прогностическим фактором в проведенных исследованиях. В ходе однофакторного анализа пол, уровень лактатдегидрогеназы (ЛДГ), количество методов и способов лечения на одном этапе и использование методов иммунотерапии были значимы на уровне p < 0,05, но их включение в прогностическую модель не приводило к ее улучшению. Учет вида предшествующего лечения, характера иммунологического действия, проведенных ранее лечебных процедур не повлиял на улучшение прогностической модели. Частично причиной этого было малое количество пациентов, получавших конкретные виды предшествующего лечения до проведения адъювантной терапии или хирургического вмешательства. Нами не выявлено ухудшение выживаемости у пациентов с редкими формами меланомы (меланома слизистых, увеальная меланома, акральная меланома, подногтевая меланома), возможно из-за относительно малого количества пациентов.
Кривые ВБП представлены на рис. 2. Анализ ВБП показал схожие результаты с анализом ОВ. Прогностическими факторами помимо стадии заболевания (ОР прогрессирования 0,268 (95% ДИ 0,176–0,407); ОР 0,472 (95% ДИ 0,362–0,617) и ОР 0,767 (95% ДИ 0,588–1,001) при I, II, III стадиях заболевания соответственно по сравнению с IV стадией; p = 1,4 × 10-12) служили уровень ЛДГ, вид лекарственного лечения и количество примененных методов лечебного воздействия. При уровне ЛДГ ниже верхней границы нормы риск прогрессирования составил 0,613 (95% ДИ 0,385–0,977). У больных, получавших адъювантную ХТ, риск прогрессирования в 2,15 раза превысил (95% ДИ 1,358–3,408) таковой при хирургическом лечении. ИФН и НМВ не имели статистически значимого влияния на показатели ВБП (p > 0,1). Терапия ДКВ с учетом прочих значимых прогностических факторов не позволяла добиться снижения риска прогрессирования до 0,665 (95% ДИ 0,433–1,021). Однако уровень значимости составил 0,062. ГМВ показала наилучшие показатели ВБП: риск прогрессирования уменьшился до 0,379 (95% ДИ 0,198–0,727; p = 0,004). При использовании комбинированного подхода (лекарственная терапия и различные методы локального лечения) риск прогрессирования снижался на 38,7% (95% ДИ 22,9–51,8%) с каждым добавленным методом терапии.
В нашем исследовании хирургическое лечение использовалось в качестве референсного метода, поскольку у больных этой группы не проводилась адъювантная терапия после полной циторедукции. Полученные нами результаты оказались хуже, чем в исследовании COMBI-AD [2], в котором у 56% пациентов с III стадией заболевания не наблюдалось прогрессирование в течение года, а у 46% – в течение трех лет. Сходные результаты были получены в исследовании KEYNOTE-054 [3], в котором показатели одногодичной ВБП составили 61% (95% ДИ 56,5–65,1). В более ранних исследованиях данный показатель на фоне хирургического лечения или терапии ИФН в любых дозах составил около 60% [4], что также превышает наши результаты.
Мы предположили, что причиной подобных расхождений может быть включение значительного количества ранее «предлеченных» больных в настоящее исследование. В связи с этим был проведен поданализ пациентов, не получавших ранее системного лечения. Однако после поданализа данные не претерпели существенных изменений и не отличались от данных по всей когорте больных, включенных в исследование (данные не представлены).
На наш взгляд, причиной снижения показателей выживаемости могло быть включение в исследование значительной доли пациентов с IV стадией заболевания. Для этого мы сопоставили наши результаты с данными исследования IMMUNED [5], в котором участвовали больные с отдаленными метастазами после выполнения полной циторедукции. В первом исследовании одногодичная ВБП при хирургическом лечении составила 32%, трехлетняя – 14%. Трехлетние результаты наблюдения соответствовали нашим результатам, тогда как показатели одногодичной ВБП были несколько ниже. Такое снижение может соответствовать условиям реальной клинической практики.
В исследование Е4697 [6] также были включены пациенты с IV стадией заболевания. Показатель медианы ОВ не отличался от показателя, полученного нами, но показатели пятилетней ОВ в нашем исследовании оказались ниже. Таким образом, оцениваемая когорта больных в исследовании РЕПРИЗА по своим характеристикам в большей степени соответствует группе пациентов с меланомой крайне высокого риска.
Несмотря на рекомендации последних 20 лет, в рутинной практике продолжали проводить адъювантную ХТ. Ее эффект мы проанализировали в исследовании РЕПРИЗА. При оценке ОР наступления прогрессирования или смерти было установлено, что ХТ статистически значимо увеличивает риск наступления этого события. При анализе литературы мы не выявили публикаций с подобными результатами. Напротив, в исследованиях Н.Н. Трапезникова и соавт. [7] показано увеличение ОВ больных, получавших ХТ. В исследованиях E.F. McClay и соавт. [8] продемонстрировано увеличение ВБП, но не ОВ на фоне адъювантной терапии пациентов с меланомой. В более поздних исследованиях [9, 10] также не показана польза от применения ХТ в адъювантном режиме. В настоящее время в практических руководствах по лекарственному лечению меланомы проведение адъювантной ХТ не рекомендуется [1].
Таким образом, результаты нашего исследования впервые подтверждают возможное ухудшение результатов лечения больных меланомой на фоне ХТ и обеспечивают дополнительную доказательную базу для существующих клинических рекомендаций.
В исследовании РЕПРИЗА не показана прогностическая значимость применения адъювантной терапии ИФН или НМВ. Полученные результаты согласуются с данными крупного метаанализа адъювантной терапии ИФН [11], в котором статистически значимые преимущества в ОВ достигнуты лишь у больных с изъязвлением первичной опухоли. Однако в нашем исследовании данный фактор не имел прогностической значимости. Тем не менее полученные результаты пятилетней выживаемости сопоставимы с результатами этого метаанализа, что подтверждает репрезентативность популяции больных, включенных в данное исследование. Адъювантная терапия НМВ не показала очевидных преимуществ в нескольких крупных рандомизированных исследованиях [10, 12], что соответствует нашим данным.
Результаты исследования свидетельствуют об увеличении ОВ и ВБП при использовании ГМВ и ДКВ. При построении модели пропорциональных рисков Кокса ДКВ влияла только на ОВ, воздействие на ВБП было статистически незначимо. Можно предположить, что ДКВ повышает эффективность последующего лечения, как показано в ряде исследований [13, 14]. Отметим, что ОР прогрессирования опухолевого процесса в случае ГМВ и ДКВ менее 0,77. По данным исследования S.C. Suciu и соавт. [15], подобный уровень эффекта при адъювантной терапии позволяет рассчитывать на увеличение ОВ. Это подтвердилось и в нашем исследовании.
Мы сравнили результаты настоящего исследования с данными исследования CheckMate 238 [16], в котором изучалась эффективность адъювантной терапии ниволумабом и ипилимумабом, и исследования IMMUNED [5]. Одногодичная ВБП при использовании противоопухолевых вакцин была сопоставима с таковой на фоне применения монотерапии ипилимумабом или ниволумабом. Результаты, полученные при комбинированной терапии анти-PD1 и анти-CTLA-4, выходили за пределы доверительных интервалов статистических показателей ВБП в нашем исследовании и превышали результаты на фоне применения противоопухолевых вакцин. Тем не менее при использовании ДКВ и ГМВ наблюдалось четкое формирование плато, что свидетельствует о стабильности эффекта, достигнутого после проведенного лечения.
Кроме того, нами выявлено значительное позитивное прогностическое значение первично-множественного характера опухоли. При этом данный фактор не влиял на ВБП. Прогностическая значимость подобного факта анализировалась в исследовании C.J. Rowe и соавт. [17], в котором проводился анализ меланом I и II стадии. Авторы показали негативную роль первично-множественного характера опухоли только при отсчете от последнего выявленного первичного очага.
Эффективность паллиативной терапии меланомы
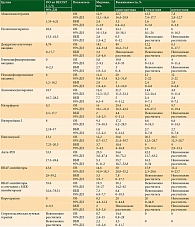
Мы проанализировали эффективность системной противоопухолевой терапии пациентов с неоперабельными формами меланомы. Показатели ОО, ОВ и ВБП у этих больных представлены в табл. 3. Как видим, современные методы терапии (анти-PD1-препараты, таргетная терапия, ипилимумаб) оказались наиболее эффективными стратегиями у данной категории пациентов. Лидирующую позицию занимают препараты, блокирующие белок PD-1. При этом полихимиотерапия, химиоиммунотерапия или применение ДКВ не улучшили результаты паллиативной терапии. При проведении многофакторного анализа в модели Кокса важными факторами прогноза ОВ были распространенность метастатического процесса (категории стадии М по TNM8, p = 9,6 × 10-7) и уровень ЛДГ (p = 3,9 × 10-12). Полученные данные соответствуют прогностическому значению клинических факторов, включенных в классификацию TNM [18]. Грубые показатели стадии также позволяли прогнозировать ОВ и ВБП (p < 0,05), но для лечебных режимов не добавляли информативности модели при учете стадии М.
Неопределенный статус мутации в гене BRAF статистически значимо повышал риск смерти пациентов, что, вероятно, отражает негативное влияние данной мутации в отсутствие ингибиторов BRAF, о чем сообщалось ранее [19]. Среди клинических факторов положительное влияние на ОВ оказывал первично-множественный характер опухоли (ОР 0,222; p = 1,8 × 10-4). Количество линий предшествующего системного лечения или проведение лечения при редких типах меланомы были прогностическими только в моделях, не учитывавших конкретный вид проведенной терапии, что свидетельствует о взаимосвязи этих параметров. Тем не менее риск смерти увеличивался на 5,8% с каждой новой линией системного лечения. Неожиданным оказался тот факт, что больные с редкими локализациями меланом (меланома слизистых, увеальная меланома, акральная меланома, подногтевая меланома) характеризовались несколько лучшей ОВ в модели, не учитывавшей конкретных видов проведенного лечения (ОР 0,863; р = 1,4 × 10-7). Данные литературы указывают на худший прогноз при меланоме слизистых [20]. Эффективность большинства терапевтических опций при метастатической увеальной меланоме остается низкой [21], что также позволяет относить ее к факторам неблагоприятного прогноза.
В нашем исследовании РЕПРИЗА современные методы терапии (ингибиторы BRAF, анти-PD1, анти-CTLA4) статистически значимо снижали риск прогрессирования и смерти. ОР прогрессирования при использовании анти-PD1-препаратов по сравнению с монохимиотерапией составил 0,351 (95% ДИ 0,215–0,513), на фоне применения ипилимумаба – 0,481 (95% ДИ 0,367–0,573), монотерапии ингибиторами BRAF – 0,436 (95% ДИ 0,299–0,636), комбинированной таргетной терапии – 0,389 (95% ДИ 0,231–0,655). Степень влияния на ОВ указанных методов лечения была ниже и лишь для ипилимумаба и вемурафениба достигла определенного в настоящем исследовании уровня статистической значимости (ОР 0,718 и 0,634 соответственно). При этом суммарный учет характера иммунологического воздействия данных методов позволил выявить выраженное влияние современных методов лечения на ОВ. При использовании методов с вторичной активацией иммунной системы (преимущественно представленных терапией с включением ингибиторов BRAF) ОР смерти составил 0,716 (95% ДИ 0,571–0,899), тогда как для модуляторов иммунного синапса – 0,684 (95% ДИ 0,535–0,874).
Полученные результаты совпали с результатами проведенного в 2018 г. сетевого метаанализа рандомизированных исследований [22], который показал преимущества модуляторов иммунного синапса и таргетной терапии перед ХТ и отсутствие преимуществ химиоиммунотерапии или полихимиотерапии.
Нумерически параметры эффективности лечения в исследовании РЕПРИЗА были хуже таковых в регистрационных исследованиях ингибиторов BRAF [23]. Однако при сравнении с данными из реальной клинической практики [24] получены сопоставимые результаты, что подтверждает существенное селекционное смещение, обусловленное строгими критериями отбора пациентов в клинические исследования. Для анти-PD-1 полученные нами результаты превосходили параметры эффективности монотерапии ниволумабом во второй и последующих линиях лекарственного лечения [25] и были сопоставимы с таковыми при использовании анти-PD1-терапии первой линии, что, вероятно, отражает более раннее применение данных препаратов у этой когорты больных. Эффективность ипилимумаба в настоящем исследовании была несколько ниже, чем в исследовании J. Schachter и соавт. [26], тем не менее соответствовала таковой в исследовании P.A. Ascierto и соавт. [27].
Некоторые виды лечения в построенных нами моделях прогнозирования ОВ и ВБП оказывали противоречивое влияние на риск наступления соответствующих событий. Так, стереотаксическая лучевая терапия при ее выделении как отдельного и самостоятельного метода без сопутствующей терапии показывала однозначный тренд к снижению риска прогрессирования и смерти по сравнению с ХТ примерно на 30–60% (в зависимости от выбора метода учета характеристик проведенного лечения), что, однако, не трансформировалось в преимущества по ОВ. Противоопухолевая вакцинотерапия продемонстрировала противоположный тренд в отношении ВБП и ОВ. Так, НМВ, равно как и ДКВ, значимо не влияли на изучаемые показатели и имели общий тренд к улучшению результатов терапии по сравнению с ХТ. ГМВ, напротив, ассоциировалась с повышением риска прогрессирования или смерти, достигавшего в отдельных моделях уровня статистической значимости p < 0,05. Причины такого противоречивого действия ГМВ, которая оказалась лучшим средством терапии при использовании в качестве метода адъювантного лечения, требуют отдельного изучения. Возможно, это обусловлено особенностями продукции опухолевыми клетками иммуносупрессирующих факторов, выявленными нами в ходе проводимых ранее НИР [28].
Исследование РЕПРИЗА продемонстрировало важность комбинированного подхода к лечению пациентов. Добавление каждого дополнительного метода лечения снижало риск прогрессирования на 48,2% (p = 6,6 × 10-12) и риск смерти на 29% (p = 1,6 × 10-4). Циторедуктивные вмешательства, не оказывающие, казалось бы, значимого и долгосрочного иммунологического действия, служили независимым фактором прогноза ОВ (ОР 0,564; 95% ДИ 0,468–0,679; p = 1,4 × 10-9), но не ВБП.
В ходе оценки прогностических факторов была проанализирована роль характеристик предшествующего и текущего лечения по видам оказываемого лекарственного воздействия и влиянию на иммунную систему. Именно последняя характеристика оказалась наиболее значимой. Предшествующее применение модуляторов иммунного синапса снижало риск прогрессирования до 0,78 (95% ДИ 0,619–0,983; p = 0,035), но не риск смерти в многофакторном анализе. Применение цитокинов в анамнезе улучшало показатели ОВ (ОР 0,757; 95% ДИ 0,637–0,900; p = 0,002), но не влияло на достижение эффекта от текущего лечения. Применение препаратов с выраженной иммуносупрессией (преимущественно полихимиотерапии) и методов с вторичной активацией иммунной системы (таргетной и фотодинамической терапии) в анамнезе негативно отражалось на показателях ОВ в моделях, учитывавших виды проведенного лечения (ОР 1,346 (95% ДИ 1,074–1,687) и ОР 1,542 (95% ДИ 1,209–1,967) соответственно). Использование методов устранения иммуносупрессивных факторов в анамнезе снижало показатели как ВБП (ОР 1,750; 95% ДИ 1,148–2,668), так и ОВ (ОР 2,264; 95% ДИ 1,415–3,621). Между тем такие результаты могут быть обусловлены применением негативных факторов прогноза в более ранние периоды, то есть в отсутствие эффективных методов лечения и, как правило, после проведения не одного этапа стандартной терапии. Это могло вызвать смещение ОР, выявленного в исследовании РЕПРИЗА.
В проведенном нами исследовании наблюдались благоприятное прогностическое значение предшествующей анти-РD-1-терапии и негативное влияние предшествующей таргетной терапии. Подобные результаты противоречат выводам D.B. Johnson и соавт. [29] о большей эффективности комбинированной терапии BRAF-ингибиторами в первой линии лечения. Вместе с тем более поздние исследования и мнения экспертного сообщества подтверждают приоритет применения модуляторов иммунного синапса в начале лечения [24].
При учете исключительно механизмов противоопухолевого действия без спецификации конкретного метода лечения нами выявлено негативное прогностическое значение мужского пола при оценке ОВ (ОР 1,222; 95% ДИ 1,08–1,382). Данный фактор не улучшил модель прогнозирования при учете конкретных методов лечения, что позволило сделать вывод о взаимосвязи между полом и отдельными методами, прежде всего иммунотерапии. Такие выводы подтверждаются результатами метаанализа рандомизированных исследований, проведенного F. Conforti и соавт. [30]. Показано, что у женщин ответ на модуляторы иммунного синапса меньше, чем у мужчин. В более ранних исследованиях, основанных исключительно на результатах применения химиотерапии и/или цитокинов, женский пол являлся фактором, влиявшим на ВБП, но не на ОВ [31]. Отметим, что влияние пола выявлялось нами только при совместном учете методов лечения на основании механизма действия и типа применяемого лечения. Это позволяет предположить связь данного фактора именно с иммунологическими характеристиками лечения и требует учета в последующей части нашего исследования.
При учете методов иммунологического действия также выявлен ряд дополнительных факторов, отражающих роль сочетанного использования разных подходов к лечению. Собственно количество использованных методов служило благоприятным фактором: снижение риска смерти варьировалось от 10 до 30% (в зависимости от используемых факторов). Фотодинамическая терапия негативно влияла на ОВ (ОР 1,739; 95% ДИ 1,201–2,517), но не на ВБП. Мы уже упоминали роль модуляторов иммунного синапса и методов с вторичным иммуномодулирующим действием. Интересно, что циторедуктивные вмешательства оказывали значимый позитивный эффект на ОВ (ОР 0,564; 95% ДИ 0,468–0,679; p = 1,4 × 10-9), но не влияли на ВБП при анализе эффективности паллиативной лекарственной терапии у пациентов с меланомой. Применение противоопухолевых вакцин, напротив, имело тенденцию к снижению ВБП, однако подобное влияние не отражалось на показателях ОВ и было обусловлено, как уже упоминалось, включением в исследование значительной доли пациентов, не имевших возможности получать современную терапию. Применение адаптивной клеточной терапии, хотя и не достигло заданного в нашем исследовании уровня значимости, обеспечило наибольшее снижение ОР смерти (0,167).
Заключение
Тридцатилетний опыт применения терапевтических опций в реальной клинической практике свидетельствует о более низких результатах терапии по сравнению с результатами регистрационных исследований, что обусловлено включением в них более широкого круга больных меланомой. Системная противоопухолевая терапия является важным фактором прогноза ОВ и ВБП как при адъювантном, так и лечебном режиме у этой категории больных. При планировании будущих исследований важно учитывать не только стадию заболевания и пол пациентов, но также характеристики иммунологического воздействия проводимого лечения и предшествующую терапию.
A.V. Novik, PhD, S.A. Protsenko, PhD, Prof., Ye.М. Anokhina, А.I. Semyonova, PhD, T.L. Nekhayeva, PhD, G.М. Teletayeva, PhD, A.B. Danilova, PhD, D.Kh. Latipova, PhD, N.P. Pipia, N.А. Avdonkina, А.Yu. Zozulya, A.P. Oganesyan, I.A. Balduyeva, PhD
N.N. Petrov National Medical Research Center of Oncology
Saint-Petersburg State Pediatric Medical University
Contact person: Alexey V. Novik, anovik@list.ru
Purpose. We assessed the efficacy of melanoma drug therapy in the real-life setting in the past thirty years (REPRISE trial).
Material and methods. A pooled personalized analysis of melanoma patients included in different studies in N.N. Petrov National Medical Research Center of Oncology was performed. We assessed efficacy or the adjuvant (606 patients) or palliative (769 patients) therapy conducted in different centers since 1988.
Results. Vaccines appeared to be effective treatment strategy and showed a benefit for time to progression (TTP), and overall survival (OS) (р < 0.01). Adjuvant chemotherapy conducted despite of clinical recommendations increased hazard ratio (HR) for TTP up to 2.15 (р < 0.01) and HR for OS up to 1.47 (р = 0.07). Palliative anti-PD1, anti-CTLA4, and targeted therapy improved OS and TTP. Anti-PD1 therapy was the most effective approach. In multifactor analysis combination therapy, the TNM stage, LDH level were independent prognostic factors in all settings. Immune synapse modulators in previous treatment improved OS and TTP. Mechanism of immunologic action appeared to be important prognostic factor (р for entire model = 1.3 × 10-10). We have found the favorable meaning of the primary-multiple character of tumors in both adjuvant and metastatic settings. There was a trend to better OS for patients with rare localizations of melanoma in some models (HR 0.863, р = 1.4 × 10-7).
Conclusion. Systemic drug therapy is a significant independent factor for OS and TTP in the adjuvant and therapeutic setting. Not only stage but tumor type, immunologic mechanisms of action, previous treatment history and patient sex should be taken into account in the further trials.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.