Прогностическое и предиктивное значение Т-клеток памяти в периферической крови у больных неоперабельной или метастатической меланомой
- Аннотация
- Статья
- Ссылки
- English
Введение
Иммунотерапия является одним из ключевых элементов лечения меланомы. Значительные успехи в этом направлении были достигнуты благодаря разработке ингибиторов иммунного синапса – препаратов, блокирующих тормозное влияние на иммунную систему, препятствующее активации Т-клеток памяти и формированию из них эффекторных субпопуляций [1]. Данные методы оказались весьма эффективны. Однако существенная доля пациентов не отвечает на подобное лечение, и лишь в небольшом проценте случаев возможно излечение. Таким образом, очевидна необходимость поиска биомаркеров для персонализации лечения больных.
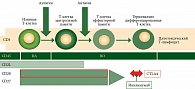
Т-клетки памяти представляют собой гетерогенную популяцию клеток, которые в своем развитии от наивных до эффекторных претерпевают ряд изменений [2]. На сегодняшний день существует несколько концепций и предположений развития этих клеток, но в целях данного исследования остановимся только на модели снижающегося потенциала (рис. 1).
Важно подчеркнуть, что именно на T-клетках памяти экспрессируется рецептор CD28, который конкурирует с рецептором CTLA4 за связывание с CD80 [3]. Данная связь служит сигналом второго типа в иммунном синапсе при встрече наивной Т-клетки или Т-клетки центральной памяти, способной к длительной персистенции и пролиферации, с антигеном и обеспечивает пролиферативный и антиапоптотический сигнал [2]. Напротив, активация CTLA4, имеющего большую аффинность к CD80, индуцирует апоптоз клеток и не приводит к их активации. Мы предположили, что уровень Т-клеток в периферической крови может быть маркером эффективности терапии и выживаемости больных меланомой. Для подтверждения выдвинутой нами гипотезы было проведено исследование.
Материал и методы
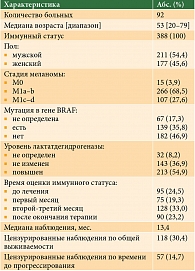
В исследование включены больные неоперабельной или метастатической меланомой, получавшие иммунотерапию ипилимумабом с 2012 по 2015 г. Основные критерии включения:
- подписание информированного согласия;
- возраст старше 18 лет;
- наличие морфологически подтвержденной неоперабельной или метастатической меланомы;
- отсутствие клинически значимых нарушений функции внутренних органов;
- отсутствие аутоиммунных заболеваний.
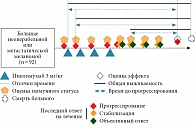
Характеристика пациентов представлена в табл. 1, схема исследования – на рис. 2. Для оценки иммунного статуса (ИС) измеряли содержание цитотоксических лимфоцитов (CTL, CD3+CD8+), наивных Т-лимфоцитов (Tn, CD3+CD45RA+CD62L+), центральных Т-клеток памяти (Tcm, CD3+CD45R0+CD62L+), клеток эффекторной памяти (Tem, CD3+CD45R0+CD62L-).
Для оценки связи показателя с эффектом лечения сравнивали частоту отдельных видов ответа по системе RECIST (прогрессирование заболевания, стабилизация заболевания, объективный ответ) у пациентов с наличием или отсутствием отклонений уровня анализируемых популяций клеток от референсных значений (при их наличии). Ответ определяли как последний результат оценки состояния опухоли перед оценкой ИС (грубая оценка) и в пределах двух недель от оценки ИС (точная оценка). Для сравнения распределений ответов использовали метод хи-квадрат и статистику отношения правдоподобия. Для оценки выживаемости были построены прогностические модели, включавшие демографические показатели (пол, возраст), характеристики времени лечения (до начала терапии, начало лечения, продолжение лечения, после лечения, время на терапии в месяцах), стадию (III против IV) и подстадию (M0 и M1a–b против M1c) процесса на момент начала терапии, наличие повышенного уровня лактатдегидрогеназы и мутаций в гене BRAF, меланомы слизистой оболочки или увеальной меланомы, первично-множественных опухолей, иммуноопосредованных нежелательных явлений, линию терапии, вид проведенного ранее лечения. Время до прогрессирования (ВДП) измерялось от времени оценки ИС (для ИС, исследуемых до начала терапии, – от времени начала лечения) до выявления первых признаков прогрессирования процесса. Общая выживаемость (ОВ) рассчитывалась от той же точки, что и ВДП, до смерти по любой причине. Для соблюдения предположений модели о независимости признаков из нее исключались переменные с высоким (> 0,7) уровнем корреляции регрессионных остатков. При построении модели изучаемые факторы добавлялись к известным методам условного включения. В дальнейшем была также построена модель, включавшая все изучаемые факторы. Размер эффекта определялся для всех случаев относительным риском (ОР). В нашем исследовании использовался уровень значимости p < 0,05.
Результаты
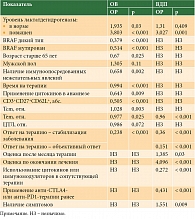
При оценке уровня наивных Тn до начала терапии не установлено связи с максимальным эффектом лечения (р >0,05). При анализе всех ИС обнаружено, что снижение данной субпопуляции лимфоцитов (как в абсолютных, так и в относительных значениях) чаще ассоциировалось с прогрессированием заболевания (ОР 1,236 и ОР 1,173, р = 0,003 и р = 0,006 соответственно). При более детальном рассмотрении динамики состояния опухоли у больных, получавших ипилимумаб, выявлена аналогичная тенденция (p = 0,024). При этом различия в частоте стабилизаций процесса достигали статистически значимого уровня (р < 0,05). Относительные уровни показателей также существенно влияли на частоту отдельных категорий динамики состояния опухоли. Бурное прогрессирование чаще регистрировалось при сниженном относительном значении наивных Т-лимфоцитов (p < 0,05). При анализе выживаемости связи уровня наивных Т-лимфоцитов как до лечения, так и в процессе терапии с ОВ и ВДП не зафиксировано (р > 0,05).
При анализе прогностической роли Tcm и Тem оказалось, что при повышении первых риск смерти увеличивается (ОР 1,02; р = 0,02), тогда как с ростом вторых уменьшается (ОР 0,401; р = 0,008). Относительный уровень Tem служил также прогностическим фактором при анализе ВДП (ОР 0,961; р = 10-5). При оценке уровней Т-клеток памяти до лечения связи с показателями выживаемости не обнаружено (р > 0,05).
Абсолютный уровень CD3+CD27+CD62L+ являлся благоприятным фактором прогноза ОВ (ОР 0,529, р = 0,001), тогда как относительный уровень CD3+CD28+CD62L+ лимфоцитов – неблагоприятным (ОР 1,012; р = 0,009). При этом данные показатели не влияли на риск прогрессирования заболевания (р > 0,05). Уровень CD3+CD27+CD62L+ и CD3+CD28+CD62L+ лимфоцитов до лечения не был связан с показателями ОВ и ВДП (p > 0,05).
Уровень CTLA4-лимфоцитов служил неблагоприятным фактором прогноза ВДП только при его оценке до начала терапии (ОР 1,045; р = 0,037).
При построении общей многофакторной модели, учитывавшей все анализируемые нами субпопуляции (табл. 2), оказалось, что с повышением уровня эффекторных субпопуляций у пациентов снижался риск прогрессирования заболевания и смерти, тогда как при накоплении клеток Tcm, наоборот, возрастал. Можно предположить, что сказанное свидетельствует о необходимости обеспечения успешной активации Т-лимфоцитов, достижение которой на фоне лечения транслируется в повышение продолжительности жизни пациентов.
Обсуждение
Наивные Т-клетки CD3+/CD45RA+/CD62L+ распознают чужеродные антигены, представленные в аспекте молекул главного комплекса гистосовместимости, циркулируют в периферических органах иммунной системы, Т-зависимых зонах вторичных лимфоидных органов и периферической крови, считаются «наивными» до контакта с антигенпрезентирующими клетками. Изучаемые клетки еще не приобрели эффекторные свойства, необходимые для реализации противоопухолевого иммунного ответа, и, по всей вероятности, именно поэтому полученные нами результаты по увеличению доли этих клеток у пациентов с прогрессированием заболевания позволяют нам рассматривать накопление в циркуляции Т-клеток, полностью лишенных эффекторных свойств, в качестве маркера неблагоприятного прогноза [2–5].
Интерес к популяции Т-лимфоцитов с иммунофенотипом «наивные» вызван исследованиями, в которых показано, что среди этой популяции могут быть «наивно-ревертантные» клетки. Считается, что первичная стимуляция Т-клеток запускает однонаправленную дифференцировку от наивных к эффекторным субпопуляциям и клеткам памяти. Вместе с тем G. Frumento и соавт. (2020) показали, что интерлейкин 7 может привести к фенотипической реверсии недавно дифференцированных CD8+ Т-клеток центральной и эффекторной памяти человека в наивный фенотип. Эти «наивно-ревертантные» клетки CD45RA+/CD62L+/CCR7+/CXCR3+ демонстрируют фенотип, аналогичный фенотипу ранее зарегистрированных популяций клеток памяти «стволовых клеток», они подвергаются быстрой дифференцировке и функциональному ответу после вторичной стимуляции [6].
Фенотипическая реверсия по крайней мере частично объясняет генерацию CD8+ Т-клеток памяти «стволовых клеток» и выявляет клетки в фенотипически наивном пуле CD8+ Т-клеток, которые эпигенетически настроены на вторичную стимуляцию. Такая информация дает представление о механизмах, которые поддерживают Т-клетки памяти и могут направлять терапевтические манипуляции с дифференцировкой в центральные и эффекторные Т-клетки памяти [7].
В ряде исследований центральные Т-клетки памяти CD3+/CD45R0+/CD62L+ демонстрировали более высокую функциональную активность и противоопухолевый иммунитет по сравнению с эффекторными Т-клетками памяти CD3+/CD45R0+/CD62L-, которые являются терминально дифференцированными клетками памяти, циркулируют в периферической крови, вторичных лимфоидных органах, достигают эффекторной функции и истощения функциональной активности вскоре после повторной стимуляции [8–10].
Наличие адгезионной молекулы CD62L и хемокинового рецептора CCR7 на поверхности Т-клеток центральной памяти позволяет отличить данную популяцию от Т-клеток эффекторной памяти, лишенных указанных молекул.
В нашем исследовании ассоциация увеличения Т-клеток центральной памяти с неблагоприятным исходом заболевания может быть тесно связана с биологией этих клеток. Эта особенность Т-клеток центральной памяти, с одной стороны, позволяет им длительное время циркулировать в организме, с другой, определяет преимущественную локализацию во вторичных лимфоидных органах и не позволяет мигрировать в очаги опухолевого роста, равно как и не подразумевает наличие у Т-клеток центральной памяти эффекторных свойств, необходимых для разрушения опухоли [11].
Принципиальным отличием Т-клеток эффекторной памяти от Т-клеток центральной памяти является выраженная способность к продукции эффекторных цитокинов и проявлению цитолитической активности в отношении клеток-мишеней [10, 12, 13]. Более того, на этой популяции клеток возрастают экспрессия молекул «хоуминга» и миграция в воспаленные ткани. Возможно, именно поэтому нами выявлена тесная взаимосвязь между ростом этих клеток в циркуляции у пациентов с благоприятным течением заболевания.
Наличие на поверхности Т-лимфоцитов ко-стимулирующих молекул CD27 и CD28 позволяет клеткам активироваться и развивать антигенспецифический ответ in vivo при наличии антигенной стимуляции и лигандов для указанных выше молекул на мембране антигенпрезентирующих клеток, что было показано в экспериментах на мышах [14]. Если циркулирующие Т-хелперы практически всегда экспрессируют обе эти молекулы на своей поверхности, то среди общего пула цитотоксических CD8+ Т-лимфоцитов наблюдается существенное изменение в их экспрессии [15]. Цитотоксические Т-лимфоциты с фенотипом CD28+CD27high получили название наивных непраймированных Т-клеток. В их цитоплазме не обнаруживались цитотоксические гранулы, но на мембране экспрессировались CD45RA и CCR7. Антиген CCR7 также был обнаружен на популяции клеток с фенотипом CD28+CD27high-to-posCD45RA-, получивших название ранних антиген-праймированных CD3+CD8+-лимфоцитов. И наконец, клетки, лишенные CD27 и CD28, получили название поздних цитотоксических Т-клеток. Кроме того, была выделена популяция промежуточных клеток с фенотипом CD28-CD27+. По мере утраты CCR7, CD27 и CD28 возрастала способность клеток синтезировать эффекторные цитокины, проявлять цитотоксические свойства по отношению к клеткам-мишеням, синтезировать и накапливать цитолитические гранулы, но одновременно снижалась способность к пролиферации. При этом по мере созревания Т-лимфоцитов утрата CD28 предшествует снижению CD27, а переход из состояния CD27+CD28- рассматривается как один из ключевых переходов в сторону эффекторных клеток [8, 16]. Не случайно полученные нами данные об увеличении числа CD3+CD27+CD62L+ Т-клеток рассматривались как благоприятный фактор прогноза ОВ. В то же время накопление CD3+CD28+CD62L+ Т-лимфоцитов, находившихся на самых ранних стадиях дифференцировки и лишенных эффекторных свойств, было связано с неблагоприятным прогнозом.
Таким образом, генерация, дифференцировка и поддержание Т-клеток памяти в функционально оптимальном состоянии имеют решающее значение для эффективности формирования противоопухолевого иммунитета, в том числе на фоне применения иммуноонкологических препаратов при меланоме.
Недавние исследования способствовали открытию Т-клеток памяти, резидентных в тканях, и расширили наши знания о транскрипционных и эпигенетических основах дифференцировки и дисрегуляции CD8+ Т-клеток [3].
К сожалению, прогресс иммунотерапии находится на критическом этапе, поскольку эффективность иммуноонкологических препаратов ограничивается небольшой долей пациентов и часто не обеспечивает долговременную пользу от лечения [3, 5, 9, 10, 12, 15]. Раскрытие потенциала иммунотерапии требует разработки стратегий, которые одновременно индуцируют мощный эффекторный ответ и надежно формируют стабильные функционально активные пулы Т-клеток памяти, способные предотвратить рецидив или дальнейшее прогрессирование заболевания. Крайне важно, чтобы основные и новые концепции, обновленные знания о биологии Т-клеток памяти были своевременно использованы в разработках иммунотерапии рака.
Заключение
Проведенное исследование дополняет системное понимание механизмов, лежащих в основе дифференцировки Т-клеток памяти. Все большее значение приобретает определение их уровня до и в процессе иммунотерапии, что служит значимым фактором прогноза заболевания. Необходимы дальнейшие проспективные клинические исследования в данном направлении.
A.V. Novik, PhD, I.V. Kudryavtsev, PhD, T.L. Nekhayeva, PhD, N.V. Yemelyanova, A.B. Danilova, PhD, N.A. Yefremova, Ye.M. Anokhina, А.I. Semyonova, PhD, D.Kh. Latipova, PhD, G.M. Teletayeva, PhD, S.A. Protsenko, PhD, Prof., I.A. Balduyeva, PhD
N.N. Petrov National Medical Research Center of Oncology
Saint-Petersburg State Pediatric Medical University
Contact person: Alexey V. Novik, anovik@list.ru
The generation, differentiation and maintenance of memory T-cells in the functionally optimal state is crucial for the effectiveness of the formation of antitumor immunity, including against the background of the use of immuno-oncological drugs in melanoma. The aim of the study was to test the hypothesis that the level of T-cells in the peripheral blood can serve as a marker of the therapy and survival of patients with melanoma effectiveness.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.