Тройная комбинация в лечении пациента с метастатической меланомой кожи с мутацией BRAF V600
- Аннотация
- Статья
- Ссылки
- English
Введение
Меланома кожи является одной из наиболее агрессивных форм злокачественных опухолей кожи и одной из ведущих причин смерти от онкологических заболеваний из-за способности к метастазированию. Ежегодно около 232 100 (1,7%) случаев впервые выявленных злокачественных новообразований (исключая немеланомный рак кожи) и около 55 500 (0,7% всех случаев смерти от злокачественных новообразований) случаев смерти от злокачественных новообразований приходятся на меланому кожи [1]. В отличие от других солидных опухолей меланома в основном встречается у лиц молодого и среднего возраста (средний возраст на момент постановки диагноза 57 лет). Заболеваемость линейно увеличивается в возрасте от 25 лет до 50 лет, затем снижается, особенно среди лиц женского пола. Примерно в 10% случаев меланома диагностируется на распространенной стадии (нерезектабельный или метастатический процесс), причем у трети пациентов на момент постановки диагноза метастатической болезни поражены внутренние органы и головной мозг, что сопровождается худшим прогнозом течения заболевания и меньшей вероятностью ответа на лечение [2].
За последнее десятилетие благодаря внедрению ингибиторов контрольных точек иммунного ответа (нацеленных на PD-1/PD-L1 и CTLA-4), низкомолекулярных ингибиторов BRAF и MEK для подгруппы пациентов с мутациями BRAF V600 возможности лекарственной терапии значительно расширились. Однако, несмотря на ощутимый прогресс в лечении пациентов с распространенными формами заболевания, для ряда пациентов с метастатической меланомой прогноз остается неблагоприятным.
В настоящее время стандартом лечения первой линии нерезектабельной местно-распространенной/метастатической меланомы являются анти-PD-1-моноклональные антитела в монотерапии (ниволумаб, пембролизумаб, пролголимаб), комбинированная иммунотерапия (анти-PD-1-препараты (ниволумаб) в сочетании с ингибитором CTLA-4 (ипилимумаб)). В случае BRAF-мутированной меланомы дополнительным вариантом первой линии терапии является использование ингибиторов BRAF и MEK. Двойная блокада BRAF/MEK превосходит монотерапию BRAF-ингибиторами по частоте объективных ответов (ЧОО), выживаемости без прогрессирования (ВБП) и общей выживаемости (ОВ). Монотерапию ингибитором BRAF следует использовать только в случае абсолютных противопоказаний для применения MEK-ингибиторов [3].
Но как быть с пациентами, у которых заболевание прогрессирует на всех последовательных линиях современной терапии?
Таргетная терапия BRAF- и MEK-ингибиторами индуцирует высокую начальную ЧОО у пациентов с BRAF-мутированной меланомой, со средней продолжительностью ответа около года. Иммунотерапия антителами к рецепторам программируемой клеточной гибели дает более низкие показатели ЧОО, но с большей длительностью ответа. Доклинические данные показывают, что сочетание ингибиторов BRAF и MEK с ингибиторами иммунных контрольных точек позволяет обойти ограничения каждого класса препаратов, достичь более высоких показателей ответа и улучшить долгосрочный контроль заболевания [4] .
В двойном слепом рандомизированном плацебо-контролируемом исследовании фазы II KEYNOTE-022 сравнивали эффективность тройной комбинации пембролизумаба, дабрафениба и траметиниба и эффективность двойной комбинации плацебо с дабрафенибом и траметинибом. В исследование было включено 120 пациентов с метастатической меланомой с мутацией BRAF V600E/K, ранее не получавших лечения. Первичной конечной точкой была оценка ВБП. Вторичными конечными точками являлись ЧОО, длительность объективного ответа и ОВ.
За 36,6 месяца наблюдения медиана ВБП составила 16,9 месяца (95%-ный доверительный интервал (ДИ) 11,3–27,9) в группе тройной терапии и 10,7 месяца (95% ДИ 7,2–16,8) – при двойной терапии (отношение рисков (ОР) 0,53; 95% ДИ 0,34–0,83). При тройной и двойной комбинациях терапии ВБП через 24 месяца составила 41,0% (95% ДИ 27,4–54,2) и 16,3% (95% ДИ 8,1–27,1) соответственно, медиана длительности объективного ответа – 25,1 месяца (95% ДИ 14,1 – не достигнут) и 12,1 месяца (95% ДИ 6,0–15,7) соответственно. Медиана ОВ в группе триплета не была достигнута. В группе дуплета она составила 26,3 месяца (ОР 0,64; 95% ДИ 0,38–1,06). В группах триплета и дуплета ОВ через 24 месяца составила 63,0% (95% ДИ 49,4–73,9) и 51,7% (95% ДИ 38,4–63,4) соответственно. Побочные эффекты 3–4-й степени, связанные с лечением, отмечались у 35 (58%) пациентов (в том числе один летальный исход) исследуемой группы и 15 (25%) пациентов контрольной группы [5].
В указанном исследовании комбинация пембролизумаба, дабрафениба и траметиниба существенно улучшила ВБП, длительность объективного ответа и ОВ у пациентов с BRAF-мутированной метастатической меланомой по сравнению с комбинированной таргетной терапией и увеличила процент нежелательных явлений. Однако выигрыш от использования тройной комбинации не достиг статистической значимости в соответствии с гипотезой исследования, хотя нумерически медиана ВБП была выше в группе тройной комбинации.
Еще одним исследованием эффективности тройной комбинации было исследование COMBI-i – фаза III. В исследовании сравнивали терапию спартализумабом в комбинации с дабрафенибом и траметинибом (С + Д + Т) с плацебо плюс дабрафениб и траметиниб (плацебо + Д + Т) у пациентов с нерезектабельной или метастатической меланомой с мутацией BRAF V600. Первичной конечной точкой в исследовании была ВБП, ключевой вторичной конечной точкой – ОВ.
За время наблюдения медиана ВБП составила 16,2 месяца (95% ДИ 12,7–23,9) в группе С + Д + Т и 12,0 месяца (95% ДИ 10,2–15,4) – в группе плацебо + Д + Т (ОР 0,82; 95% ДИ 0,66–1,03; p = 0,042 (односторонний; незначимый)). ЧОО составила 69% (183 из 267 пациентов) против 64% (170 из 265 пациентов) соответственно. Побочные эффекты, связанные с лечением, отмечались у 55% (146 из 267) пациентов в группе С + Д + Т и 33% (88 из 264) – в группе плацебо + Д + Т. Как и исследование KEYNOTE-022, данное исследование не достигло своей первичной конечной точки. Дальнейшее исследование может выявить субпопуляции пациентов, которые будут иметь выигрыш от назначения данной комбинации препаратов, однако спартализумаб пока не зарегистрирован [6].
В рандомизированном двойном слепом плацебо-контролируемом исследовании фазы III IMspire150 сравнивали эффективность тройной комбинации атезолизумаба, вемурафениба и кобиметиниба с эффективностью двойной комбинации таргетными препаратами. В исследование было включено 514 пациентов с нерезектабельной местно-распространенной/метастатической меланомой с мутацией BRAF. Первичной конечной точкой служила ВБП. Это исследование (NCT02908672) продолжается в настоящее время, но набор пациентов завершен.
При медиане наблюдения 18,9 месяца ВБП на фоне применения тройной комбинации атезолизумаба, вемурафениба и кобиметиниба значительно превысила таковую при использовании двойной комбинации вемурафениба и кобиметиниба (15,1 против 10,6 месяца; ОР 0,78; 95% ДИ 0,63–0,97; p = 0,025). Общий процент нежелательных явлений, связанных с лечением, в обеих группах превысил 30%, наблюдались повышение уровня креатинфосфокиназы (51,3 против 44,8%), диарея (42,2 против 46,6%), сыпь (40,9%, обе группы), артралгия (39,1 против 28,1%), пирексия (38,7 против 26,0%), повышение уровней аланинаминотрансферазы (АЛТ) (33,9 против 22,8%) и липазы (32,2 против 27,4%). 13% пациентов группы атезолизумаба и 16% контрольной группы завершили лечение из-за побочных эффектов.
Таким образом, добавление атезолизумаба к таргетной терапии вемурафенибом и кобиметинибом было переносимым и значительно увеличивало ВБП у пациентов с метастатической меланомой с мутацией BRAF V600 [7].
Клинический случай
Пациентка Т., 61 год, длительно отмечала наличие пигментного образования на коже грудной стенки слева. В 2019 г. пациентка обратилась в клинику по поводу кровоточивости новообразования. В июле 2019 г. было выполнено хирургическое лечение в объеме иссечения новообразования грудной стенки слева.
Данные гистологического исследования: узловая меланома с инвазией ретикулярного слоя дермы, без изъязвления, с умеренно выраженной лимфоцитарно-плазмоцитарной инфильтрацией. Уровень инвазии по Кларку IV. Толщина опухоли по Бреслоу 10,0 мм. В ходе молекулярно-генетического исследования выявлена мутация гена BRAF V600E.
Пациентке был установлен первоначальный диагноз: меланома кожи грудной стенки слева pT4aN0M0, стадия IIC, мутация BRAF V600E.
После оперативного лечения пациентка находилась на динамическом наблюдении в течение 11 месяцев.
В августе 2020 г. пациентка самостоятельно отметила появление образования в левой подмышечной области. При дообследовании, по данным позитронной эмиссионной томографии, совмещенной с компьютерной томографией (ПЭТ/КТ), с 18F-фтордезоксиглюкозой (18F-ФДГ), в ноябре 2020 г. в левой аксиллярной области определена малочисленная группа лимфатических узлов до 3 см с высокой метаболической активностью, в корнях легких симметрично – немногочисленные лимфоузлы до 7 мм неопределенного генеза.
По месту жительства в декабре 2020 г. пациентке было выполнено оперативное лечение в объеме подмышечно-подлопаточной лимфаденэктомии слева с пластикой. Рекомендована адъювантная терапия по схеме: вемурафениб 960 мг/сут ежедневно непрерывно + кобиметиниб 60 мг один раз в день, прием 1–21-й дни, семь дней перерыв, в течение года, плановое обследование один раз в три месяца. Необходимо отметить, что данный комбинированный режим таргетной терапии не зарегистрирован для адъювантного применения.
С декабря 2020 г. пациентка начала прием комбинированной таргетной терапии.
При первом контрольном обследовании, по данным ПЭТ/КТ (апрель 2021 г.), отмечалось появление конгломератов лимфоузлов в воротах печени до 2,5 см, выявлен канцероматоз брюшины, что свидетельствовало о прогрессировании заболевания на фоне приема таргетных препаратов, продолжительность приема которых до прогрессирования составляла 3,5 месяца.
С учетом прогрессирования заболевания пациентке назначили комбинированную иммунотерапию – ипилимумаб 3 мг/кг и ниволумаб 1 мг/кг, один раз в 21 день.
29 апреля 2021 г. было выполнено первое введение комбинированной иммунотерапии ипилимумабом и ниволумабом.
В течение первых двух недель после введения препаратов у пациентки появились жалобы на выраженную слабость, тошноту, потемнение мочи. Из-за подозрения на развитие иммуноопосредованного гепатита и холестатического синдрома пациентка была экстренно госпитализирована в стационар. Анализ крови (июнь 2021 г.): АЛТ – 262,9 ЕД/л (норма лаборатории – 7–35; 7,5 нормы – GRADE 3 по CTCAE 5.0), аспартатаминотрансфераза (АСТ) – 288 ЕД/л (норма лаборатории – 8–40; 7,2 нормы – GRADE 3 по CTCAE 5.0), общий билирубин – 100,9 мкмоль/л (норма лаборатории – 3,40–17,0; 5,9 нормы – GRADE 3 по CTCAE 5.0), щелочная фосфатаза (ЩФ) – 1490 ЕД/л (норма лаборатории – 34–114; 13 норм – GRADE 3 по CTCAE 5.0), гамма-глутамилтранспептидаза (ГГТП) – 1740 ЕД/л (норма лаборатории – 9–52; 33 нормы – GRADE 4 по CTCAE 5.0). В условиях стационара проводилась консервативная терапия преднизолоном 40 мг перорально, адеметионином 400 мг внутривенно капельно, метронидазолом 100 мл внутривенно капельно. После выписки пациентка амбулаторно продолжала прием преднизолона с постепенной редукцией дозы.
С мая по сентябрь 2021 г. пациентка не получала специфического лечения с учетом длительного восстановления после развития нежелательного явления. Комбинированная иммунотерапия была полностью отменена.
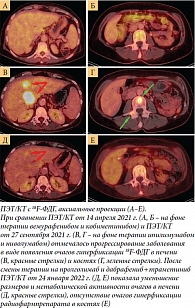
При контрольном обследовании, по данным ПЭТ/КТ, в сентябре 2021 г. выявлено дальнейшее прогрессирование заболевания в виде появления очагов в печени и костях скелета (литическая деструкция) (рисунок, А–Г).
С учетом тяжести состояния пациентке по месту жительства рекомендовали паллиативное лечение.
В октябре 2021 г. пациентка обратилась в Национальный медицинский исследовательский центр (НМИЦ) онкологии им. Н.Н. Блохина для получения второго врачебного мнения. На момент обращения функциональный статус пациентки расценивался как ECOG-3, она использовала опиоидные анальгетики (трамадол, промедол) с незначительным эффектом, нуждалась в помощи.
В рамках научной тематики отделения онкодерматологии НМИЦ онкологии им. Н.Н. Блохина было начато комбинированное лечение по схеме: пролголимаб (1 мг/кг внутривенно один раз в 14 недель), дабрафениб 300 мг/сут + траметиниб 2 мг/сут.
На протяжении всего периода лечения в анализах крови сохранялись повышенные показатели АЛТ, АСТ в пределах 2-й степени, повышение уровней ЩФ, ГГТП расценивалось как проявление основного заболевания.
Через месяц от начала терапии (два введения пролголимаба на фоне терапии дабрафенибом и траметинибом) пациентка отметила улучшение общего состояния, значимое уменьшение болевого синдрома (отказ от приема опиоидных анальгетиков).
С октября 2021 г. проведено шесть курсов иммунотерапии пролголимабом на фоне таргетной терапии.
Данные контрольной ПЭТ/КТ в феврале 2022 г.: частичный ответ в виде уменьшения количества, размеров и метаболической активности всех ранее выявленных очагов опухолевой активности (рисунок, Д и Е).
Данных о прогрессировании заболевания не получено, в связи с чем лечение было продолжено по прежней схеме.
С учетом поражения костей скелета литического характера с марта 2022 г. была начата терапия остеомодифицирующими агентами.
19 марта 2022 г. (спустя пять месяцев от начала тройной терапии) пациентка отметила появление боли, ломоты в суставах верхних и нижних конечностей, купируемых приемом ибупрофена. Подобные жалобы расценивались как развитие нежелательных явлений на фоне тройной комбинации, в связи с чем с 25 марта 2022 г. прием таргетных препаратов был отменен и далее продолжен в редуцированных дозах (дабрафениб 250 мг/сут + траметиниб 2 мг/сут), после чего указанная симптоматика разрешилась.
Пациентке суммарно на момент подготовки статьи проведено 11 курсов иммунотерапии пролголимабом на фоне продолжающейся таргетной терапии дабрафенибом и траметинибом.
Заключение
Роль тройных комбинаций в лечении пациентов с неоперабельной и/или метастатической меланомой кожи с мутацией BRAF в настоящее время активно изучается и обсуждается. Вопрос, какой же пациент с неоперабельной и/или метастатической меланомой кожи с мутацией BRAF получит наибольшую пользу от назначения тройной комбинации, остается открытым. Представленное клиническое наблюдение свидетельствует об успешном применении тройной комбинации (иммунотерапии с таргетной терапией) у пациентки с ранее зарегистрированным прогрессированием болезни на фоне всех видов стандартной терапии. Данный случай демонстрирует возможность повторного использования BRAFi и MEKi у пациентов, уже получавших в анамнезе таргетную терапию и завершивших лечение таргетными препаратами из-за прогрессирования заболевания. Кроме того, остается открытым вопрос о возможности применения иммунотерапии анти-PD-1 у пациентов с ранее зарегистрированной токсичностью 3–4-й степени на фоне комбинированной (анти-PD-1 + анти-CTLA-4) иммунотерапии.
Исходя из опубликованных на сегодняшний день данных литературы, выбор целесообразно делать в пользу комбинации таргетных препаратов, которая ранее не использовалась, в случае их повторного назначения после прогрессирования. Поэтому в данном случае мы отдали предпочтение комбинации дабрафениба и траметиниба. Добавление иммунотерапии анти-PD-1 (пролголимаб) к таргетной терапии не привело к рецидиву тяжелого гепатита, который ранее был зарегистрирован на фоне комбинированной иммунотерапии и не позволил провести запланированную терапию в полном объеме. В данном клиническом случае использование тройной комбинации (пролголимаб + дабрафениб + траметиниб) позволило достичь объективного ответа на лечение, увеличить ВБП при удовлетворительной переносимости. В настоящее время пациентка продолжает лечение.
A.S. Tsareva, V.V. Nazarova, PhD, K.V. Orlova, PhD, P.Ye. Tulin, PhD, L.V. Demidov, PhD, Prof.
N.I. Pirogov Russian National Research Medical University
N.N. Blokhin National Medical Research Center of Oncology
Contact person: Anastasia S. Tsareva, tsarevaas1997@yandex.ru
The article presents a clinical case of the use of combined therapy with BRAF/MEK inhibitors and anti-PD-1 monoclonal antibody in a patient with metastatic melanoma of the skin with a BRAF mutation. This clinical case demonstrates a recurrent course of the disease associated with resistance to anti-PD-1 monotherapy, targeted BRAF/MEKi therapy, intolerant toxicity when using combined immunotherapy and relative success when attempting triple immunotargeted therapy with BRAF/MEK inhibitors (dabrafenib + trametinib) and an immune response checkpoint inhibitor (prolgolimab).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.