Взаимосвязь хронического панкреатита с жировой болезнью печени и нарушениями углеводного обмена у пациентов с ожирением
- Аннотация
- Статья
- Ссылки
Введение
В последнее время появляется все больше статистических данных о росте в популяции числа людей с ожирением. Вместе с этим увеличивается и число заболеваний, связанных с избыточной массой тела. Как следствие, средняя продолжительность жизни полных людей на 8–10 лет меньше, чем в популяции. В мире ежегодно погибает более 2,5 млн человек от заболеваний, связанных с ожирением [6].
В настоящее время ожирение является одним из наиболее важных критериев диагностики метаболического синдрома. Некоторые другие дополнительные факторы, такие как атерогенная дислипидемия и нарушение толерантности к углеводам (НТГ) и/или сахарный диабет 2 типа, а также неалкогольная жировая болезнь печени (НАЖБП), могут оказывать влияние на риск развития острого (ОП) и хронического панкреатитов (ХП). Именно оценке данной взаимосвязи и посвящена эта работа.
Как известно, жировой гепатоз (стеатоз) печени и неалкогольный стеатогепатит (НАСГ) представляют собой две стадии НАЖБП. Известное исследование «Дионис» (Dionysos study, 1994) продемонстрировало гистологически подтвержденный стеатоз у 46% пациентов с ожирением, не злоупотреблявших алкоголем, и у 95% лиц с ожирением, употреблявших более 60 г чистого этанола в сутки. Распространенность НАБЖП в общей популяции, по данным разных исследований, колеблется в пределах 5,7–17% [17]. С точки зрения клинициста основное внимание целесообразно уделять стеатогепатиту как потенциальной причине развития цирроза печени, однако этим интерес к НАСГ не ограничивается.
НАСГ подразделяют на первичный и вторичный. Основой первичного НАСГ является синдром инсулинорезистентности, для которого характерно снижение чувствительности тканевых рецепторов к эндогенному инсулину, вырабатывающемуся в нормальном или даже повышенном количестве, особенно при ожирении, с учетом характера питания и качества пищи (высококалорийная пища и увеличенный разовый объем пищи) [2, 9].
Необходимо отдельно рассмотреть патологические состояния, которые тесно связаны с развитием НАЖБП и воспалительных заболеваний поджелудочной железы.
Ожирение
У 75% пациентов с НАСГ индекс массы тела (ИМТ) повышен на 10–40% по сравнению с нормой, особенно у больных с висцеральным ожирением. Ожирение (при ИМТ > 30 кг/м2) в 95–100% случаев связано с развитием стеатоза печени и в 20–47% – с НАСГ [1]. Гиперинсулинемия способствует снижению β-окисления свободных жирных кислот (СЖК) в печени и образованию из них триглицеридов, что приводит к формированию жировой дистрофии гепатоцитов [1].
Многими клиницистами подтверждены факты более тяжелого течения ОП и более длительной госпитализации у больных с избыточной массой тела [8, 12, 16]. Также проведенными исследованиями доказано, что ожирение является достаточно надежным ранним прогностическим признаком тяжести течения и прогноза ОП [12, 13, 19]. Однако точные механизмы ассоциативной взаимосвязи ожирения и панкреатитов до сих пор не установлены [15, 16]. Возможно, жировая инфильтрация печени, имеющая место при ожирении, играет определенную роль в развитии патологического процесса при ОП, вероятно, за счет снижения функции этого органа, поскольку выживаемость при ОП коррелирует с выраженностью стеатоза печени [14].
Известным фактом является взаимосвязь между желчекаменной болезнью и ожирением, поэтому ряд авторов именно этим объясняют повышенный риск развития панкреатита (острого и хронического) у больных ожирением [7, 9, 18]. Авторами было показано, что холелитиаз, хронический холецистит, панкреатит встречались достоверно чаще у лиц с избыточной массой тела, чем в контрольной группе [18].
Вероятная взаимосвязь, требующая дополнительного анализа, – изменение состава желчи при ожирении с потенциальным увеличением ее литогенности, развитием билиарного сладжа и холелитиаза, поскольку при ожирении наблюдается повышенный синтез и экскреция холестерина желчью. При этом количество продуцируемого холестерина прямо пропорционально избытку массы тела. Необходимо отметить, что низкокалорийные диеты, применяемые с целью похудания у пациентов с ожирением, в 25% случаев также сопровождаются образованием билиарного сладжа и конкрементов [3, 18]. Другими словами, у больных ожирением преимущественный этиологический фактор развития панкреатита – билиарнозависимый. Однако этот механизм, по всей видимости, не единственный, поскольку у больных ожирением часто имеются тяжелые нарушения углеводного (сахарный диабет) и жирового обмена (гиперлипидемия).
Значимая роль ожирения доказана при развитии и течении ОП и дискутабельна при ХП. В то же время большинство этиологических факторов ОП и ХП идентичны, а также имеется достаточное количество данных, свидетельствующих о возможности трансформации ОП в ХП [5]. Поэтому в некоторой степени можно предполагать взаимосвязь ожирения и ХП. Безусловно, имеющихся данных пока недостаточно для вынесения определенного заключения. По результатам проведенных нами исследований [4] такая взаимосвязь все же существует.
Сахарный диабет 2 типа или НТГ
НТГ или сахарный диабет 2 типа выявляются у 15% больных стеатозом печени и в 60% случаев – у пациентов с НАСГ; тяжесть поражения печени имеет прямую связь с тяжестью нарушения обмена глюкозы. Одним из факторов инсулинорезистентности при НАЖБП является фосфолирирование инсулинового рецептора 1-го типа, опосредованное действием TNF-α, что приводит к уменьшению сродства рецептора к инсулину и транспорта глюкозы в клетки [2]. Другим фактором при чрезмерном увеличении массы жировой ткани является нарушение баланса медиаторов, регулирующих чувствительность рецепторов к инсулину [1].
Известным фактом является постепенное развитие инкреторной панкреатической недостаточности у больных ХП. В частности, по результатам проведенного нами исследования типа «случай – контроль» сахарный диабет осложнял течение ХП в 11% случаев, при этом у больных с избыточной массой тела он встречался достоверно чаще [4].
В ряде исследований было выявлено, что нарушение экзокринной функции поджелудочной железы – это характерная черта инсулинзависимого сахарного диабета; оно отмечается в 20–70% случаев этого заболевания [5, 10]. Патофизиологию взаимосвязи сахарного диабета и ХП можно представить следующим образом [5]:
- тесная функциональная взаимосвязь эндо- и экзокринной паренхимы поджелудочной железы;
- уменьшение гликемии при заместительной ферментной терапии микрокапсулированным панкреатином;
- секреции инсулина коррелирует с концентрацией панкреатических ферментов в крови;
- ангиопатия усугубляет микроциркуляторные нарушения при ХП.
Гиперлипидемия
Гиперлипидемия выявляется у 20–80% больных с НАСГ; при этом характерно, что с гипертриглицеридемией НАСГ сочетается чаще, чем с гиперхолестеринемией. Нарушение метаболизма глюкозы и липидов в жировой ткани ведет к усилению липолиза и высвобождению СЖК, которые усугубляют печеночную инсулинорезистентность и способствуют синтезу и секреции печенью липопротеинов очень низкой плотности [1].
В последнее время отмечается значительный рост заболеваемости панкреатитами на фоне гиперлипидемии, частота встречаемости ОП у больных гиперлипидемией достигает 12–38% [5]. Возможно, механизм, ведущий к тяжелым формам ОП, заключается в токсическом воздействии на ткань поджелудочной железы чрезвычайно высоких концентраций СЖК, которые не могут быть полностью связаны сывороточными альбуминами в плазме крови. В то же время наблюдение за больными показало, что для возникновения панкреатита на фоне гиперлипидемии необходимо дополнительное вторичное воздействие на поджелудочную железу алкоголя или некоторых лекарственных средств либо декомпенсация протекающего параллельно сахарного диабета [11].
Таким образом, согласно данным литературы, причины многих патогенетических звеньев развития ХП и поражения печени у лиц с ожирением недостаточны изучены. Однако четко прослеживается связь между развитием ОП или ХП и поражением печени на фоне ожирения, что связано с нарушением углеводного и липидного обмена, а также с параллельным отягощением течения ХП и НАЖБП у лиц с ожирением.
Для подтверждения данных наблюдений необходимо проведение крупных клинических исследований, направленных на уточнение особенностей патогенеза сочетанного поражения печени и поджелудочной железы у лиц с ожирением, а также с целью разработки тактики ведения и лечения таких пациентов.
Исследование
Цель исследования: оценить особенности течения ХП у лиц с избыточной массой тела и определить взаимосвязь поражения печени и поджелудочной железы у больных ожирением.
Материалы и методы
Проведено ретроспективное сравнительное исследование («случай – контроль»), в рамках которого были проанализированы 2034 стационарные истории болезней пациентов, пролеченных в соответствии с медико-экономическими стандартами К86,0 или К86,1 (МКБ 10-го пересмотра) в период 2002–2010 гг.
Клинический центр: НУЗ ЦКБ № 2 им. Н.А. Семашко ОАО «РЖД» (директор – заслуженный врач России, д.м.н., проф. Калинин М.Р.).:
- отделение гастроэнтерологии (зав. отделением – главный гастроэнтеролог ОАО «РЖД» Куликовская Н.С.);
- 1-е терапевтическое отделение (зав. отделением к.м.н. Черемушкин С.В.);
- 1-е хирургическое отделение (зав. отделением – д.м.н., проф. Габуния З.Р.).
Критерии включения в исследование
- Код диагноза К86,0 или К86,1 по МКБ 10-го пересмотра.
- Возраст 20–60 лет. Больные старшего возраста не включались в исследование для минимизации вероятности ассоциации с сопутствующими заболеваниями, требующими дополнительного приема препаратов, способных повлиять на течение основного заболевания, увеличить длительность пребывания больного в стационаре и т.п.
- Отмеченные в первичной медицинской документации на момент обращения клинические проявления ХП (болевой абдоминальный синдром, нарушения стула, стеаторея, вздутие живота).
- Анамнестические данные, позволяющие предполагать диагноз ХП (регулярное табакокурение и/или доказанная патология билиарного тракта, документированный ОП в анамнезе).
- Данные лучевых методов диагностики (ультразвукового исследования и/или компьютерной томографии), демонстрирующие типичные признаки ХП (изменение размеров поджелудочной железы, дилатация и/или повышение эхогенности стенок главного панкреатического протока, неровность контуров и неоднородность паренхимы органа, конкременты или кальцификация паренхимы железы).
- Наличие в истории болезни указаний на ИМТ и/или ростовесовые показатели.
Критерии исключения из исследования
- Клинико-инструментальные признаки ОП.
- Клинико-инструментальные признаки аутоиммунных гепатита и/или панкреатита.
- Инфицированность вирусами гепатитов В и/или С, ВИЧ-инфекция.
- Наличие цирроза печени любой этиологии.
- Состояние после резекции желудка или гастрэктомии.
- Синдром мезентериальной ишемии.
- Любые другие причины хронической диареи (глютеновая энтеропатия, лактазная недостаточность, воспалительные заболевания кишечника и др.).
- Сопутствующий прием препаратов, влияющих на тонус БДС: антагонистов кальциевых каналов, нитратов.
- Любые сопутствующие заболевания в стадии декомпенсации (сердечно-сосудистая, печеночная или почечная недостаточность, сахарный диабет и др.), требующие интенсивных мер и специального лечения.
- Любые опухолевые (злокачественные) заболевания органов пищеварения и других локализаций, химиотерапия и лучевая терапия в анамнезе.
- Любые хирургические вмешательства в процессе текущей госпитализации.
- Сведения в первичной медицинской документации об участии на текущий момент (на момент обращения/госпитализации) в каких-либо клинических исследованиях.
В исследование не включались пациенты, не отвечающие любому из вышеприведенных критериев.
Методы
Согласно критерию диагноза К86,0 или К86,1 первично было отобрано 2034 истории болезни, из них в дальнейший анализ включено 1930 историй болезни пациентов, удовлетворяющих критериям включения. При отсутствии указаний на ИМТ последний рассчитывался исходя из ростовесовых показателей (кг/м2). Избыточной массу тела считали при ИМТ > 25 кг/м², ожирение диагностировали при ИМТ ³ 30 кг/м². В первичной медицинской документации проведен анализ физикальных и анамнестических данных, результатов обследования.
Результаты и их обсуждение
В результате ретроспективного анализа 1930 историй болезни в исследование вошли 1070 пациентов (55%) с высоким ИМТ (> 25,1 кг/м2), в группу сравнения вошли 567 пациентов (30%) с нормальным ИМТ (18,5–25 кг/м2). 293 больных с низким ИМТ (15%) исключены из дальнейшего анализа.
У 632 (59,1%) из 1070 пациентов с высоким ИМТ был диагностирован билиарный ХП. У большинства больных, включенных в исследование, присутствовали болевой абдоминальный и диспепсический синдромы, стеаторея по данным копрограммы, характерные для поражения ПЖ. Жалоб, специфичных для поражения печени, больные не предъявляли.
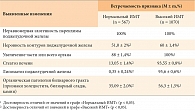
В анализах крови у больных с высоким ИМТ было отмечено статистически достоверное увеличение панкреатических ферментов (амилазы, липазы) (р < 0,05), общего холестерина (р < 0,01), триглицеридов (р < 0,001) по сравнению с результатами у пациентов с нормальной массой тела. Была выявлена положительная корреляционная связь между индексом массы тела и повышением значений триглицеридов в биохимических анализах крови (r = 0,78; р < 0,05). Также были зафиксированы повышенные маркеры цитолиза, преимущественно аланинаминотрансферазы (АЛТ) у 175 (10%) из 1637 пациентов основной и контрольной групп. При этом маркеры цитолиза статистически достоверно чаще регистрировались у больных с высоким ИМТ по сравнению с больными с нормальным ИМТ (12,0 ± 0,99% и 7,0 ± 1,1% соответственно; р < 0,05). Ретроспективно при анализе анамнестических данных было установлено, что синдром цитолиза регистрировался статистически достоверно чаще у больных ХП и стеатозом печени с высоким ИМТ при резком похудании на фоне атаки панкреатита (1–2 кг за неделю) (р < 0,05).
У больных ХП с высоким ИМТ и стеатогепатитом в 20,3% случаев отмечена гипертриглицеридемия. Вышеперечисленные показатели анализов крови свидетельствовали о сочетанном поражении печени и поджелудочной железы у больных ожирением на фоне нарушенного липидного обмена.
Как видно из таблицы 1, по данным ультразвукового исследования органов брюшной полости у больных с высоким ИМТ статистически достоверно чаще регистрировались увеличенные размеры поджелудочной железы, признаки ее липоматоза и стеатоза печени, также чаще регистрировалась патология билиарного тракта по сравнению с частотой встречаемости признака в контрольной подгруппе лиц с нормальной массой тела (р < 0,05). Скорее всего, это обусловлено изменением при ожирении состава желчи – увеличением ее литогенности и развитием билиарного сладжа и холелитиаза, а также жировой инфильтрацией поджелудочной железы и печени.
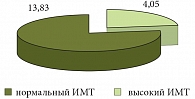
Известным фактом является постепенное развитие инкреторной панкреатической недостаточности у больных ХП. У больных ожирением и НАЖБП развивается инсулинорезистентность, что, в свою очередь, способствует развитию НТГ или сахарного диабета 2 типа. Поэтому у лиц с ожирением и ХП в сочетании с поражением печени чаще диагностировались нарушения углеводного обмена. В частности, по результатам проведенного нами исследования «случай – контроль» НТГ или сахарный диабет 2 типа осложняли течение ХП в общей выборке у 10,5% больных, при этом у пациентов с избыточной массой тела они встречались достоверно чаще (рис. 1). Также у больных ХП с высоким ИМТ в 100% случаев нарушения углеводного обмена протекали на фоне стеатоза печени, сопровождая почти все случаи НАСГ из нами выявленных.
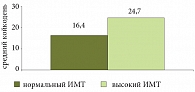
При анализе длительности стационарного лечения (рис. 2) было достоверно установлено увеличение среднего койко-дня у больных ХП с высоким ИМТ по срвнению с больными ХП с нормальным ИМТ (р < 0,05). Таким образом, средняя длительность пребывания больных в стационаре увеличивается более чем на 8 дней у лиц с избыточной массой тела. Безусловно, это может быть связано с фактом наличия прочих ассоциированных с ожирением заболеваний, требующих дополнительного лечения, однако большинство потенциально возможных из них было отсечено строгими критериями исключения.
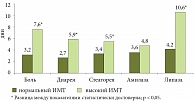
Правомочность гипотезы подтверждается фактом более быстрого купирования болевого абдоминального синдрома, диареи, стеатореи, панкреатической гиперферментемии, отмеченных в первичной медицинской документации (рис. 3). Таким образом, можно предполагать, что чем выше масса тела, тем тяжелее протекало обострение ХП и увеличивался койко-день, что и было подтверждено наличием положительной корреляционной связи между ИМТ и тяжестью течения ХП (совокупно оцененной по условной трехбалльной шкале по каждому признаку – боль, диарея, стеаторея, панкреатическая гиперферментемия, r = 0,62; р < 0,05).
К концу стационарного лечения у больных ХП с нормальным ИМТ отмечено стойкое купирование болевого абдоминального и диспепсического синдромов, уменьшение стеатореи по данным копрограммы, нормализация показателей в анализах крови, а также нормализация размеров и структуры поджелудочной железы по данным ультразвукового исследования органов брюшной полости.
При выписке из стационара у больных ХП с высоким ИМТ отмечено купирование болевого абдоминального и диспепсического синдромов, уменьшение стеатореи в копрограмме. Однако по данным УЗИ органов брюшной полости изменений зарегистрировано не было, в анализах крови отмечено незначительное снижение показателей АЛТ, общего холестерина, триглицеридов, которые были выше контрольных значений.
У больных с избыточной массой тела и обострением ХП, протекающим на фоне НАЖБП, тяжесть течения и риск осложнений обусловлены, с одной стороны, снижением экзокринной и эндокринной функций ПЖ на фоне ее условной дистрофии (липоматоз ПЖ) и, вероятно, выраженной системной воспалительной реакцией, чрезмерной экспрессией цитокинов и эндотоксинов, активацией процессов перекисного окисления липидов с учетом сниженной способности печени к их инактивации.
Анализ проведенного лечения выявил любопытные факты – среди лиц с ожирением r благоприятного исхода (купирование клинико-лабораторных признаков ХП, своевременная выписка) отмечено при использовании высоких доз современных препаратов минимикросферического панкреатина (Креон, более 50000 ЕД липазы в сутки) по сравнению с таблетированным панкреатином и галеническими ферментами в низких дозах (ОШ 2,56 и 1,17 соответственно; р < 0,01), а также при введении в схему терапии S-адеметионина (Гептрала) 800–1600 мг в сутки (ОШ 3,1 и 0,95 соответственно; р < 0,001) по сравнению с использованием гепатопротекторов других групп или неиспользованием лекарственных средств этой группы вовсе.
Таким образом, оценка вариантов терапии пациентов указанной патологии свидетельствовала, что наиболее оптимальными полиферментными препаратами при ожирении являются минимикросферы, а гепатопротектором – S-адеметионин (Гептрал).
Выводы
- У больных ожирением в связи с особенностями питания (преобладание в рационе животных жиров и легкоусвояемых углеводов), малоактивным образом жизни, высокой частотой органической билиарной патологии, гиперлипидемии чаще развивается ХП, особенно в сочетании с поражением печени (НАЖБП).
- У больных ХП с ожирением и НАЖБП достоверно чаще развиваются нарушение углеводного (НТГ или сахарный диабет 2 типа) и липидного обмена (гипертриглицеридемия, гиперлипидемия), что в свою очередь усугубляет течение ХП и значимо увеличивает сроки пребывания в стационаре.
- Сочетанное поражение печени у лиц с ожирением, вероятно, усугубляет тяжесть поражения поджелудочной железы.
- Использование сочетанного использования высокодозовой терапии минимикросферическими препаратами панкреатина и S-адеметионином значимо улучшает прогноз у больных ХП и ожирением.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.