Янумет Лонг: повышение приверженности терапии пациентов с сахарным диабетом 2 типа
- Аннотация
- Статья
- Ссылки
- English
В статье рассматриваются возможности фиксированной комбинации метформина медленного высвобождения и ингибитора дипептидилпептидазы 4 ситаглиптина в отношении повышения не только эффективности терапии, но и приверженности ей.
В статье рассматриваются возможности фиксированной комбинации метформина медленного высвобождения и ингибитора дипептидилпептидазы 4 ситаглиптина в отношении повышения не только эффективности терапии, но и приверженности ей.

Масштабы распространения сахарного диабета (СД), ассоциированные с ним сердечно-сосудистые осложнения, в том числе фатальные, поражения органов и систем, нарушения всех видов обмена веществ позволяют считать его угрозой для человечества.
По данным Международной диабетической федерации (International Diabetes Federation – IDF), на 1 января 2015 г. насчитывалось 415 млн пациентов с СД, при этом ежегодный прирост составляет 9,5 млн. К 2040 г. ожидается увеличение заболеваемости на 55% и количество лиц с СД может достичь 642 млн [1]. Исходя из анализа прогнозов экспертов IDF за предыдущие десятилетия, можно предположить, что последний прогноз также носит оптимистичный характер. К указанному году число диабетиков превысит 750 млн.
В России согласно результатам исследования NATION 5,4% населения от 20 до 79 лет, что приблизительно составляет 6 млн человек, страдают СД 2 типа, 19,26% – находятся в состоянии предиабета [2].
Учитывая скачкообразное повышение заболеваемости, можно прогнозировать увеличение общих расходов здравоохранения [3] на лечение не только СД, но и его осложнений. Самыми частыми и грозными из них признаны слепота, ампутация, гемодиализ, аортокоронарное шунтирование – сокращенно САГА.
Основная причина развития осложнений СД 2 типа – хроническая гипергликемия.
При манифестации СД 2 типа секреция инсулина снижается практически на 50%, чувствительность к нему – на 70% [4]. Инсулинорезистентность приводит к снижению синтеза гликогена, активации гликогенолиза и глюконеогенеза. Развитию инсулинорезистентности также способствуют стресс, инфекции, уменьшение физической активности, пожилой возраст, прием алкоголя, ожирение и другие состояния [5].
Длительная инсулинорезистентность компенсируется нефизиологической гиперинсулинемией. В дальнейшем этот механизм утрачивается, и повышается продукция глюкозы печенью. Как следствие, повышение гликемии натощак. При СД 2 типа, несмотря на пищевую нагрузку, продукция эндогенной глюкозы печенью продолжается, что в сочетании с относительной недостаточностью выброса инсулина приводит к постпрандиальной гипергликемии.
На этапе установления диагноза СД 2 типа основными терапевтическими мероприятиями считаются модификация образа жизни и назначение метформина как препарата первой линии (в отсутствие противопоказаний).
Метформин – единственный препарат из группы бигуанидов, разрешенный к применению [6]. Он способствует инсулин-индуцированному подавлению глюконеогенеза из лактата, пирувата, глицерола, некоторых аминокислот и препятствует глюконеогенетическому действию глюкагона [7]. Ночная продукция глюкозы печенью подавляется, как следствие, снижается гликемия натощак. Для адекватного гликемического контроля помимо целевых значений гликемии натощак необходимо достичь целевых показателей постпрандиальной гликемии. Если контроль постпрандиального уровня глюкозы не связан с увеличением риска гипогликемических состояний, то контроль значений глюкозы плазмы натощак, напротив, ассоциируется с таковым [8].
После открытия инкретинов (глюкагоноподобного пептида 1 (ГПП-1) и глюкозозависимого инсулинотропного полипептида (ГИП)) – эндогенных стимуляторов секреции инсулина в ответ на прием пищи были разработаны препараты, регулирующие гликемию с помощью модулирования секреции ГПП-1. Последний стимулирует глюкозозависимое высвобождение инсулина, подавляет продукцию глюкагона, замедляет эвакуацию пищи из желудка, снижает аппетит и может способствовать сохранению функции бета-клеток у пациентов с СД 2 типа [9].
Ингибирование дипептидилпептидазы 4 (ДПП-4) замедляет деградацию эндогенного ГПП-1. В результате действие инсулинотропного гормона усиливается и пролонгируется [10].
Выявление физиологической роли инкретинов (ГПП-1 и ГИП) в регуляции углеводного обмена позволило рассматривать их в качестве терапевтических мишеней [11].
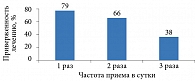
В настоящее время доказано, что для успешного управления СД 2 типа, в том числе на старте терапии, необходимо комбинировать антигипергликемические препараты, которые дополняли бы действие друг друга. В то же время установлено, что одновременный прием нескольких препаратов затрудняет соблюдение предписанного режима. Несоблюдение схемы приема лекарственных препаратов при комбинированной терапии объясняется необходимостью принимать большое количество таблеток (рис. 1), а также развитием побочных эффектов. Это приводит к снижению приверженности лечению или его отмене, субоптимальным клиническим результатам.
Результаты исследования, проведенного A.H. Paes и соавт. (1997) [12], продемонстрировали, что при назначении лекарственного препарата два раза в день приверженность пациентов лечению составляет 66%.
Установлено, что приверженность терапии пероральными сахароснижающими препаратами (ПССП) варьируется от 30 до 90% [13, 14]. Низкая приверженность терапии (участники исследования получали ПССП, статины и гипотензивные препараты) увеличивала частоту неблагоприятных исходов у больных СД 2 типа. Общая смертность в группе с высокой приверженностью лечению (n = 9076) составила 4%, с низкой (n = 2456) – 5,9% (p < 0,001). Уровень гликированного гемоглобина (HbA1c) в первой группе – 7,7%, во второй – 8,1% (p < 0,001) [13].
Y. Rozenfeld и соавт. (2008) установили, что приверженность лечению ПССП обратно пропорциональна уровню HbA1c [14]. Так, увеличение приверженности терапии на 10% приводит к снижению значений HbA1c на 0,1% (p = 0,0004).
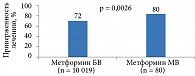
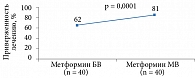
Одним из возможных путей решения проблемы низкой приверженности лечению может стать применение фиксированных комбинаций ПССП. Это в свою очередь приведет к более выраженному клиническому эффекту (рис. 2 и 3).
Первый метаанализ, в котором сравнивалась эффективность контроля гликемии при использовании фиксированной и свободной комбинаций, выполнен по результатам десяти клинических исследований с участием 70 573 пациентов с СД 2 типа. Применение фиксированной комбинации ассоциировалось с более низким уровнем HbA1c. Средняя разница по данному показателю между группами составила -0,53% (95%-ный доверительный интервал -0,78–-0,28, р < 0,0001) [15].
Какие группы препаратов возможно комбинировать?
В ряде клинических исследований изучены преимущества и недостатки бигуанидов, производных сульфонилмочевины, тиазолидиндионов и инсулина. Возможность комбинации лекарственных средств трех последних групп ограничена из-за риска увеличения массы тела (производные сульфонилмочевины, тиазолидиндионы и инсулин), гипогликемии (производные сульфонилмочевины и инсулин), истощения бета-клеток (производные сульфонилмочевины) [16]. Предпочтительной может оказаться комбинация с агонистами рецепторов ГПП-1 и ингибиторами ДПП-4. Обе группы препаратов увеличивают концентрацию ГПП-1 и таким образом влияют на многие патогенетические механизмы СД 2 типа [17].
Когда следует назначать комбинированную терапию?
Учитывая сложный патогенез СД 2 типа, двухкомпонентная сахароснижающая терапия показана пациентам с уровнем HbA1c более 7,6%.
Метформин
Метформин – сенситайзер инсулина в большей степени в печени и в меньшей – в мышечной и жировой тканях [18]. Как было сказано выше, его действие преимущественно направлено на ингибирование глюконеогенеза в печени [19]. Метформин способен снижать абсорбцию глюкозы в кишечнике и увеличивать эндогенные уровни ГПП-1 [20], что приводит к уменьшению постпрандиальной гликемии.
Молекулярный механизм метформина до конца не изучен. На сегодняший день установлено, что он влияет на клеточные мембраны, воздействует на окисление дыхательной цепи и активацию аденозинмонофосфат-зависимой протеинкиназы [18].
Повышение чувствительности периферических тканей к инсулину под влиянием метформина реализуется через ряд клеточных механизмов. Повышаются количество и аффинность рецепторов инсулина. Происходит стимуляция тирозинкиназной активности рецепторов инсулина, а также экспрессии и активности транспортеров глюкозы, их транслокация из внутриклеточного пула на клеточную мембрану. В результате поглощение глюкозы органами – мишенями инсулина (печенью, мышечной и жировой тканями) увеличивается, усиливается синтез гликогена в печени.
Метформин также способен влиять на жировой обмен [21]. Повышение концентрации свободных жирных кислот наблюдается у большинства больных СД 2 типа. На фоне метформина окисление свободных жирных кислот уменьшается на 10–30%, что приводит к улучшению чувствительности тканей к инсулину и коррекции его секреции [22].
Стандартный метформин быстрого высвобождения (БВ) требует двукратного приема в сутки. Такая терапия может плохо переноситься из-за развития неблагоприятных эффектов со стороны желудочно-кишечного тракта (ЖКТ). Метформин медленного высвобождения (МВ), или лонг, принимается один раз в день, поэтому характеризуется меньшей частотой нежелательных реакций со стороны ЖКТ. Фармакокинетика двух форм метформина представлена на рис. 4.
В когортном исследовании, продолжавшемся 52 недели, проанализированы 310 карт больных, получавших метформин МВ, и 158 карт больных, получавших метформин БВ [23]. Обе группы включали пациентов, принимавших указанный препарат в качестве первой линии не более двух лет до начала исследования.
Предыдущий опыт побочных эффектов на фоне применения метформина БВ не препятствовал включению больных в исследование. Однако из него исключались пациенты с серьезными заболеваниями ЖКТ, умеренной или тяжелой печеночной или почечной недостаточностью.
Первичными конечными точками стали общая частота желудочно-кишечных нежелательных явлений и частота диареи.
С метформина БВ на метформин МВ было переведено 205 пациентов. Общая частота желудочно-кишечных нежелательных реакций при применении метформина БВ составила 26,34%, после перехода на метформин МВ – 11,71%. Частота диареи сократилась с 18,05 до 8,29%. Статистически значимого различия в суточных дозах препаратов в обеих группах не зафиксировано.
В другое исследование было включено 253 пациента европеоидной расы с СД 2 типа, не достигших целевого показателя HbA1c (> 7,0 и < 8,5%) на диетотерапии [24]. Больных рандомизировали на две группы: первая получала метформин БВ, вторая – метформин МВ. Препараты назначались в максимально переносимой дозе: средняя доза метформина БВ – 2000 ± 1000 мг/сут, метформина МВ – 1000 ± 500 мг/сут.
Оценивались масса тела, уровень HbA1c, глюкозы плазмы натощак и постпрандиально, инсулина плазмы натощак (ИПН), индекс инсулинорезистентности (НОМА-IR), липидный профиль, значения отдельных адипоцитокинов (фактора некроза опухоли альфа (ФНО-альфа), высокочувствительного С-реактивного белка (СРБ), висфатина, васпина), а также удовлетворенность лечением.
Через шесть месяцев в обеих группах отмечено сопоставимое снижение массы тела и индекса массы тела, однако показатели гликемического контроля, НОМА-IR в группе метформина МВ были достоверно лучше. В группе метформина МВ также зафиксировано достоверное снижение значений общего холестерина и липопротеинов низкой плотности. Кроме того, у принимавших метформин МВ были снижены уровни ФНО-альфа, СРБ, васпина и повышен уровень висфатина.
Результаты фармакоэкономического анализа свидетельствуют, что с позиций эффективности и безопасности, влияния на качество жизни, затрат на лечение СД 2 типа и его осложнений перевод пациентов с метформина БВ на метформин МВ предпочтителен. Терапия метформином МВ ассоциировалась с лучшим контролем гликемического профиля, что в долгосрочной перспективе позволит сократить частоту осложнений. Кроме того, она характеризовалась меньшей частотой нежелательных реакций со стороны ЖКТ. Эти факторы опосредованно и в совокупности с лучшим контролем над массой тела были отражены в виде интегрального показателя эффективности [25].
Ситаглиптин
Ингибиторы ДПП-4, известные как глиптины (ситаглиптин, вилдаглиптин, саксаглиптин, линаглиптин и алоглиптин), представляют собой относительно новую группу ПССП.
Первым и наиболее изученным представителем данного класса является ситаглиптин (Янувия®).
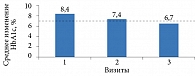
В отечественной многоцентровой наблюдательной программе «Диа-Да» проанализированы результаты в отношении 923 больных СД 2 типа с неудовлетворительным контролем гликемии (HbA1c > 7%), исходно не получавших медикаментозную терапию (14%) и получавших метформин в дозе 1000–2000 мг/сут (86%). На момент включения в программу уровень HbA1c составлял 8,4%. При этом у 50% пациентов он достигал 7–8%, у 27% – 8–9%, у 14% – 9–10%, у 9% больных – более 10% [26].
Через шесть месяцев комбинированной терапии ситаглиптином и метформином отмечалось достоверное снижение уровня HbA1c – в среднем на 1,7% (с 8,4 до 6,7%) (рис. 5).
В связи с высокой сердечно-сосудистой смертностью среди больных СД 2 типа особенно важна сердечно-сосудистая безопасность сахароснижающей терапии.
Сердечно-сосудистые исходы при применении ситаглиптина оценивались в крупнейшем рандомизированном клиническом исследовании TECOS. Оно было призвано показать, что риск сердечно-сосудистых событий у пациентов, получавших ситаглиптин в дополнение к стандартной терапии, не превышает таковой у пациентов, принимавших стандартную терапию [27].
В исследование включен 14 761 пациент с СД 2 типа. В группу терапии ситаглиптином рандомизированы 7332 больных в возрасте 65,4 ± 7,9 года, среди них женщин – 2134 (29,1%). Группа сравнения была сопоставима по указанным характеристикам.
Анализ результатов по первичной комбинированной конечной точке продемонстрировал отсутствие статистически значимых различий между группами. Кроме того, было отмечено, что добавление ситаглиптина к стандартной терапии не приводит к повышению риска развития сердечно-сосудистых осложнений.
Особый интерес представлял анализ результатов исследования TECOS по одной из вторичных конечных точек – частоте госпитализаций по причине сердечной недостаточности, поскольку в исследовании EXAMINE отмечена тенденция к увеличению данного показателя (на 19%), в исследовании SAVOR-TIMI – достоверное увеличение (на 27%).
В исследовании TECOS как в отношении частоты госпитализаций по поводу сердечной недостаточности, так и в отношении частоты сердечно-сосудистой смерти различий между группами не зафиксировано.
Таким образом, полученные результаты дают основание предположить, что ситаглиптин обладает хорошим профилем сердечно-сосудистой безопасности.
Фиксированная комбинация ситаглиптина и метформина МВ
Новый препарат Янумет® Лонг представляет собой фиксированную комбинацию метформина МВ и ингибитора ДПП-4 ситаглиптина.
Янумет® Лонг показан пациентам с СД 2 типа в качестве стартовой терапии и для интенсификации моно- или комбинированной терапии. Рекомендуемый режим приема – один раз в сутки во время еды вечером.
Заключение
Учитывая комплементарные механизмы действия ситаглиптина и метформина МВ, применение фиксированной их комбинации (препарат Янумет® Лонг) будет способствовать уменьшению гликемии и достижению целевых показателей HbA1c у пациентов с СД 2 типа. Кроме того, такая комбинация потенциально может снижать частоту побочных реакций со стороны ЖКТ и улучшать приверженность пациентов терапии вследствие удобного режима приема (один раз в сутки). Как следствие, повысятся шансы на более успешное управление заболеванием.
A.M. Mkrtumyan
A.I. Evdokimov Moscow State University of Medicine and Dentistry
A.S. Loginov Moscow Clinical Research Center
Contact person: Ashot Musaelovich Mkrtumyan, vagrashot@mail.ru
Diabetes mellitus type 2 in the prevalence and development of severe complications represents a threat to life in no less degree than AIDS. By developing the most formidable and frequent complications, diabetes mellitus is a leading pathology. Complications of diabetes often lead to blindness, amputation, hemodialysis, and coronary artery bypass grafting. Their development can be prevented by optimal glycemic control. It is not enough to prescribe effective hypoglycemic drugs, the patients should as well have high adherence to treatment. It can be increased by the reduction in the frequency of drugs application.
The article discusses the possibility of fixed combination of slow release Metformin and 4-sitagliptin dipeptidyl peptidase inhibitor concerning not only the improvement of the effectiveness of therapy, but as well the adherence to it.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.