количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Обзоры
Афатиниб – первый селективный необратимый ингибитор семейства ErbB
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Онкология, гематология и радиология." № 2 (37)
- Аннотация
- Статья
- Ссылки
- English
Афатиниб является селективным необратимым ингибитором протеинкиназы рецепторов семейства ErbB. Он блокирует передачу сигналов от гомо- и гетеродимеров, образованных рецепторами ErbB: EGFR (ErbB1), HER2 (ErbB2), ErbB3, ErbB4. В России афатиниб зарегистрирован в качестве препарата монотерапии местнораспространенного или метастатического немелкоклеточного рака легкого с мутациями EGFR у пациентов, ранее не получавших ингибиторов тирозинкиназы EGFR.
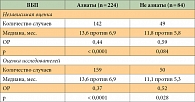
Таблица 1. Показатель ВБП на фоне терапии афатинибом по сравнению с цисплатином/пеметрекседом у пациентов с частыми мутациями EGFR в группе азиатов/не азиатов
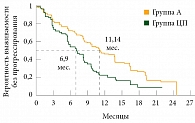
Рис. 1. Выживаемость без прогрессирования на фоне терапии афатинибом и цисплатином/пеметрекседом в качестве препаратов первой линии у больных распространенной аденокарциномой легкого с активирующими мутациями EGFR (исследование LUX-Lung 3)
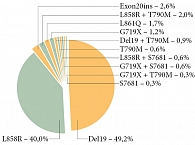
Рис. 2. Мутации, выявленные у пациентов в исследовании LUX-Lung 3
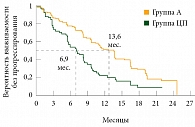
Рис. 3. Выживаемость без прогрессирования в подгруппе с частыми мутациями (Del19 и L858R) на фоне терапии афатинибом и цисплатином/пеметрекседом в качестве препаратов первой линии у больных распространенной аденокарциномой легкого (исследование LUX-Lung 3
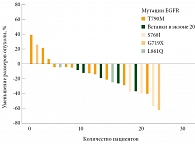
Рис. 4. Уменьшение размеров опухоли в результате терапии афатинибом в исследовании LUX-Lung 3
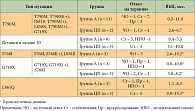
Таблица 2. Ответ на проводимую терапию афатинибом (А) или цисплатином/пеметрекседом (ЦП) у пациентов с редкими мутациями

Рис. 5. Время до ухудшения симптомов заболевания на фоне терапии афатинибом и цисплатином/пеметрекседом в качестве препаратов первой линии у больных распространенной аденокарциномой легкого (исследование LUX-Lung 3)

Таблица 3. Наиболее частые побочные явления 3-й и 4-й степени токсичности у пациентов, принимавших афатиниб, в подгруппе азиатов/не азиатов, %
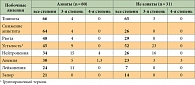
Таблица 4. Наиболее частые побочные явления 3-й и 4-й степени токсичности у пациентов, принимавших цисплатин и пеметрексед, в подгруппе азиатов/не азиатов, %
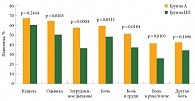
Рис. 6. Улучшение симптомов основного заболевания на основании результатов опроса пациентов на фоне терапии афатинибом и цисплатином/пеметрекседом в качестве препаратов первой линии у больных распространенной аденокарциномой легкого (исследование LUX-Lung
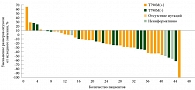
Рис. 7. Зависимость роста опухоли от EGFR-сигнальной функции после возникновения резистентности к гефитинибу или эрлотинибу
В США рак легкого (РЛ) является второй по распространенности локализацией среди онкологических заболеваний. Немелкоклеточный рак легкого (НМРЛ) составляет примерно 85% всех видов рака легкого. При этом 10–15% белого населения и 40% азиатов с НМРЛ имеют мутации EGFR, 90% которых приходятся на Del19 и L858R [1, 2]. В России РЛ в ряду онкологических заболеваний занимает первое место среди мужчин и девятое среди женщин [3].
Афатиниб
Афатиниб является селективным необратимым ингибитором протеинкиназы рецепторов семейства ErbB. Он блокирует передачу сигналов от гомо- и гетеродимеров, образованных рецепторами ErbB: EGFR (epidermal growth factor receptor – рецептор эпидермального фактора роста) (ErbB1), HER2 (ErbB2), ErbB3, ErbB4.
Афатиниб под торговым названием Гиотриф зарегистрирован в России в качестве препарата для монотерапии местнораспространенного рака легкого или метастатического НМРЛ с мутацией (мутациями) EGFR у пациентов, ранее не получавших ингибиторы тирозинкиназы EGFR. В Европе препарат зарегистрирован под тем же названием для больных с активирующими мутациями EGFR. В США этот препарат выпущен на рынок под названием Gilotrif. Препарат применяется в первой линии терапии у больных с делецией в экзоне 19 (Del 19) или мутацией L858R в экзоне 21.
Исследование III фазы LUX-Lung 3
Регистрационным для афатиниба стало рандомизированное исследование III фазы LUX-Lung 3. В ходе работы сравнивалось действие афатиниба и цисплатина/пеметрекседа в качестве препаратов первой линии у больных распространенной аденокарциномой легкого с активирующими мутациями EGFR.
Было рандомизировано 345 больных в соотношении 2:1 в группы терапии афатинибом в дозе 40 мг в сутки перорально или цисплатином в дозе 75 мг/м² и пеметрекседом в дозе 500 мг/м² внутривенно один раз в 21 день до шести циклов.
Медиана выживаемости без прогрессирования (ВБП) у пациентов, получавших афатиниб (группа А, n = 230), составила 11,1 месяца, у пациентов, получавших цисплатин с пеметрекседом (группа ЦП, n = 115), – 6,9 месяца (отношение рисков (ОР) составило 0,58 при 95%-ном доверительном интервале (ДИ) 0,43–0,78, р = 0,0004) (рис. 1).
Однолетняя выживаемость была достигнута у 47 и 22% пациентов соответственно.
Анализ данных продемонстрировал улучшение показателя ВБП во всех группах, за исключением больных, которые продолжали курить или прекратили курение менее чем за год (79 больных). В данной группе пациентов ОР составило 1,04 (95% ДИ 0,54–1,98).
Исследователи оценили показатель ВБП в разных подгруппах. В подгруппе пациентов с курением в анамнезе было выделено три группы: никогда не курившие, курившие < 15 пачко-лет + прекратившие курение менее чем за год до исследования, продолжающие курить или бывшие курильщики. Поскольку p = 0,09, можно сделать вывод, что улучшение показателя ВБП не связано с наличием/отсутствием в анамнезе курения.
При анализе показателя ВБП в подгруппе больных с мутациями было установлено, что наиболее распространенными мутациями являются мутация Del19 у 170 (49,2%) пациентов и L858R – у 138 (40,0%) пациентов (рис. 2).
В когорте больных с типичными мутациями разница результатов была более выраженной: медиана ВБП в группе А (n = 204) составила 13,6 месяца, в группе ЦП (n = 104) – 6,9 месяца (ОР 0,47 (95% ДИ 0,34–0,65), р < 0,0001) (рис. 3).
Различался показатель ВБП и в подгруппе азиатов/не азиатов. В таблице 1 представлены результаты независимой оценки и оценки исследователей.
Таким образом, в регистрационном исследовании LUX-Lung 3 была достигнута конечная цель – улучшение медианы ВБП. В группе пациентов с частыми мутациями (90% всех мутаций EGFR) она составила 13,6 месяца [4, 5].
Приводим выписку из истории болезни пациентки с мутацией Del19, лечившейся афатинибом.
Пациентка Д., 58 лет, некурящая.
Диагноз: аденокарцинома левого легкого IIIB стадии.
Декабрь 2009 г. – левосторонняя пульмонэктомия с резекцией перикарда и диафрагмального нерва, послеоперационная лучевая терапия в суммарной дозе 40 г.
В октябре 2010 г. отмечено прогрессирование процесса – появление метастазов в лимфоузлах средостения и правом легком.
При иммуногистохимическом исследовании послеоперационного материала выявлена мутация EGFR (Del19).
С 3 ноября 2010 г. начато лечение афатинибом в дозе 40 мг в день.
В связи с нарастающей кожной токсичностью 2-й степени (высыпания, зуд, паронихия) с 12 по 16 февраля 2011 г. был перерыв в приеме афатиниба, больная получала доксициклин и местно Тридерм®. С 17 февраля 2011 г. по 4 апреля 2013 г. получала афатиниб в дозе 30 мг в сутки.
Через девять недель после начала приема афатиниба достигнута полная регрессия всех проявлений, которая сохраняется по настоящее время (более трех лет).
Исследование показало, что и при редких мутациях сохраняется возможность получения эффекта от приема афатиниба. Это продемонстрировал дополнительный анализ исследования LUX-Lung 3.
Группа пациентов с редкими мутациями была незначительной – 37 (11%) пациентов и генетически разнородной: десять молекулярных подтипов, в том числе мутации Т790М, вставки в экзоне 20, S7861, G719X и L8610, а также комбинации мутаций.
У всех пациентов наблюдался ответ на терапию афатинибом и/или длительный контроль заболевания (табл. 2, рис. 4) [6].
Наиболее частыми побочными реакциями в группе А были диарея (95% случаев), сыпь/акне (89%) и паронихия (57%), в группе ЦП – тошнота (66% случаев), снижение аппетита (53%), утомляемость (47%) и рвота (42%). У 8% больных в группе А лечение было отменено из-за побочных явлений, у 1% – из-за диареи и у 12% пациентов – в группе химиотерапии. Почти все побочные реакции были более выраженными у пациентов-азиатов (табл. 3 и 4) [4, 5, 7].
Показатель объективного эффекта (ОЭ) при оценке всех пациентов в группе А составил 56%, в группе ЦП – 23%. Устойчивое улучшение (стабилизация и отсутствие прогрессирования заболевания) наблюдалось у 90% больных группы А и у 81% группы ЦП. Улучшение симптомов болезни (кашель, одышка, затруднение дыхания, боль) было более выраженным при приеме афатиниба. Риск ухудшения симптомов при приеме афатиниба по сравнению с приемом ЦП составлял: кашель ОР 0,60 (95% ДИ 0,41–0,87, р = 0,007), одышка ОР 0,68 (95% ДИ 0,50–0,93, р = 0,01), боль ОР 0,83 (95% ДИ 0,62–1,10, р = 0,19).
Медиана времени до ухудшения симптомов заболевания представлена на рис. 5 [8, 9].
Оценка качества жизни продемонстрировала лучшие показатели в группе А (р = 0,0269) [7]. Процент пациентов с улучшением симптомов также был выше в группе А (рис. 6) [8, 9].
Другие исследования препарата
Программы исследования афатиниба включают в себя и другие протоколы:
- LUX Lung 1 IIb/III фаза: афатиниб + BSC (Best supportive care – наилучшее симптоматическое лечение) против BSC у больных, ранее получавших химиотерапию и гефитиниб или эрлотиниб;
- LUX Lung 2 II фаза: афатиниб при НМРЛ с мутациями EGFR или в качестве первой линии, или после первой линии химиотерапии;
- LUX-Lung 4 I/II фаза: афатиниб при НМРЛ после прогрессирования на ингибиторах тирозинкиназы (ИТК) EGFR;
- LUX-Lung 5 III фаза: афатиниб при НМРЛ, который лечили гефитинибом или эрлотинибом;
- LUX-Lung 6 III фаза: эффективность и переносимость афатиниба по сравнению с эффективностью стандартной химиотерапии первой линии при НМРЛ с мутациями EGFR;
- LUX-Lung 7 IIb фаза: афатиниб по сравнению с гефитинибом в первой линии терапии НМРЛ с мутациями EGFR;
- LUX-Lung 8 III фаза: афатиниб по сравнению с эрлотинибом во второй линии терапии плоскоклеточного рака легкого [10].
Исследование LUX-Lung 6 (эффективность афатиниба по сравнению с эффективностью химиотерапии (цисплатин + гемцитабин) у пациентов-азиатов с распространенным НМРЛ и активирующими мутациями EGFR) подтвердило эффективность афатиниба в отношении показателя ВБП. Ранее нелеченые пациенты с НМРЛ IIIВ–IV стадии с активирующими мутациями EGFR были рандомизированы в группу афатиниба (n = 242) – препарат принимался перорально в дозе 40 мг сутки и группу химиотерапии (n = 122) – гемцитабин в дозе 1000 мг/м² в 1-й и 8-й день и цисплатин в дозе 75 мг/м² в 1-й день трехнедельного цикла (до шести циклов). Лечение продолжалось до прогрессирования заболевания, развития непереносимых токсических эффектов или отказа пациента. Медиана ВБП была достоверно больше в группе А – 11 месяцев (95% ДИ 9,7–13,7) против 5,6 месяца (95% ДИ 5,1–6,7). Отношение рисков составило 0,28 (95% ДИ 0,20–0,39), p < 0,0001 [11].
Недавно были представлены первые данные по общей выживаемости (ОВ). Анализ показателя ОВ в исследованиях LUX-Lung 3 и LUX-Lung 6 в группе наиболее частых мутаций включал 631 из 709 пациентов. Мутация Del19 диагностирована у 355 больных, L858R – у 276. Афатиниб получали 419 пациентов, химиотерапию – 212. После начала прогрессирования процесса у 78% пациентов была назначена системная терапия: 68% пациентов в группе химиотерапии получали ингибиторы тирозинкиназы, 70% пациентов в группе А получали химиотерапию. Показатель ОВ был достоверно выше в группе А против группы химиотерапии – медиана ОВ 27,3 месяца против 24,3 месяца соответственно, ОР 0,81 (95% ДИ 0,66–0,99), р = 0,037 [12].
Существует мнение, что прием афатиниба может быть связан с большей эффективностью и более длительным сохранением эффекта по сравнению с приемом гефитиниба и эрлотиниба, особенно в отношении больных НМРЛ с частыми мутациями. Однако это требует дополнительных исследований.
Так, в исследовании LUX-Lung 2 афатиниб назначали в дозе 50 или 40 мг в сутки пациентам с НМРЛ IIIB–IV стадии (мутации EGFR) в качестве препарата первой линии или после прогрессирования на первой линии химиотерапии и неоадъювантной или адъювантной химиотерапии. В исследовании участвовало 129 больных: 61 пациент получал лечение первой линии, 68 – второй линии. По оценке независимой группы экспертов, ОЭ был отмечен у 61% пациентов, контроль болезни (без прогрессирования) – у 82%. У больных с частыми мутациями (Del19 и L858R) ОЭ и контроль болезни составили 66 и 88% случаев соответственно по сравнению с больными, у которых диагностированы другие мутации EGFR, – 39 и 56% случаев соответственно.
Медиана ВБП, по оценке исследователей, у всех пациентов составила 13,7 месяца: у пациентов с мутацией Del19 – 15,5 месяца, с мутацией L858R – 15,8 месяца, у 23 больных с другими мутациями – 4,6 месяца. Медиана ВБП при применении афатиниба как средства первой линии составила 15,6 месяца. Наиболее частыми осложнениями были диарея и сыпь. Больным с начальной дозой афатиниба 50 мг (n = 65) потребовалось снижение дозы до 40 мг, 34 из них в дальнейшем доза была снижена до 30 мг.
Среди пациентов с начальной дозой 40 мг у 11 (37%) пациентов доза была снижена до 30 мг. Лечение 8,5% пациентов было отменено из-за токсичности [10].
Больные с мутациями EGFR, которые получали ингибиторы тирозинкиназы, как правило, имели более длительные ремиссии или стабилизации, чем больные, получавшие химиотерапию. Однако, после того как процесс начал прогрессировать, у них наблюдался положительный ответ на терапию тем же или другим препаратом, что указывало на сохраняющуюся зависимость от мутации EGFR. Поэтому применение афатиниба после гефитиниба или эрлотиниба представляет особый интерес.
Известно, что резистентность к ингибиторам тирозинкиназы связана с мутацией Т790М [13, 14], а афатиниб в доклинических исследованиях показал эффективность на таких моделях. Это явилось основанием для проведения исследования LUX-Lung 1: применение афатиниба при прогрессировании аденокарциномы легкого после первой или второй линии химиотерапии и спустя 12 недель и более после лечения гефитинибом или эрлотинибом. Оказалось, что добавление афатиниба к симптоматическому лечению не улучшило показатель ОВ. Однако значительно повысился показатель ВБП (ОР 0,38) и на два месяца увеличилась медиана ВБП [15].
Наиболее показательны результаты преодоления приобретенной резистентности к ингибиторам тирозинкиназы, полученные при изучении эффективности комбинации афатиниба и цетуксимаба. У животных (мыши) с мутацией Т790М было показано, что комбинация афатиниба и цетуксимаба приводит к регрессии заболевания, близкой к полной регрессии [16]. В связи с этим в США и Нидерландах было проведено исследование Ib-фазы для определения максимально переносимой дозы у больных с приобретенной резистентностью к гефитинибу или эрлотинибу и выработки рекомендаций режима для II фазы. Предполагались проведение повторной биопсии опухоли после неэффективного лечения гефитинибом или эрлотинибом, оценка по данным обследования 40 больных с мутацией Т790М(+) и Т790М(-) в каждой группе.
Афатиниб был назначен в дозе 40 мг в сутки, цетуксимаб – в дозе 500 мг/м² каждые две недели. Побочные эффекты терапии – диарея 3-й степени – наблюдались у 6% больных.
Более чем у 90% больных были отмечены клиническое улучшение и повышение ОЭ, которые были зарегистрированы и при мутации Т790М(+), и при мутации Т790М(-) в 40% случаев. Эти данные подтверждали зависимость роста опухоли от EGFR-сигнальной функции даже после возникновения резистентности к гефитинибу или эрлотинибу (рис. 7). Данные по ОВ еще не опубликованы [17].
В исследовании II фазы LUX-Lung 4 (Япония) афатиниб применяли у пациентов, заболевание которых прогрессировало спустя 12 и более недель после лечения гефитинибом или эрлотинибом или их комбинацией. В ходе работы оценили 61 больного. У 5 (8,2%) пациентов был достигнут подтвержденный ОЭ (частичный ответ) и у 35 (57,4%) – стабилизация процесса по крайней мере на шесть недель. Клиническая эффективность (частичный ответ + стабилизация) составила 65,6% случаев и была отмечена у 40 больных. Большинство эффектов развилось в течение восьми недель терапии афатинибом. В среднем ответ на лечение был получен на 24,4 недели. Показано, что с приемом афатиниба связано уменьшение таргетных опухолевых очагов у 79% больных, а у 16% больных более чем на 30%. Однако уменьшение размеров очагов продолжалось не более четырех недель у четырех из девяти больных. Медиана ВБП – 4,4 месяца. Медиана ОВ – 19 месяцев [18].
В заключение следует отметить, что афатиниб является еще одним ингибитором мутации EGFR и первым необратимым ингибитором тирозинкиназы с возможно неполной перекрестной резистентностью к двум предыдущим средствам этой группы. Препарат показал свою эффективность у больных НМРЛ с мутациями EGFR. Было также доказано, что афатиниб значительно увеличивает вероятность ВБП.
Изучение эффективности афатиниба при НМРЛ, а также при других опухолях продолжается.
1. Cancer Facts & Figures 2012. American Cancer Society. 2012.
2. Yu J., Kane S., Wu J. et al. Mutation-specific antibodies for the detection of EGFR mutations in non-small-cell lung cancer // Clin. Cancer Res. 2009. Vol. 15. № 9. P. 3023–3028.
3. Вестник РОНЦ им. Н.Н. Блохина РАМН. Т. 22. № 3. Прил. 1. 2011.
4. Sequist L V., Schuler M., Yamamoto N. et al. LUX-Lung 3: a randomized, open-label, phase III study of afatinib vs pemetrexed and cisplatin as first-line treatment in patients with advanced adenocarcinoma of the lung harbouring an epidermal growth factor receptor activating mutation // J. Thorac. Oncol. 2012. Vol. 7. № 9. Suppl. 4.
5. Mok T., Schuler M., Yamamoto N. et al. LUX-Lung 3: afatinib versus cisplatin and pemetrexed in Asian patients with adenocarcinoma of the lung harbouring an epidermal growth factor receptor mutation. APLCC-ITMIG 2012, 5th Asia Pacific Lung Cancer Conf and 3rd Ann Mtg of the International Thymic Malignancy Interest Group, Fukuoka // J. Thorac. Oncol. 2012. Vol. 7. № 11. Suppl. 5.
6. Yang J.C. LUX-Lung 3: a randomized, open-label, phase III study of afatinib vs cisplatin/pemetrexed as 1st-line treatment for patients with advanced adenocarcinoma of the lung harboring EGFR-activating mutations // 48th Ann Mtg of the American Society of Clinical Oncology. Chicago, 2012.
7. Sequist L.V., Yang J.C., Yamamoto N. Phase III study of afatinib or cisplatin plus pemetrexed in patients with metastatic lung adenocarcinoma with EGFR mutations // J. Clin. Oncol. 2013. Vol. 31. № 27. P. 3327–3334
8. Sequist L.V., Schuler M., Yamamoto N. et al. LUX-LUNG 3: symptom and health-related quality of life results from a randomized phase III study in 1 st-line advanced NSCLC patients harbouring EGFR mutations // Ann Oncol. 2012. Vol. 23. Suppl. 9.
9. Yang J.C., Hirsh V., Schuler M. et al. Symptom control and quality of life in LUX-Lung 3: a phase III study of afatinib or cisplatin/pemetrexed in patients with advanced lung adenocarcinoma with EGFR mutations // J. Clin. Oncol. 2013. Vol. 31. № 27. P. 3342–3350.
10. www.clinicaltrials.gov.
11. Wu Y.L., Zhou C., Hu C.P. et al. Afatinib versus cisplatin plus gemcitabine for first-line treatment of Asian patients with advanced non-small-cell lung cancer harbouring EGFR mutations (LUX-Lung 6): an open-label, randomised phase 3 trial // Lancet Oncol. 2014. Vol. 15. № 2. P. 213–222.
12. Yang J.C. Overall survival (OS) in patients (pts) with advanced non-small cell lung cancer (NSCLC) harboring common (Del19/L858R) epidermal growth factor receptor mutations (EGFR mut): Pooled analysis of two large open-label phase III studies (LUX-Lung 3 [LL3] and LUX-Lung 6 [LL6]) comparing afatinib with chemotherapy (CT) // J. Clin. Oncol. 2014. Vol. 32.
13. Kobayashi S., Boggon T.J., Dayaram T. et al. EGFR mutation and resistance of non-small-cell lung cancer to gefitinib // N. Engl. J. Med. 2005. Vol. 352. № 8. P. 786–792.
14. Pao W., Miller V.A., Politi K.A. et al. Acquired resistance of lung adenocarcinomas to gefitinib or erlotinib is associated with a second mutation in the EGFR kinase domain // PLoS Med. 2005. Vol. 2. № 3.
15. Miller V.A. Phase iib/iii double-blind randomized trial of afatinib (BIBW 2992, an irreversible inhibitor of egfr/herl and her2) + best supportive care (bsc) versus placebo + bsc in patients with nsclc failing 1-2 lines of chemotherapy and erlotinib or gefitinib (lux-Lung 1) [abstract LBAl] // Ann Oncol. 2010. Vol. 21. Suppl. 8.
16. Regales L., Gong Y., Shen R. et al. Dual targeting of EGFR can overcome a major drug resistance mutation in mouse models of EGFR mutant lung cancer // J. Clin. Invest. 2009. Vol. 119. № 10. P. 3000–3010.
17. Janjigian Y.Y., Groen H.J., Horn L. et al. Activity and tolerability of afatinib (BIBW 2992) and cetuximab in NSCLC patients with acquired resistance to erlotinib or gefitinib // J. Clin. Oncol. 2011. Vol. 29. Suppl. Abstr. 7525.
18. Katakami N., Atagi S., Goto K. et al. LUX-Lung 4: a phase II trial of afatinib in patients with advanced non-small-cell lung cancer who progressed during prior treatment with erlotinib, gefitinib, or both // J. Clin. Oncol. 2013. Vol. 31. № 27. P. 3335–3341.
Afatinib – the first selective irreversible inhibitor of the ErbB family
V.A. Gorbunova
N.N. Blokhin Russian cancer research center
Contact person: Vera Andreyevna Gorbunova, veragorbounova@mail.ru
Afatinib is a selective irreversible protein kinase inhibitor of the ErbB family receptors. ErbB receptors function as homo- and geterodimers consisting of EGFR (ErbB1), HER2 (ErbB2), ErbB3, ErbB4. Afatinib blocks ErbB receptor signalling. In Russia, afatinib was approved for monotherapy of EGFR mutation-positive locally-advanced or metastatic non-small cell lung cancer in patients not treated by EGFR tyrosine kinase inhibitors.
Новости на тему
21.07.2022
24.05.2022 13:00:00
03.12.2021
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.