Актовегин в лечении неврологических осложнений сахарного диабета
- Аннотация
- Статья
- Ссылки
- English
Актовегин относится к биологическим препаратам. Это высокоочищенный гемодиализат крови телят, получаемый методом двойной ультрафильтрации. В состав препарата входят более 200 низкомолекулярных соединений (весом менее 5000 дальтон), что исключает развитие прионных болезней, например болезни Крейтцфельдта – Якоба, при внутривенном введении. Кроме того, технология получения Актовегина исключает наличие белковых компонентов, обладающих антигенными и пирогенными свойствами.
Препарат представляет собой смесь неорганических (электролиты – натрий, калий, кальций, магний, хлориды, соединения азота) и органических (ацетат, лактат, аминокислоты, нуклеозиды, гликосфинголипиды, инозитолфосфоолигосахариды, промежуточные продукты углеводного и жирового обмена, антиоксидантные ферменты) веществ.
Особенности производства и механизмы действия Актовегина детально обсуждаются в ряде обзоров, один из которых посвящен почти полувековой истории препарата [1, 2].
Точные данные о фармакокинетике Актовегина отсутствуют, так как это многокомпонентный препарат и в его состав входят вещества, исходно содержащиеся в организме человека.
Установлено, что Актовегин обладает плейотропным действием. Одни эффекты органонеспецифические, другие – дозозависимые.
Считается, что инсулиноподобный эффект Актовегина и стимуляция метаболизма глюкозы связаны с инозитолфосфоолигосахаридами. Актовегин активирует транспорт глюкозы внутрь клетки посредством глюкозных транспортеров 1 и 4, не взаимодействуя при этом с рецепторами к инсулину, что важно для больных сахарным диабетом (СД) типа 2 [3]. Активация захвата глюкозы клетками начинается через 5 минут после внутривенного введения препарата, пик действия достигается через 120 минут.
Антигипоксантный эффект препарата обусловлен способностью увеличивать поглощение тканями кислорода. Показано, что на фоне терапии Актовегином потребление кислорода клетками возрастает почти на 40% [4]. В результате повышается образование макроэргических фосфатов (аденозинтрифосфата, аденозиндифосфата (АДФ), активируются ферменты окислительного фосфорилирования, ускоряются синтез углеводов и белков и распад продуктов анаэробного гликолиза (лактата), уменьшается энергетический клеточный дисбаланс.
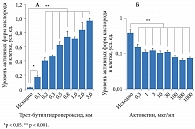
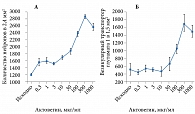
Актовегин также обладает выраженным антиоксидантным эффектом, определяющим его нейропротективное действие [5]. Показано, что у пациентов с сердечно-сосудистой недостаточностью Актовегин снижает образование активных форм кислорода, причем данный эффект носит дозозависимый характер [6]. Дозозависимое уменьшение апоптотической гибели нейронов, вызванной гидропероксидом водорода, выявлено в эксперименте на культуре нейронов (рис. 1) [7]. В другом исследовании M.W. Еlmlinger и соавт. Актовегин уменьшал апоптоз (по активности каспазы 3), увеличивал число синаптических связей и дозозависимо уменьшал оксидантный стресс в нейронах [7] (рис. 2). В работе A. Dieckmann и соавт. показано, что Актовегин улучшает проведение возбуждения по чувствительным волокнам и снижает апоптоз в волокнах седалищного нерва в результате уменьшения активности поли(АДФ-рибоза)полимеразы. Следовательно, препарат способен влиять на механизмы повреждения клеток при СД [8, 9].
В ряде работ изучалось влияние Актовегина на микрососудистый эндотелий. Так, в пилотном исследовании А. Федоровича и соавт. с участием 28 здоровых добровольцев показано, что Актовегин обладает прямым эндотелиопротективным действием на уровне микрососудистого русла [10]. Полученные результаты в дальнейшем подтвердились у пациентов с облитерирующими заболеваниями артерий нижних конечностей, а также с артериальной гипертензией [11, 12].
Вышеописанные механизмы определяют возможность применения Актовегина при различных заболеваниях и состояниях, включая хроническую ишемию головного мозга, диабетическую полинейропатию, заболевания периферических артерий и вен.
Среди нежелательных явлений на фоне применения Актовегина указываются редкие аллергические реакции. Описан только один случай анафилактического шока с дальнейшим поражением печени и почек – препарат был введен спортсмену внутривенно [13]. Возможная причина – нарушение норм применения препарата.
Использование Актовегина при различных неврологических заболеваниях описано в ряде обзоров [14–17].
На данный момент накоплен большой опыт применения препарата при сосудистых заболеваниях головного мозга и когнитивных нарушениях различной степени тяжести [17]. Так, результаты нейропсихологического тестирования показали, что у лиц пожилого и старческого возраста уже через две недели терапии статистически достоверно улучшились память, внимание и мышление. Зафиксированы также нормализация электроэнцефалограммы и увеличение амплитуды вызванного когнитивного потенциала Р300. Необходимо отметить, что даже однократное введение препарата улучшало электрофизиологические показатели функции головного мозга [18, 19].
В нескольких двойных слепых плацебоконтролируемых рандомизированных исследованиях оценивалось действие Актовегина при пероральном или парентеральном введении у пациентов с легкой или умеренной степенью деменции. Пероральный прием двух драже Актовегина три раза в день в течение восьми недель ассоциировался с достоверным повышением скорости психических процессов [20].
Исследование с участием 120 пациентов с недостаточностью мозгового кровообращения и когнитивным дефицитом показало, что при длительной терапии дисциркуляторной энцефалопатии с синдромом когнитивных нарушений предпочтение следует отдать пероральному приему Актовегина [21]. При парентеральном введении у этой группы больных улучшались когнитивные функции, в первую очередь память и внимание, уменьшалась выраженность аффекта и улучшалась социальная адаптация. Эффективность терапии возрастала с увеличением ее продолжительности (как при сосудистой деменции, так и при болезни Альцгеймера) [22, 23].
Поскольку курс инфузионной терапии Актовегином приводит к более выраженному и быстрому улучшению состояния больных, рекомендуется сначала применять препарат парентерально, затем перорально [24].
Получены данные об использовании Актовегина при заболеваниях периферической нервной системы – сосудистый компонент присутствует при радикулопатии, мононейропатии и полинейропатии.
Так, терапия Актовегином в сочетании с Ксефокамом или индометацином у пожилых пациентов с дискогенной радикулопатией и интенсивным болевым синдромом способствовала более быстрому регрессу последнего по сравнению с терапией только Ксефокамом или индометацином [25]. Катамнестическое исследование показало, что пациентам, получавшим комбинированную терапию, на 43% реже требовалась повторная госпитализация в связи с рецидивом болевого синдрома. Выраженность неврологического дефицита также была значительно ниже среди получавших Актовегин. В этой группе отмечено достоверное улучшение самочувствия, двигательной активности и сна. Был сделан вывод: включение Актовегина в комплексную терапию пожилых пациентов с дискогенной радикулопатией позволяет быстрее купировать болевой синдром, ускорить регресс неврологических нарушений и улучшить самочувствие больных.
Интерес к использованию Актовегина у больных СД вызван тем, что при данном заболевании патология клеток обусловлена и метаболическими нарушениями, и изменением кровотока в системе микроциркуляции [8, 26]. Основные исследования по оценке эффективности Актовегина проведены у пациентов с диабетической дистальной симметричной сенсорно-моторной полинейропатией (ДПН) [27–29]. Причина ее развития – снижение кровотока в эндоневральных сосудах вследствие микроангиопатии. Это еще раз подтверждает, что диабет начинается как болезнь обмена, а заканчивается – как сосудистая патология [26].
Согласно современному представлению о патогенезе ДПН обусловлена оксидантным стрессом, возникающим в результате нарушения метаболизма глюкозы, а также слабостью собственных антиоксидантных систем [8]. Метаболические нарушения приводят к изменению содержания фосфатных энергетических субстратов в цитоплазме клеток. Как следствие, развивается псевдогипоксия. Длительность нарушения углеводного обмена играет основную роль в развитии ДПН [30]. Утолщение сосудистой стенки эндоневральных сосудов и изменение реологических свойств крови приводят к развитию истинной гипоксии. Сказанное подтверждает целесообразность применения Актовегина при ДПН.
Впервые действие Актовегина у больных ДПН изучалось в рамках пилотного контролируемого исследования, проведенного W. Jansen и E. Beck. Основная группа (n = 35) получала Актовегин перорально по 600 мг три раза в день в течение 24 недель, контрольная (n = 35) – плацебо [29]. Критериями оценки эффективности терапии были клинические показатели полинейропатии (сухожильные рефлексы, поверхностная и глубокая чувствительность, интенсивность болевого синдрома) и электромиографические показатели функции периферических нервов (скорость распространения возбуждения (СРВ)), а также расстояние, которое больные могли пройти до появления боли.
В группе Актовегина улучшение состояния отмечено у большинства пациентов через восемь недель терапии, а оптимальный эффект – через 16 недель. Достоверно улучшились практически все клинические показатели (р < 0,01), а также достоверно (p < 0,001) увеличилась СРВ. Пациенты основной группы предъявляли меньше жалоб на нестабильность психоэмоционального состояния.
В открытом исследовании В.А. Яворской и соавт. Актовегин использовали для лечения ДПН у 24 больных СД типов 1 и 2. Режим применения – инфузия один раз в сутки в течение 20 дней [28]. Эффективность терапии оценивалась по клиническим показателям ДПН, результатам исследования периферического кровотока и электромиографии. На фоне терапии Актовегином зафиксировано уменьшение болевого синдрома, улучшение чувствительности и сухожильных рефлексов, увеличение силы мышц. Реовазография показала улучшение кровотока в ногах, электромиография – увеличение амплитуды М-ответа и СРВ при стимуляции нервов ног.
Применение Актовегина в комбинированной терапии у 33 пациентов с синдромом диабетической стопы различной степени тяжести (определяли по классификации F.W. Wagner) способствовало быстрому купированию болевого синдрома и ускорению процессов грануляции и эпителизации язвенных дефектов [31].
В исследовании Ф.Э. Моргоевой и соавт. оценивалась эффективность монотерапии Актовегином у больных СД типа 2 [27]. 30 больных получали Актовегин в дозе 400 мг на 200 мл физиологического раствора один раз в сутки внутривенно капельно в течение трех недель. Длительность СД – не менее десяти лет. Возраст участников – 58,94 ± 1,29 года. Из них 9 мужчин и 21 женщина. ДПН диагностировали на основании неврологического осмотра, результатов электромиографии, количественного сенсорного и автономного тестирования. В исследование включали пациентов с ДПН стадий 2а и 2b (по классификации P.J. Dyck) и уровнем гликированного гемоглобина не более 10%.
Позитивная невропатическая симптоматика оценивалась по шкале TSS (Total Symptom Score). Анализировали выраженность боли, жжения, онемения и парестезий. Негативная невропатическая симптоматика (неврологический дефицит) в ногах – по шкале NISLL (Neuropathy Impairment Score). Тестировали силу мышц, состояние рефлексов и чувствительность различной модальности. Функциональное состояние периферических нервов ног определяли по результатам стимуляционной электромиографии и тестирования двигательного (n. peroneus) и чувствительного (n. suralis) нервов. Количественную оценку поверхностной и глубокой чувствительности, а также автономной кардиоиннервации проводили с помощью прибора Case-IV (компания Medical Electronics, США). Для этого определяли порог температурной, болевой и вибрационной чувствительности.
Уровень оксидантного стресса устанавливали по содержанию малонового диальдегида в сыворотке крови и гемолизате эритроцитов.
Микроциркуляция оценивалась в ногтевом ложе второго пальца рук на компьютерном капилляроскопе GY-0,04 (компания «Центр анализа веществ», Россия). Анализировались скорость кровотока, количество сладж-феноменов, величина периваскулярного отека.
Обследование больных проводилось до и после лечения.
Исходно у участников отмечено достоверное повышение уровня перикисного окисления липидов в плазме и мембранах эритроцитов (по сравнению с группой здоровых добровольцев того же возраста (n = 15)). Это свидетельствовало о выраженности оксидантного стресса. На фоне проводимой терапии зафиксировано снижение уровня малонового диальдегида в плазме и мембранах эритроцитов до нормальных значений. Сделан вывод: Актовегин оказывает антиоксидантный эффект при ДПН. После лечения Актовегином отмечено достоверное улучшение основных характеристик капиллярного кровотока, отражающих не только реологические свойства крови, но и степень проницаемости стенки капилляров.
Выраженность позитивной невропатической симптоматики по шкале TSS до лечения составляла 7,79 балла. После лечения отмечено достоверное уменьшение как суммы баллов по шкале TSS, так и баллов по каждому из сенсорных симптомов в отдельности (p < 0,001). Снижение выраженности боли не было связано с улучшением психоэмоционального состояния, так как после лечения не отмечено динамики в отношении депрессии и тревожности.
Исходно негативная невропатическая симптоматика оценивалась в 2,27 балла по шкале NISLL. Чаще выявлялись нарушения чувствительности и рефлексов. После лечения Актовегином снизилась выраженность неврологического дефицита (p < 0,05). Исследование функционального состояния чувствительного нерва показало достоверное увеличение амплитуды сенсорного ответа (3,87 ± 2,43 мкВ до лечения и 6,19 ± 3,16 мкВ после лечения, p < 0,05) при неизменной СРВ.
Исследование порогов температурной и болевой чувствительности свидетельствовало об уменьшении чувствительности, связанной с состоянием тонких нервных волокон (р < 0,05).
Не выявлено достоверного увеличения порога вибрационной чувствительности (толстые волокна), несмотря на то что по результатам электромиографии отмечено достоверное повышение амплитуды сенсорного ответа.
Вариабельность сердечного ритма по данным исследования RR-интервалов в покое и при пробе с глубоким дыханием достоверно не изменилась, хотя отмечена тенденция к ее нормализации.
Исследование показало, что терапия Актовегином приводит к регрессу клинических проявлений ДПН (позитивной и негативной невропатической симптоматики) у больных СД типа 2.
Все исследования клинической эффективности Актовегина при ДПН были немногочисленными. Для подтверждения полученных результатов требовалось проведение исследования с большим количеством участников.
В 2009 г. опубликованы результаты крупного многоцентрового рандомизированного двойного слепого плацебоконтролируемого исследования с участием больных СД типа 2 и ДПН. Исследование проводилось в 26 клинических центрах России, Украины и Казахстана. Цель работы – оценить клиническую эффективность и безопасность Актовегина у данной категории пациентов.
В исследование было включено 567 больных, которых рандомизировали на две группы: группу Актовегина (n = 281) и группу плацебо (n = 286). Пациенты первой группы сначала получали 20 внутривенных инфузий Актовегина (250 мл 20%-ного раствора), после чего переводились на прием драже в дозе 600 мг три раза в день в течение 140 дней. Во второй группе терапия проводилась по той же схеме.
Первичными критериями оценки лечения были жалобы на онемение, боль, жжение, покалывание иголками (оценивались по шкале невропатических нарушений) и порог вибрационной чувствительности (определялся в нескольких точках на ногах с помощью биотензиометра). Вторичными –изменения по шкале неврологических симптомов и показателей качества жизни.
Наилучшие результаты получены в отношении неприятных ощущений в ногах – как по суммарной оценке всех симптомов, так и по оценке каждого конкретного симптома. Выявлено достоверное уменьшение сенсорного неврологического дефицита. В группе Актовегина по сравнению с группой плацебо отмечена высокая степень достоверности по снижению порога вибрационной чувствительности.
На протяжении исследования определялся уровень глюкозы натощак и гликированного гемоглобина. Полученные результаты свидетельствовали о том, что эффективность терапии связана с действием препарата, а не с изменением контроля СД.
В группе Актовегина по сравнению с группой плацебо также наблюдалось значимое улучшение качества жизни (по шкале психического здоровья). Отмечено, что оба вида терапии имели сравнимый профиль безопасности.
Согласно требованиям Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США для лечения ДПН могут быть зарегистрированы только те препараты, которые отвечают следующим критериям:
-
действие на патогенетические механизмы;
-
уменьшение симптомов нейропатии;
-
улучшение функции нерва;
-
отсутствие значительных побочных эффектов;
-
уменьшение риска гибели нервных волокон.
Результаты исследований позволяют сделать вывод, что Актовегин соответствует большинству из этих критериев и, следовательно, может быть рекомендован при ДПН [32, 33].
Представляет интерес возможность применения Актовегина при субклинической ДПН.
В проведенном авторами в 2013–2015 гг. исследовании приняли участие 30 больных СД типа 2 и субклинической ДПН. Последняя диагностировалась по результатам электромиографии.
Пациентам была проведена панч-биопсия кожи голени для иммуногистохимического анализа плотности нервных волокон (маркер PGP 9,5) в эпидермисе и дерме до и после лечения Актовегином.
Схема применения препарата – 10 инфузий 250 мл 20%-ного раствора, затем драже в дозе 200 мг три раза в день в течение пяти месяцев.
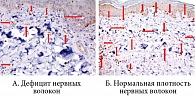
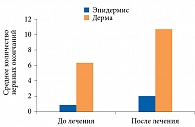
Для контроля эффективности терапии использовали биоптаты, взятые у десяти здоровых добровольцев того же возраста. Исходно в их биоптатах выявлена достоверно большая плотность нервных волокон, чем в биоптатах больных СД типа 2 и субклинической ДПН (p < 0,05) (рис. 3). По окончании лечения Актовегином в биоптате отмечено достоверное (р < 0,05) увеличение плотности нервных волокон (рис. 4).
Изучалась также возможность использования Актовегина у больных СД типа 2 и диабетической энцефалопатией (ДЭ) для лечения когнитивных нарушений.
В настоящее время ДЭ рассматривается как осложнение нарушений метаболизма нейронов и проводников центральной нервной системы вследствие гипергликемии. ДЭ – поражение головного мозга дисметаболического характера при СД, которое развивается в результате длительной гипергликемии и проявляется преимущественно нарушением когнитивных функций [34].
К ДЭ не относятся острые нарушения функции структур центральной нервной системы, возникающие при инсультах у больных СД, а также отек головного мозга, развивающийся при кетоацидозе или гипогликемии. Заболевания головного мозга, обусловленные атеросклерозом и артериальной гипертензией, у больных СД типа 2 и пожилых пациентов с СД типа 1, скорее всего, имеют второстепенное значение.
ДЭ развивается медленно. Клинические признаки заболевания, как правило, отмечаются на поздних стадиях поражения центральной нервной системы.
Клинически значимая когнитивная дисфункция приводит к нарушению трудовой и социальной адаптации и ухудшению качества жизни больных. Когнитивные нарушения снижают способность больных СД адекватно контролировать гипергликемию и увеличивают риск развития осложнений, приводящих к инвалидизации и смерти [35]. Так, наличие когнитивной дисфункции у пожилых больных СД типа 2 повышает риск смерти на 20% за два года [36].
В исследовании с участием 60 больных СД типа 2, имевших когнитивные нарушения различной степени тяжести, внутривенное введение Актовегина в дозе 400 мг в течение трех недель способствовало улучшению психического статуса по шкале MMSE (MINI-mental State Examination) (25,50 ± 2,52 балла до лечения и 26,47 ± 2,50 балла после лечения, p < 0,05). При этом в большей степени положительная динамика отмечена в отношении памяти.
Улучшение когнитивных функций не сопровождалось достоверным уменьшением депрессии и тревожности, а также изменением церебральной гемодинамики (по данным дуплексного сканирования). Сделано предположение: эффективность Актовегина у больных СД типа 2 с когнитивными нарушениями обусловлена улучшением в первую очередь церебрального метаболизма [37].
В другом исследовании 27 больных СД типа 2 получали Актовегин в дозе 1200 мг перорально (по 400 мг три раза в день) в течение трех месяцев. Контрольную группу составили 28 пациентов с СД типа 2. Все участники имели умеренные когнитивные нарушения.
Основным критерием оценки эффективности препарата служила динамика когнитивных показателей по данным нейропсихологического исследования [38].
Выявлено достоверное увеличение числа фонематически опосредованных направленных ассоциаций, улучшение способности к последовательной смене программ деятельности, произвольного внимания и увеличение объема кратковременной памяти.
Результаты исследования показали, что Актовегин оказывает положительное влияние на когнитивные функции больных СД типа 2 с синдромом умеренных когнитивных нарушений. Как следствие, улучшаются их общая активность и социальная адаптация.
С клинической и патофизиологической точек зрения не вызывает сомнения, что Актовегин, обладающий антигипоксантным и антиоксидантным действием, может широко применяться при неврологических осложнениях СД: диабетической полинейропатии и диабетической энцефалопатии.
Одним из нерешенных вопросов остается определение минимальной эффективной дозы. В последнем рандомизированном клиническом исследовании [33] использовались большие дозы Актовегина при длительном курсе лечения. Такая схема терапии неудобна и экономически невыгодна. В то же время в других исследованиях показана высокая эффективность Актовегина при меньших дозах и при назначении на более короткий период. Следовательно, для определения оптимальной схемы лечения необходимо проведение сравнительного исследования эффективности различных доз Актовегина и в более короткие сроки.
I.A. Strokov, A.S. Fokina, A.V. Zilov
I.M. Sechenov First Moscow State Medical University
Contact person: Igor Alekseyevich Strokov, strigoral@mail.ru
Here we discuss the main effects of Actovegin as well as opportunities of its administration in treatment of neurological complications of diabetes mellitus, particularly diabetic polyneuropathy and encephalopathy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.