Инсулинотерапия у пациентов c сахарным диабетом 2 типа пожилого возраста: факторы, которые необходимо учитывать
- Аннотация
- Статья
- Ссылки
- English
Прогрессирующий характер течения СД и невозможность достижения целевых показателей гликемии, а также наличие противопоказаний к пероральной сахароснижающей терапии обусловливают необходимость назначения инсулина. Однако у пожилых пациентов с СД 2 типа проведение инсулинотерапии сопряжено с рядом сложностей из-за наличия гериатрических синдромов (ГС) и большого числа коморбидных состояний.
Упрощение режима инсулинотерапии и объяснение алгоритма титрации дозы инсулина пациентам обеспечивают улучшение показателей углеводного обмена и снижение частоты развития гипогликемий, что важно у пожилых пациентов с СД 2 типа, особенно при ГС.
Прогрессирующий характер течения СД и невозможность достижения целевых показателей гликемии, а также наличие противопоказаний к пероральной сахароснижающей терапии обусловливают необходимость назначения инсулина. Однако у пожилых пациентов с СД 2 типа проведение инсулинотерапии сопряжено с рядом сложностей из-за наличия гериатрических синдромов (ГС) и большого числа коморбидных состояний.
Упрощение режима инсулинотерапии и объяснение алгоритма титрации дозы инсулина пациентам обеспечивают улучшение показателей углеводного обмена и снижение частоты развития гипогликемий, что важно у пожилых пациентов с СД 2 типа, особенно при ГС.


Введение
Сахарный диабет (СД) 2 типа является одной из актуальных проблем общественного здравоохранения как в России, так и во всем мире.
Согласно данным экспертов Всемирной организации здравоохранения и Международной диабетической федерации, в 2019 г. насчитывалось примерно 463 млн больных СД в возрасте от 20 до 79 лет, при этом 136 млн были старше 65 лет.
В России, согласно данным федерального регистра, общая численность пациентов с СД 2 типа к началу 2021 г. составила более 4 млн, при этом 2,7 млн (60,5%) были старше 65 лет, из них 636,1 тыс. (14,3%) – старше 80 лет [1]. Около 18,8% пациентов с СД 2 типа находились на инсулинотерапии [1].
Ведение пожилых пациентов с СД 2 типа сопряжено с рядом возраст-ассоциированных проблем. Наряду с характерными для этого заболевания инсулинорезистентностью (ИР) и прогрессирующей дисфункцией β-клеток развиваются гериатрические синдромы (ГС), которые в свою очередь затрудняют проведение сахароснижающей терапии, в том числе препаратами инсулина.
В статье описаны возрастные особенности, в значительной мере влияющие на гликемический контроль, а также рассмотрены режимы инсулинотерапии у пациентов с СД 2 типа пожилого возраста.
Особенности течения сахарного диабета 2 типа в пожилом возрасте
Известно, что после 50–60 лет показатели гликемии у пациентов становятся выше, что обусловлено возрастным снижением чувствительности тканей к инсулину и захвата глюкозы инсулинзависимыми тканями [2].
Инсулинорезистентность у лиц пожилого возраста усугубляется в связи с ожирением, низкой физической активностью и саркопенией [3], встречающейся примерно у 10% [4–6].
Наличие СД ассоциировано с быстро прогрессирующим снижением физической активности и мышечной силы [7].
Метаанализ результатов десяти исследований, проведенный N. Veronese и соавт., показал, что распространенность саркопении была более высокой среди лиц с СД, чем в контроле (относительный риск (ОР) 1,635 при 95%-ном доверительном интервале (ДИ) 1,204–2,220; p = 0,002) [3]. Саркопения также ассоциирована со снижением физической активности и потерей способности к самообслуживанию [8], что оказывает негативное влияние на эффективность сахароснижающей терапии и достижение целевых показателей гликемии.
С возрастом снижается чувствительность β-клеток к инкретинам, что приводит к уменьшению глюкозозависимой секреции инсулина.
Согласно результатам исследования B. Geloneze и соавт., у пожилых пациентов с СД 2 типа наблюдается снижение уровня глюкагоноподобного пептида 1 (ГПП-1) при нормальных значениях глюкозозависимого инсулинотропного пептида [9].
Клиническая характеристика пациентов
Гериатрические синдромы
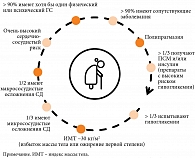
На течение СД, а также на эффективность проводимого лечения у лиц пожилого возраста в значительной степени влияют ГС – многофакторные возраст-ассоциированные клинические состояния, ухудшающие качество жизни и повышающие риск смерти, зависимости от посторонней помощи, повторных госпитализаций, потребности в долгосрочном уходе и функциональных нарушений [10].
У большинства пациентов с СД 2 типа развивается один или несколько ГС, некоторые из которых необходимо учитывать при выборе режима инсулинотерапии и препаратов инсулина.
Собирательный клинический портрет пожилого пациента с СД 2 типа представлен на рис. 1 [11].
Когнитивные нарушения (КН) – снижение одной или нескольких когнитивных функций. В процессе старения нередко наблюдается когнитивный дефицит разной степени выраженности – от нарушения познавательных функций до развития деменции [12].
В большом количестве исследований доказано влияние СД 2 типа на развитие КН [13–15]. Установлено, что у пациентов с СД 2 типа риск развития деменции увеличивается не менее чем в полтора раза по сравнению с общей популяцией [16].
К наиболее значимым механизмам, посредством которых реализуется влияние СД 2 типа на возникновение и прогрессирование КН, относятся нарушение нейрогенеза, а также целостности гематоэнцефалического барьера, системные воспалительные реакции, гипер- и гипогликемия, инсулинорезистентность, дисфункция сосудов микроциркуляторного русла и повышение уровня глюкокортикостероидов [16]. Выявлена также связь между длительно некомпенсированной гипергликемией, рецидивирующими тяжелыми гипогликемиями, цереброваскулярной болезнью, полинейропатией, ИР и наличием депрессии и развитием КН [17].
КН могут препятствовать самообслуживанию пациентов, адекватному проведению самоконтроля гликемии и техники инъекций инсулина, а также снижать эффективность процесса обучения, что затрудняет достижение целевых значений гликемического контроля [18].
В то же время инсулинотерапия сопряжена с высоким риском развития гипогликемий, что, как было отмечено ранее, негативно влияет на когнитивный статус.
В связи с вышесказанным когнитивный статус во многом определяет выбор схемы сахароснижающей терапии.
Депрессия. У лиц с СД частота встречаемости депрессии выше, чем в общей популяции [19]. Так, в исследовании с участием 2522 человек в возрасте от 70 до 79 лет было выявлено, что у лиц с СД частота развития депрессии была на 30% выше, чем у лиц без СД (отношение шансов 1,20 (ДИ 0,97–1,48)) [20].
В ряде исследований установлена связь между плохим гликемическим контролем и развитием депрессии [21].
У пожилых пациентов с СД 2 типа, страдающих депрессией, был выше риск развития синдрома мальнутриции, снижения когнитивных функций и способности к самообслуживанию [22].
Депрессивные расстройства способны препятствовать адекватному гликемическому контролю из-за снижения мотивации к проведению сахароснижающей терапии и, как следствие, приверженности лечению (комплаентности) [23]. Ввиду сказанного необходима коррекция данного состояния специалистами соответствующего профиля.
Сенсорные дефициты. При подборе оптимальной сахароснижающей терапии и обучении пожилых пациентов следует учитывать возможные нарушения зрения и слуха.
Ухудшение слуха у пожилых пациентов с СД встречается примерно в два раза чаще, чем у лиц пожилого возраста без диабета [24]. Снижение слуха может быть обусловлено как сосудистыми заболеваниями, так и невропатией различного генеза.
Нарушение зрения может быть самостоятельной патологией или ассоциированной с СД (катаракта, диабетическая невропатия). Нарушение зрения может стать ограничивающим фактором для назначения инсулинотерапии, так как при данном состоянии возможно возникновение сложностей с проведением инъекций инсулина и самоконтроля гликемии.
Полипрагмазия. У пациентов пожилого возраста зачастую имеет место большое количество хронических заболеваний (полиморбидность), каждое из которых требует назначения терапии.
Для достижения целей лечения многим больным необходимо интенсифицировать терапию, в том числе за счет добавления новых классов препаратов. Это приводит к вынужденной, а иногда необоснованной полипрагмазии.
При лечении многих заболеваний используются многокомпонентные схемы с приемом препаратов несколько раз в день, что неизбежно приводит к снижению комплаентности.
Согласно результатам метаанализа, проведенного L. Pasina и соавт., наиболее низкая приверженность лечению отмечалась у получавших большое количество препаратов. Была также установлена прямая зависимость между количеством препаратов, назначенных при выписке из стационара, и уровнем приверженности терапии при контроле через 15–30 дней и через три месяца [25]. Связи между уровнем комплаентности и такими показателями, как возраст, пол, семейное положение, не обнаружено. Полипрагмазия также была ассоциирована с большей частотой нежелательных побочных эффектов и снижением качества жизни [25].
Помимо приведенных выше причин низкая комплаентность может быть обусловлена отсутствием видимого эффекта терапии и понимания необходимости постоянного приема препаратов.
Низкая приверженность сахароснижающей терапии приводит к длительной декомпенсации СД, в связи с чем существенно повышается вероятность развития его осложнений.
Таким образом, перед назначением сахароснижающей терапии (особенно препаратов инсулина) необходимо оценивать способность пациента соблюдать схему лечения и уровень его комплаентности.
Снижение функциональной активности
Сахарный диабет способствует снижению функциональной активности у пожилых пациентов примерно в 2–2,5 раза [4].
Согласно данным исследования E.W. Gregg и соавт., включавшего 6588 человек в возрасте 60 лет и старше, неспособность ходьбы на четверть мили, выполнения работы по дому и подъема по лестнице была выявлена у 32% женщин и 15% мужчин с СД 2 типа [26]. В отсутствие данной патологии – у 14% женщин и 8% мужчин.
Снижение способности выполнять основные функции делает пациентов с СД зависимыми от окружающих, которые зачастую не обладают необходимыми навыками ухода (контроль гликемии при помощи глюкометра, корректное проведение инъекций инсулина и т.д.).
У лиц пожилого возраста нередко встречаются состояния, сопровождающиеся нарушением мелкой моторики, например вследствие тремора или артроза мелких суставов кистей, что служит серьезным барьером к самостоятельному введению инъекций. При этом даже при наличии лиц, осуществляющих уход, у последних не всегда есть временные ресурсы для реализации необходимой схемы инсулинотерапии (например, определенный режим рабочего времени родственников или сиделки).
Следует помнить и о финансовых ограничениях, с которыми зачастую сталкиваются пожилые пациенты. Это может приводить к экономии на иглах и тест-полосках и, как следствие, нарушению техники инъекций и неполноценному контролю заболевания.
Таким образом, снижение функциональной активности значимо влияет на эффективность проведения сахароснижающей терапии, в том числе препаратами инсулина.
Нераспознавание гипогликемических состояний
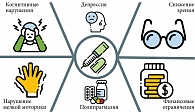
Пожилые пациенты с СД 2 типа подвержены более высокому риску развития тяжелой гипогликемии [27], что обусловлено снижением активности симпатоадреналовой системы и нарушением распознавания гипогликемий. Как правило, у пожилых пациентов гипогликемия проявляется уже в виде нейрогликопенической симптоматики. Дополнительными факторами риска развития гипогликемий являются снижение активности глюконеогенеза в печени и почках, а также аппетита, что приводит к развитию синдрома мальнутриции. Более того, риск развития гипогликемий у лиц с СД 2 типа пожилого возраста увеличивается с длительностью инсулинотерапии [28].
Установлено, что у пациентов с СД 2 типа, находившихся на инсулинотерапии более двух лет, легкие гипогликемии наблюдались в 2,5 раза чаще, а тяжелые – в 7 раз чаще, чем у получавших инсулинотерапию менее двух лет [29].
Тяжелые гипогликемии приводят к развитию таких осложнений, как инфаркт миокарда, тяжелая аритмия, инсульт, кома, а также являются причиной смерти 3–6% пациентов с СД, большую часть которых составляют лица старшего возраста [27].
Тяжелые гипогликемические состояния также приводят к развитию КН.
Согласно результатам 27-летнего наблюдения когорты пожилых пациентов с СД 2 типа, проведенного R.A. Whitmer и соавт., наличие эпизодов тяжелой гипогликемии ассоциировано со значимым повышением риска развития деменции (для одного эпизода ОР 1,26 (95% ДИ 1,10–1,49), для двух эпизодов ОР 1,80 (95% ДИ 1,37–2,36), для трех эпизодов или более ОР 1,94 (95% ДИ 1,42–2,64)) [30].
Следовательно, быстрое снижение гликемии у пожилых пациентов нецелесообразно: период достижения целевых значений у них должен быть более продолжительным, чем у лиц молодого и среднего возраста. Одной из целей лечения у пожилых пациентов с СД 2 типа является минимизация риска развития гипогликемии, что влияет на выбор как режима инсулинотерапии, так и препаратов инсулина.
Основные факторы, затрудняющие проведение инсулинотерапии у пожилых пациентов, представлены на рис. 2.
Целевые значения углеводного обмена
Тактика ведения пациентов с СД 2 типа пожилого возраста во многом зависит от их соматического статуса, сохранности когнитивных функций и ожидаемой продолжительности жизни (ОПЖ). В связи с этим в Алгоритмах специализированной медицинской помощи больным СД 2021 г. предложено распределять пожилых пациентов на три группы [31]:
- функционально независимые;
- функционально зависимые;
- пациенты с ОПЖ менее 6 месяцев.
При ОПЖ более пяти лет сахароснижающая терапия направлена на достижение целевых показателей гликемического контроля для предупреждения развития микро- и макрососудистых осложнений СД.
У пациентов с ОПЖ менее пяти лет показатели гликемического контроля могут быть менее строгими, так как прогноз жизни в этом случае в большей мере зависит от течения сопутствующей патологии.
При наличии тяжелой соматической патологии и ОПЖ менее шести месяцев цель терапии заключается не в достижении целевого уровня гликированного гемоглобина (HbA1c), а в минимизации симптомов гипергликемии и предотвращении гипогликемических состояний [31]. Алгоритм индивидуализированного выбора целей терапии по уровню HbA1c представлен в таблице [31].
Согласно объединенной позиции экспертов Международной ассоциации геронтологии и гериатрии, Европейской рабочей группы по диабету для пожилых людей и Международной целевой группы экспертов по диабету 2022 г., основными целями лечения пациентов, которым требуется постоянный посторонний уход, являются профилактика гипогликемии и острых осложнений, снижение риска инфицирования и полипрагмазии [32].
Режимы инсулинотерапии
Прогрессирующий характер течения СД и невозможность достижения индивидуальных целевых показателей гликемии, а также наличие противопоказаний к пероральным сахароснижающим препаратам (ПССП), в частности прогрессирующее снижение скорости клубочковой фильтрации и развитие хронической болезни почек, обусловливают неизбежность назначения инсулина.
В значительной степени на эффективность инсулинотерапии способны влиять ГС. В связи с этим при инициации инсулинотерапии необходимо предварительно оценивать зрительную функцию, моторику пациента, а также его функциональный и когнитивный статусы с помощью соответствующих тестов [33].
Лица, осуществляющие уход за пациентами с выраженным снижением способности к самообслуживанию, должны обладать навыками проведения инъекций инсулина, контроля уровня глюкозы в крови и купирования гипогликемических состояний [34].
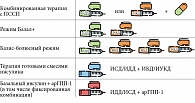
В настоящее время для достижения целевых показателей гликемического контроля используются различные режимы инсулинотерапии: терапия базальным инсулином в комбинации с ПССП/агонистами рецепторов ГПП-1 (арГПП-1), режим базал-плюс (Базал+), введение отдельных инъекций инсулина короткого/ультракороткого действия (ИКД/ИУКД) в определенные приемы пищи, базис-болюсный режим, терапия готовыми смесями инсулина (рис. 3).
Базальный инсулин в комбинации с ПССП. Для инициации инсулинотерапии, в том числе у пожилых пациентов, чаще всего используют базальные инсулины, которые различаются продолжительностью действия – средняя, длительная и сверхдлительная.
До начала ХХI в. единственным базальным инсулином был человеческий инсулин на нейтральном протамине Хагедорна (НПХ). Однако такие его фармакокинетические особенности, как вариабельность времени начала действия, наличие пика действия и вариабельность абсорбции, повышают риск гипогликемических состояний. В связи с этим для пациентов пожилого возраста рекомендованы аналоги инсулина длительного действия (ИДД), у которых отсутствует пик концентрации препарата в крови, из-за чего суточный профиль действия более близок к физиологической секреции данного гормона β-клетками поджелудочной железы [35]. При применении аналогов ИДД отмечается меньшая вариабельность гликемии по сравнению с таковой при использовании инсулина НПХ, что способствует снижению риска возникновения гипогликемий [35].
Согласно объединенному ретроспективному анализу трех исследований фазы III, в которых суммарно приняли участие 1296 пациентов с СД, получавших аналог ИДД детемир или инсулин НПХ в течение 22–26 недель, на фоне первого варианта терапии наблюдалось снижение риска гипогликемических состояний на 41% по сравнению с использованием второго варианта терапии, что было клинически и статистически значимо (ОР 0,59; р = 0,002 для пожилых людей) [36].
При проведении сравнительного анализа результатов пяти рандомизированных контролируемых исследований выявлено, что у пациентов 65 лет и старше, получавших гларгин, наблюдалось более выраженное снижение уровня HbA1c, чем у получавших аналогичные дозы инсулина НПХ (1,5 против 1,1%; р < 0,001) [37]. Частота развития ночных гипогликемий у применявших гларгин была ниже (1,27 против 2,78 случая на пациента в год; р = 0,03).
Применение у пожилых пациентов инсулина гларгин U-300 было ассоциировано с еще меньшей частотой возникновения гипогликемических состояний по сравнению с использованием инсулина гларгин U-100. Так, согласно результатам исследования EDITION (из 2496 пациентов 662 в возрасте 65 лет и старше), при сопоставимом гликемическом контроле в группе гларгина U-300 наблюдалось меньшее число ночных и тяжелых гипогликемий (для лиц 65 лет и старше ОР 0,70 (0,57–0,85), для лиц моложе 65 лет ОР 0,77 (0,68–0,87)) по сравнению с группой гларгина U-100 [38].
Режим базал-плюс – это режим инсулинотерапии, при котором предполагается введение базального инсулина и одной инъекции прандиального инсулина перед приемом пищи, содержащим максимальное количество углеводов. При назначении данного режима наблюдается снижение уровня HbA1c, эквивалентное таковому при базис-болюсном режиме инсулинотерапии, но при меньшем количестве инъекций в сутки [39].
В ряде исследований сообщалось, что при объяснении пациенту алгоритма титрации дозы инсулина показатели углеводного обмена при самостоятельном изменении дозы значительно улучшались [40].
Очевидно, что этот алгоритм должен быть максимально простым и понятным для пациента.
Согласно результатам исследований AUTONOMY и FullSTEP, оптимальным ориентиром для титрации дозы прандиального инсулина в отсутствие необходимости подсчета углеводов по системе хлебных единиц являются показатели самоконтроля гликемии [40, 41].
Таким образом, режим Базал+ имеет сопоставимую с базис-болюсным режимом эффективность, но более удобен для пациентов.
Базал+ может рассматриваться как переходный вариант с терапии базальным инсулином на базис-болюсную инсулинотерапию.
Применение у лиц пожилого возраста данного режима приводит к улучшению гликемического контроля, сопоставимому с базис-болюсным режимом, при меньшей частоте гипогликемий [42].
Данный режим инсулинотерапии может быть предпочтителен у пациентов, пропускающих приемы пищи или с недостаточностью питания, тогда как базис-болюсный режим может быть рекомендован пациентам с регулярными приемами пищи, без риска мальнутриции.
Введение прандиального инсулина перед основными приемами пищи в комбинации с ПССП. В ряде случаев пациентам, получающим ПССП, требуется дополнительное снижение постпрандиальной гликемии после приемов пищи, содержащих наибольшее количество углеводов. Для достижения целевых показателей гликемического контроля в таких случаях возможно добавление к терапии ПССП однократной инъекции болюсного инсулина (ИКД/ИУКД).
Применение такой схемы возможно у пациентов с сохранным когнитивным статусом, способных осуществлять титрацию дозы инсулина в зависимости от количества принятых углеводов и уровня гликемии перед едой.
Терапия готовыми смесями инсулина. В связи с прогрессирующим снижением функции β-клеток поджелудочной железы для контроля постпрандиальной гликемии может потребоваться назначение ИКД/ИУКД. У пациентов пожилого возраста могут возникать сложности при многократном ежедневном введении инсулина, требующем как частого самоконтроля, так и учета углеводов с коррекцией дозы прандиального инсулина. В этой ситуации терапия готовыми смесями инсулина может являться упрощенным аналогом базис-болюсного режима, имеющим преимущество в виде меньшего количества инъекций в течение суток: в зависимости от режима питания и индивидуальной потребности готовые смеси инсулина могут вводиться не три, а один-два раза в сутки. В состав готовой смеси могут входить как рекомбинантные инсулины человека (ИКД и ИСД), так и аналоги инсулина (ИДД и ИУКД). Преимуществами препаратов, состоящих из аналогов инсулина, являются более быстрое начало и стабильность продолжительности действия, а также снижение риска возникновения гипогликемических состояний [35].
При сохранении когнитивных функций возможно обучение пациентов самостоятельной титрации доз готовых смесей инсулина.
Согласно результатам 18-месячного исследования R.J. Ligthelm, в которое были включены 149 человек, у 91% удалось достичь целевых показателей гликемии при низкой частоте развития гипогликемических состояний (15%) посредством самостоятельной титрации дозы готовой смеси инсулина (двухфазный инсулин аспарт 30/70) [43]. Эта схема может быть оптимальной у пожилых с сохранной способностью к самообслуживанию и когнитивным статусом [43].
В исследовании J. Vora и соавт., включавшем 335 человек, которые были рандомизированы в группу, получавшую инсулинотерапию в режиме Базал+ в течение 24 недель (n = 170), и группу, получавшую терапию готовыми смесями инсулина в течение того же периода (n = 165), было показано, что данные режимы инсулинотерапии имеют сопоставимую эффективность, однако частота ночных гипогликемий была выше в группе Базал+ (5,7 против 3,6 случая на пациента в год; p = 0,02) [44].
Базис-болюсный режим инсулинотерапии. Базис-болюсный режим инсулинотерапии, или режим многократных инъекций, является наиболее сложным вариантом инсулинотерапии, а также наиболее опасным в отношении возникновения гипогликемий.
Преимущество этого режима перед использованием готовых смесей заключается в более точном дозировании ИКД/ИУКД в зависимости от количества углеводов в пище, однако это требует проведения самоконтроля перед едой, навыка учета углеводов и расчета дозы вводимого инсулина, что невозможно без терапевтического обучения.
Перевод пожилых пациентов на базис-болюсный режим инсулинотерапии показан при неэффективности комбинированной сахароснижающей терапии, а также других режимов инсулинотерапии, и предполагает сохранность когнитивных функций для осуществления самоконтроля, учета углеводов, коррекции дозы инсулина или введение инсулина лицами, осуществляющими уход и прошедшими соответствующее обучение.
В открытом трехлетнем рандомизированном контролируемом исследовании Treating To Target in Type 2 Diabetes (4-T), проведенном в 58 центрах Великобритании и Ирландии, сравнивали эффективность и безопасность трех режимов инициации инсулинотерапии. В исследование были включены 708 пациентов с СД 2 типа, находившихся на терапии метформином и производными сульфонилмочевины (ПСМ), с уровнем HbA1c от 7,0 до 10,0%. Средний возраст участников составлял 61,7 ± 9,8 года. Пациенты были рандомизированы на терапию базальным инсулином детемир (один или два раза в день), терапию двухфазным инсулином аспарт (два раза в день) или прандиальным инсулином аспарт (три раза в день). Через год после инициации терапии средние значения HbA1c были выше в группе базального инсулина (7,6%; р < 0,001) по сравнению с таковыми в группах двухфазного (7,3%) и прандиального (7,2%) инсулина. Однако клиническая значимость полученной разницы была весьма условной с учетом того, что среднее количество гипогликемических событий на одного пациента в год в этих группах составляло 2,3, 5,7 и 12,0 соответственно и было наименьшим в группе базального инсулина, так же как увеличение веса, составившее 1,9, 4,7 и 5,7 кг соответственно [45]. Таким образом, использование базального инсулина для инициации инсулинотерапии у лиц пожилого возраста было ассоциировано с улучшением показателей гликемического контроля при меньшей частоте гипогликемических состояний и увеличении веса.
Базальный инсулин в комбинации с арГПП-1. У пациентов с сохранной функцией β-клеток альтернативой базис-болюсному режиму может стать комбинация базального инсулина с арГПП-1, как свободная, так и фиксированная (гларгин + ликсисенатид, деглудек + лираглутид).
Применение данного режима позволяет снизить риск развития гипогликемий, предотвратить нежелательный набор массы тела, а также при использовании фиксированных комбинаций повысить приверженность лечению благодаря снижению числа инъекций [46].
Кроме того, некоторые арГПП-1 обладают кардиопротективным эффектом, что важно для снижения риска развития сердечно-сосудистых событий у лиц пожилого возраста.
Депрескрайбинг, или упрощение инсулинотерапии
Терапия готовыми смесями инсулина, базис-болюсный режим, а также применение НПХ-инсулина в качестве базального ассоциированы с высокой частотой развития гипогликемических состояний [47, 48]. Неудовлетворительный гликемический контроль может быть обусловлен отсутствием алгоритма титрации инсулина, доступного для понимания пациентов [49]. В связи с этим лицам пожилого возраста рекомендуется уменьшение количества вводимого инсулина в сутки путем упрощения схем инсулинотерапии (перевод на комбинированную сахароснижающую терапию, монотерапию базальным инсулином, фиксированную комбинацию ИДД + арГПП-1), если это может быть сделано без ущерба для гликемического контроля и/или с целью снижения риска развития гипогликемических событий.
В 2016 г. группой ученых из Бостона было проведено одноэтапное интервенционное исследование в отношении 65 пациентов с СД 2 типа в возрасте старше 65 лет, которые получали две инъекции инсулина и более ежедневно и у которых были зарегистрированы эпизоды гипогликемии не менее одного раза в сутки в течение пятидневного непрерывного мониторинга глюкозы (НМГ). Упрощение режима инсулинотерапии проводилось путем перевода с режима многократных инъекций на однократное введение ИДД (в сочетании с ПССП или без них). У пациентов с исходным уровнем HbA1c в пределах 8–9% он снизился на 0,52% (р < 0,001), с исходным уровнем HbA1c более 9% – на 1,7% (р = 0,03). После упрощения режима инсулинотерапии количество эпизодов гипогликемии через пять и восемь месяцев значимо сократилось (р < 0,001).
Таким образом, упрощение режима инсулинотерапии может снизить риск развития гипогликемий без ущерба для гликемического контроля, а также потребность в инсулине [49]. Помимо этого становится возможной самостоятельная титрация дозы инсулина.
Средства введения инсулина
Инсулиновые шприц-ручки (предзаполненные или со сменным картриджем) в настоящее время являются наиболее распространенным средством введения препаратов инсулина.
Сравнительный анализ приверженности инсулинотерапии у пожилых пациентов с СД 2 типа показал, что использовавшие шприц-ручки были более привержены лечению, чем применявшие шприцы (коэффициент охваченных дней – 0,67 против 0,50 соответственно (p < 0,001), коэффициент владения лекарствами – 0,75 против 0,57 соответственно (p < 0,0001)) [50].
В исследовании R.V. Machry и соавт. статистически значимых различий по приверженности лечению, частоте гипогликемий и влиянию на качество жизни у пациентов, использовавших шприц-ручки и инсулиновые шприцы, получено не было. Однако у первых уровень HbA1c через 24 недели был статистически значимо ниже, чем у вторых, – 8,39 ± 1,28 и 8,85 ± 1,74% соответственно (p = 0,101) [51].
Снижение эффективности инсулинотерапии у пациентов пожилого возраста зачастую обусловлено нарушением техники выполнения инъекций или некорректным введением препаратов инсулина вследствие сенсорного дефицита или КН, а также наличия заболеваний суставов или хайропатии.
Для пожилых пациентов предпочтительнее использование шприц-ручек ввиду их большего удобства (встроенный картридж, заполненный инсулином, наличие слышимых щелчков при выставлении дозы, крупные цифры в окне установки дозы, больший размер устройства по сравнению с инсулиновым шприцем) [52].
Кроме того, введение инсулина с помощью шприц-ручек, а не инсулиновых шприцев в некоторой степени способно уменьшить зависимость пациентов от лиц, осуществляющих уход.
Помповая инсулинотерапия
Около 90% пожилых с СД 2 типа имеют множественные сопутствующие состояния, наиболее значимым из которых является снижение когнитивных функций, что затрудняет применение инсулиновой помпы [53]. Простые в использовании инсулиновые помпы подходят лицам, плохо разбирающимся в технике, однако пожилым пациентам со сниженными когнитивными функциями необходима помощь посторонних при их применении [54].
Сохранение данных о количестве введенного помпой инсулина позволяет более эффективно корректировать дозу вводимого препарата в течение суток.
Для определения уровня гликемии рекомендуется использовать системы НМГ, что помогает своевременно выявлять нераспознаваемые гипогликемии [55].
В настоящее время данные о преимуществах непрерывного подкожного введения инсулина (НПВИ) над режимом множественных инъекций инсулина в отношении улучшения гликемического профиля противоречивы.
Согласно результатам ряда рандомизированных контролируемых исследований, статистически значимой разницы в отношении гликемического контроля у пациентов, находившихся на режиме НПВИ или множественных инъекций инсулина, не отмечено [56, 57]. Вместе с тем в исследовании OPT2MISE продемонстрировано статистически значимое снижение уровня HbA1c в группе НПВИ по сравнению с группой множественных инъекций инсулина – на 1,1 и 0,4% соответственно (p < 0,001) [58].
В настоящее время НПВИ у пожилых пациентов с СД 2 типа используется редко. Однако такой вариант введения инсулина возможен у пациентов с сохранным когнитивным и функциональным статусами, а также у лиц без сенсорных дефицитов, способных затруднять обучение и использование помпы.
Обучение при инициации или интенсификации инсулинотерапии
Согласно заключению экспертов всех международных диабетологических сообществ, обучение является важнейшим компонентом лечения СД и должно проводиться вне зависимости от возраста пациентов [59]. Инициация или интенсификация инсулинотерапии требует дополнительного обучения пациентов или лиц, осуществляющих уход за ними.
Обучение пожилых пациентов зачастую затруднено в связи с наличием коморбидных состояний и ГС, в первую очередь сенсорных дефицитов и КН.
Перед началом обучения важно оценить когнитивный, эмоциональный и функциональный статусы, финансовые возможности и наличие социальной поддержки у лиц, которым она необходима.
В индивидуальном порядке следует определить оптимальную форму обучения.
При наличии у пациента деменции, функциональной зависимости или выраженного сенсорного дефицита целесообразно обучение лиц, обеспечивающих уход, по упрощенной программе, направленной в первую очередь на профилактику жизнеугрожающих состояний. У пациентов с депрессией и умеренными сенсорными дефицитами стоит отдавать предпочтение индивидуальному обучению до улучшения эмоционального состояния.
Даже у наиболее сохранных пожилых пациентов занятия следует проводить в более медленном темпе и перед их началом убедиться, что обучающимся достаточно хорошо слышно обучающих.
Для лучшего запоминания материала рекомендуется использовать наглядные пособия и вспомогательные средства, например раздаточные материалы [22].
Перед началом обучения необходимо оценить исходный уровень знаний о СД, владение навыками самоконтроля и техникой инъекций инсулина. Важно ежегодно контролировать выживаемость знаний. Дополнительная промежуточная оценка может потребоваться пациентам, которые по неясным причинам не могут достичь целевых значений углеводного обмена.
Основные подходы к обучению лиц пожилого возраста представлены на рис. 4.
Выводы
Заболеваемость СД 2 типа продолжает неуклонно увеличиваться, в основном за счет лиц пожилого возраста. В дебюте или при прогрессировании заболевания практически каждому пятому пациенту требуется назначение инсулина. В старших возрастных группах нуждающихся в инсулинотерапии становится еще больше. Особенностью пожилых пациентов является наличие одного или нескольких ГС, способных оказывать значимое влияние на эффективность лечения, с одной стороны, и определяющих выбор режима и препаратов инсулина, с другой стороны, что необходимо учитывать для достижения индивидуальных целей гликемического контроля и снижения риска возникновения гипогликемических событий. В настоящее время установлено, что упрощение режима инсулинотерапии и обучение улучшают гликемический контроль и снижают частоту развития гипогликемий у пожилых пациентов с СД 2 типа, в том числе при наличии ГС.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
A.V. Oderiy, A.V. Balashova, I.V. Glinkina, PhD, G.E. Runova, PhD, V.V. Fadeev, MD, PhD, Corresponding member of the RASci.
I.M. Sechenov First Moscow State Medical University
Contact person: Anna V. Oderiy, anya.oderij2112@gmail.com
The number of people with type 2 diabetes mellitus (T2DM) continues to progressively increase, mainly due to the elderly.
Due to T2DM a progression glycemia targets are commonly unachievable with oral hypoglycemic drugs, which also have several contraindications, and so insulin should be prescribed for many diabetic patients. Insulin therapy in elderly patients with T2DM is associated with a number of difficulties due to the presence of geriatric syndromes and a large number of comorbid conditions.
Insulin therapy regimen simplification and explanation of the insulin dose titration algorithm to patients may lead to an improvement in glucose control and decrease the incidence of hypoglycemia. In this regard, it should be considered in all elderly people with T2DM, especially for those geriatric syndromes.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.