Сахарный диабет (СД) 2 типа относится к числу наиболее распространенных неинфекционных заболеваний, приводящих к ранней инвалидизации, преждевременной смерти и значительному снижению качества жизни пациентов. По экспертной оценке Международной федерации диабета, в 2014 г. число больных диабетом в мире достигло 387 млн [1], при этом на долю СД 2 типа приходилось 90% случаев. Подобная тенденция обусловлена прежде всего ожирением и гиподинамией [2]. Отметим, что масштабность проблемы более значительна, поскольку наряду с официально зарегистрированными случаями СД 2 типа примерно у трети населения диагноз не установлен [3].
СД 2 типа представляет собой фактор высокого риска ухудшения сердечно-сосудистого прогноза [4–6]. Так, в отличие от пациентов без диабета у больных СД вероятность развития инсульта повышена в два-три раза, риск инфаркта миокарда – в четыре – шесть раз. За прошедший год количество смертей, обусловленных заболеванием, составило 4,9 млн [3].
Проблема лечения СД 2 типа по-прежнему привлекает особое внимание врачей различных специальностей, что диктует необходимость поиска современных подходов к дальнейшему улучшению результатов фармакотерапии заболевания. Медикаментозное снижение гипергликемии достигается за счет применения препаратов, влияющих на основные патогенетические механизмы этого нарушения. До недавнего времени патофизиологические механизмы развития гипергликемии рассматривались главным образом с позиций инсулинорезистентности и снижения секреции инсулина вследствие нарушения функции и/или уменьшения массы бета-клеток поджелудочной железы.
Успехи в диабетологии расширили представления о патогенезе СД 2 типа. Стало ясно, что помимо упомянутых ключевых дефектов имеют значение серьезные метаболические нарушения, такие как гиперглюкагонемия, дефицит продукции и/или резистентность к инкретинам, ускоренный липолиз в жировой ткани, повышение почечной реабсорбции глюкозы и резистентность к инсулину в головном мозге с нарушением пищевого поведения [7]. Как следствие, пересматриваются устоявшиеся взгляды на цели и подходы к лечению пациентов с СД 2 типа. Помимо достижения эффективного и безопасного контроля гликемии лечение должно быть направлено на предупреждение прогрессирования заболевания за счет уменьшения инсулинорезистентности и улучшения функции бета-клеток, а также на коррекцию других нарушений, имеющих место при СД 2 типа [8–10].
Лечение СД 2 типа остается актуальной проблемой, в ряде случаев связанной с риском гипогликемических состояний, которые по сути являются лимитирующими как при инициации, так и при интенсификации сахароснижающей фармакотерапии. Эффективному лечению заболевания препятствует избыточная масса тела у большинства пациентов с СД 2 типа, которая с годами обычно увеличивается, особенно при использовании препаратов сульфонилмочевины (ПСМ) [11, 12]. К тому же ожирение, в большей степени его висцеральная форма, является значимым фактором риска сердечно-сосудистых заболеваний (ССЗ) и увеличивает вероятность развития осложнений СД 2 типа [2, 13].
Хронические осложнения заболевания у большинства пациентов вносят свой вклад в выбор лечебной стратегии [5, 8]. Пациенты, страдающие СД 2 типа, чаще умирают от ССЗ, среди которых лидируют инфаркты и инсульты. В настоящее время СД 2 типа рассматривается как эквивалент наличия у пациента клинически выраженного ССЗ, что выдвигает особые требования к долгосрочной сердечно-сосудистой безопасности сахароснижающих препаратов [14, 15]. Поэтому современные требования к сахароснижающей терапии включают отсутствие негативного влияния на сердечно-сосудистые исходы [8, 12, 13]. Продолжается поиск новых лекарственных возможностей.
Инкретин-направленная терапия
К настоящему времени сформулирована концепция сниженного эффекта инкретинов при СД 2 типа. Это послужило основанием для внедрения в клиническую практику принципиально новых патофизиологически обоснованных подходов к лечению заболевания, включающих, в частности, применение лекарственных средств, действие которых основано на эффектах инкретинов [4, 16]. Считается, что именно инкретины ответственны за 50–70% постпрандиальной секреции инсулина [17, 18]. Речь идет о гормонах желудочно-кишечного тракта, стимулирующих секрецию инсулина и подавляющих секрецию глюкагона в ответ на прием пищи, – глюкагоноподобном пептиде-1 (ГПП-1) и глюкозозависимом инсулинотропном полипептиде (ГИП) [19].
Инкретиновый инсулинотропный эффект проявляется только при повышенной концентрации глюкозы в крови, что крайне важно в плане безопасности сахароснижающей терапии. У врачей впервые появилась возможность обеспечить гликемический контроль, близкий к физиологическому, без риска гипогликемии – выработку инсулина и подавление секреции глюкагона исключительно в ответ на гипергликемию [14, 16, 17, 19]. Стимулируя биосинтез инсулина, инкретины активируют накопление запасов инсулина в бета-клетках, что связано с активацией транскрипции гена проинсулина и инсулина с последующим повышением биосинтеза и стабильности мРНК [9]. Эффективность эндогенных инкретинов у больных СД 2 типа снижается, что может быть обусловлено нарушением процессов секреции ГПП-1, ускоренным метаболизмом ГПП-1 и ГИП или нечувствительностью клеточных рецепторов к пептидам [11, 20, 21]. Особый интерес представляет потенциальная возможность ГПП-1 подавлять апоптоз, стимулировать неогенез и пролиферацию бета-клеток поджелудочной железы, что не исключает воздействия на снижение бета-клеточной массы, которое характеризует течение СД 2 типа. Однако делать окончательные выводы по данному серьезному вопросу преждевременно. Необходимы дальнейшие исследования в этом направлении [11, 14, 17].
Инкретин-направленная терапия заняла прочную позицию в оказании помощи больным СД 2 типа. Ее создание и внедрение в клиническую практику облегчило лечение заболевания и по сути стало поворотным моментом и перспективным направлением в лечении заболевания [4, 19]. К лекарственным средствам, действие которых основано на эффектах инкретинов, относятся агонисты рецепторов ГПП-1. Без них сегодня невозможно представить лечение СД 2 типа [17, 18, 22]. Признанием преимуществ этой группы сахароснижающих препаратов стало их введение в алгоритмы специализированной медицинской помощи больным сахарным диабетом. Уникальный механизм действия позволяет применять данные средства как в виде монотерапии, так и в сочетании с традиционными средствами, включая инсулин [9, 23, 24].
Вследствие прогрессирующего характера СД 2 типа получить необходимый терапевтический эффект со временем становится труднее, и многие пациенты нуждаются в комбинированной сахароснижающей терапии. Более того, применение ряда сахароснижающих препаратов, особенно ПСМ и инсулина, чревато риском развития гипогликемии и увеличения массы тела [8, 13].
В недавнем метаанализе S.C. Liu и соавт. [25], посвященном применению различных лекарственных средств второй линии в случае неудовлетворительного контроля на фоне монотерапии метформином, были проанализированы 39 рандомизированных клинических исследований (КИ), включавших 17 860 пациентов. Оказалось, что терапия агонистами рецепторов ГПП-1 обеспечивает более существенное снижение HbA1c, чем терапия ПСМ, глинидами, тиазолидиндионами, ингибиторами альфа-глюкозидазы и ингибиторами дипептидилпептидазы 4-го типа (ДПП-4) (-0,20% (95% доверительный интервал (ДИ) -0,34–-0,04%), -0,31% (95% ДИ -0,61–-0,02%), -0,20% (95% ДИ -0,38–-0,00), -0,36% (95% ДИ -0,64–-0,07%), -0,32% (95% ДИ -0,47–-0,17%) соответственно). Иными словами, агонисты рецепторов ГПП-1 имеют явное преимущество по эффективности перед другими пероральными сахароснижающими препаратами (ПСП) у пациентов с неудовлетворительным контролем на монотерапии метформином. Кроме того, снижение HbA1с при использовании агонистов рецепторов ГПП-1 было сопоставимо с терапией базальным инсулином и готовыми смесями инсулина. Согласно результатам названного выше метаанализа, применение агонистов рецепторов ГПП-1 было более безопасно в отношении риска гипогликемий и не способствовало увеличению массы тела больных СД 2 типа по сравнению с терапией глинидами, ПСМ, тиазолидиндионами. Инсулинорезистентность играет ключевую роль в развитии СД 2 типа, безопасность в отношении массы тела на фоне терапии сопровождается улучшением чувствительности тканей к инсулину и благоприятно отражается на гликемическом контроле. Поэтому при необходимости интенсификации сахароснижающей терапии у пациентов с СД 2 типа пристальное внимание уделяется комбинации агонистов рецепторов ГПП-1 и метформина.
Особый интерес представляет крупный метаанализ, посвященный изучению эффективности препаратов инкретин-направленной терапии (77 рандомизированных КИ) [24]. При отборе КИ в метаанализ учитывались следующие критерии:
- продолжительность исследований не менее 12 недель;
- количество пациентов в группе – не менее десяти;
- первичный параметр оценки – НbА1с;
- изменения в клиническом состоянии оценивались при добавлении одного сахароснижающего средства.
Большинство КИ были фазы III со средней продолжительностью 24–30 недель, в 85% из них участвовало не менее 90 пациентов в каждой группе (cреднее значение НbА1с 8,0–8,6%). Кроме того, в большинстве КИ пациенты получали комбинированную сахароснижающую терапию. Анализ эффективности лечения показал снижение НbА1с на фоне применения всех препаратов (рис. 1) [26]. В целом наиболее выраженное снижение НbА1с наблюдалось при использовании агонистов рецепторов ГПП-1 по сравнению с ингибиторами ДПП-4.
Клинические возможности первого агониста ГПП-1 эксенатида
Среди агонистов рецепторов ГПП-1 первым и наиболее изученным лекарственным средством считается эксенатид (Баета®), обладающий всеми достоинствами ГПП-1 и применяемый в клинической практике в США с апреля 2005 г. В России препарат был зарегистрирован в ноябре 2006 г. Следует отметить, что эксенатид характеризуется большой доказательной базой по эффективному снижению HbA1c у пациентов с СД 2 типа, включая результаты рандомизированных КИ, исследований в реальных условиях и метаанализов баз данных [4, 16, 27–29].
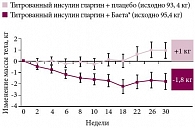
Согласно результатам основных КИ, у пациентов с СД 2 типа лечение эксенатидом обеспечивает снижение уровня HbA1c на 0,5–1,7%. Причем по эффективности препарат не уступает препаратам инсулина [30, 31]. В различных КИ доказано, что эффективность эксенатида сопоставима с таковой инсулина гларгина и двухфазного инсулина аспарт в рамках снижения уровней HbA1c к 26–52-й неделе терапии. Как видно из рис. 2, по основному конечному показателю в группах комбинированной терапии с препаратом эксенатид и в группах терапии двухфазным инсулином аспарт и инсулином гларгином снижение уровней HbA1c было одинаковым [5, 28, 31, 32].
Эксенатид обеспечивает снижение уровня HbA1c, главным образом воздействуя на постпрандиальную гипергликемию. При сравнении с двухфазным инсулином аспарт в КИ с участием пациентов с СД 2 типа, имевших неудовлетворительный контроль на фоне лечения метформином и ПСМ, в группе эксенатида достигнуто более выраженное снижение показателей постпрандиальной гликемии [31]. Однако в отличие от терапии эксенатидом применение инсулинотерапии привело к увеличению массы тела [5, 28, 31]. В частности, при сравнении с двухфазным инсулином аспарт средние показатели массы тела статистически достоверно различались между двумя группами уже на второй неделе от начала терапии, а к концу исследования (52-я неделя) эти различия составили -5,5 ± 0,2 кг (95% ДИ -5,9–-5,0 кг; p < 0,001) [31]. Кроме того, возросла масса тела у больных, получавших инсулин гларгин (в среднем на 1,8 кг [32] и на 3,0 кг [30]).
Как известно, сахароснижающая терапия нередко приводит к прибавке массы тела, что само по себе может влиять на эффективность лечения. С появлением агонистов рецепторов ГПП-1 у врачей впервые появилась возможность не только улучшить гликемический контроль, но и снизить риск увеличения массы тела у пациентов с СД 2 типа.
Обратите внимание: одним из побочных эффектов применения эксенатида может быть снижение массы тела (на 0,8 кг уже через две недели лечения [20] и до 3,1–3,6 кг при более длительной терапии [17, 29]). Возможное снижение массы тела требует отдельного тщательного врачебного мониторинга с точки зрения безопасной скорости. В настоящее время эксенатид не относится к лекарственным средствам для лечения ожирения [33].
Результаты долгосрочных клинических исследований эксенатида
СД 2 типа является хроническим заболеванием. Его лечение представляет длительный, пожизненный процесс. Для клинической практики интерес представляют результаты долгосрочных КИ эксенатида, в которых терапия лекарственным средством и наблюдение за пациентами продолжались до трех с половиной лет [34]. В когорте пациентов, продолжавших терапию эксенатидом на протяжении трех лет, отмечалось стойкое сохранение достигнутых уровней контроля гликемии со снижением HbA1с на 1% от исходного уровня (р < 0,0001). При этом значения HbA1с < 7% удалось добиться у 46% пациентов с СД 2 типа, а уровня < 6,5% – у трети больных. Отмечавшееся снижение массы тела имело безопасный темп и достигло -5,3 ± 0,4 кг через три года применения эксенатида (по сравнению с исходным значением, p < 0,0001).
С учетом сложных патофизиологических связей между СД 2 типа и ССЗ особое значение для всех используемых на практике, а также появляющихся на фармацевтическом рынке новых сахароснижающих лекарственных средств приобретает не только их способность обеспечивать надежный контроль гликемии, но и безопасность в отношении сердечно-сосудистого риска [8, 13, 15, 35]. Неоспоримо преимущество эксенатида в отношении низкого риска гипогликемии, что относится и к пациентам с высоким риском сердечно-сосудистых событий (пожилой возраст, инсульт, инфаркт в анамнезе, снижение скорости клубочковой фильтрации).
Наличие многочисленных сопутствующих заболеваний существенно ограничивает врачей в выборе сахароснижающей терапии, особенно у пациентов с нарушением функции печени [8, 9]. Поскольку эксенатид в основном выводится почками, считается, что нарушение печеночной функции не изменяет концентрации эксенатида в крови [33].
Влияние эксенатида на функцию бета-клеток
Ключевой задачей при лечении СД 2 типа является достижение целевого гликемического контроля и предотвращение развития хронических осложнений заболевания. Для улучшения результатов лечения пациентов с СД 2 типа с патогенетических позиций крайне важно сохранение секреторной активности бета-клеток.
К сожалению, большинство применяемых сахароснижающих препаратов как в виде монотерапии, так и в различных комбинациях не способны обеспечить длительное сохранение контроля гликемии в процессе лечения, поддержание функции бета-клеток, а также предупредить прогрессирование заболевания.
Секреция инсулина в течение первых десяти минут, известная как первая фаза инсулинового ответа, отсутствует у пациентов с СД 2 типа. Кроме того, утрата первой фазы инсулинового ответа считается ранним нарушением функции бета-клеток при СД 2 типа. Введение эксенатида восстанавливает или значительно усиливает как первую, так и вторую фазу инсулинового ответа у пациентов с СД 2 типа [33]. О восстановлении функции бета-клеток обычно судят по улучшению индекса HOMA-B (homeostasis model assessment – pancreatic B-cell function – гомеостатическая модель оценки функционирования бета-клеток) на фоне применения лекарственного средства. В подгруппе пациентов, завершивших трехлетний курс терапии эксенатидом, отмечалось достоверное улучшение показателя HOMA-B по сравнению с исходным значением (70,1 против 52,4%; p < 0,0001) [34]. Аналогичные результаты получены в сравнительных исследованиях эксенатида и плацебо (на фоне терапии тиазолидиндионом) [36] и двухфазным инсулином аспарт [31]: в группах терапии эксенатидом наблюдалось улучшение индекса HOMA-B на 19% относительно исходных уровней [31, 36].
В другом рандомизированном КИ пациентам, получавшим терапию метформином, назначали эксенатид или инсулин гларгин [28]. Спустя год в обеих группах после 52 недель лечения наблюдалось одинаковое снижение уровня HbA1c (до 6,8%). Оценка функции бета-клеток показала, что аргинин-стимулированная секреция С-пептида во время гипергликемии увеличилась в 3,2 раза на фоне применения эксенатида и лишь в 1,31 раза – после терапии инсулином гларгином (различие между группами 2,46 раза; р < 0,0001). Однако через четыре недели после отмены эксенатида и инсулина гларгина показатели функции бета-клеток вернулись к исходным и достоверно не отличались между исследуемыми группами. Показатели HbA1c и массы тела также вернулись к исходным через три месяца после прекращения терапии. Полученные результаты позволяют предположить, что для сохранения благоприятных эффектов на функцию бета-клеток необходимо продолжение терапии эксенатидом. Данные о влиянии эксенатида на функцию бета-клеток у пациентов с СД 2 типа требуют дальнейшего изучения в долгосрочных КИ.
Другие аргументы в пользу эксенатида, применяемого у больных СД 2 типа
Эксенатид особенно привлекателен для пациентов с СД 2 типа с факторами риска сердечно-сосудистой патологии и ССЗ, поскольку характеризуется низким риском развития гипогликемии [33].
В настоящее время некоторые практические врачи рассматривают эксенатид в качестве альтернативы инсулинотерапии при невозможности достижения целевого контроля гликемии ПСП у больных СД 2 типа. Поэтому следует остановиться на сравнении результатов указанных выше вариантов лечения.
В рандомизированном исследовании M.J. Davies и соавт. пациентам с СД 2 типа и повышенным риском сердечно-сосудистых событий, у которых не удавалось добиться компенсации двумя или тремя ПСП, назначали эксенатид или инсулин гларгин [30]. Спустя 26 недель лечения динамика уровней HbA1c в сравнении с исходными показателями была одинаковой в обеих группах (-1,25 [0,09]% и -1,26 [0,09]% соответственно; p = 0,924). Вместе с тем эффекты на массу тела пациентов были прямо противоположными (-2,73 кг в группе терапии эксенатидом и +2,98 кг в группе инсулина гларгина, p < 0,001). Причем в группе эксенатида более чем у половины пациентов удалось добиться снижения HbA1c до целевого уровня без повышения массы тела (53,4%), а в группе инсулина гларгина их доля составила лишь 19,8% (p < 0,001).
Анализ фармакоэкономических показателей продемонстрировал, что терапия эксенатидом (n = 4090), несмотря на более высокую стоимость препарата, сопровождается достоверно (p < 0,0001) меньшими общими медицинскими затратами и расходами на обслуживание пациентов в амбулаторной практике и в стационаре, на оказание неотложной медицинской помощи, а также обеспечивает сокращение затрат, связанных с лечением СД, по сравнению с инсулином гларгином (n = 1660) [37].
Перспективным направлением интенсификации сахароснижающей терапии признано сочетание агонистов рецепторов ГПП-1 и базального инсулина, целесообразность которого продемонстрирована в исследованиях.
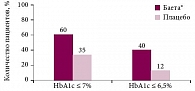
В рандомизированном плацебоконтролируемом КИ J.B. Buse и соавт. изучали клиническую эффективность эксенатида у пациентов, получавших инсулин гларгин (≥ 20 Ед) в виде монотерапии или в комбинации со стабильной дозой метформина, пиоглитазона или их сочетания [26]. В течение 24 недель больные СД 2 типа (n = 592) в дополнение к сопоставимой в двух группах пероральной сахароснижающей терапии получали эксенатид (исходно HbA1c 8,32 ± 0,85%, доза инсулина 0,51 ± 0,28 Ед/кг) или плацебо (исходно HbA1c 8,50 ± 0,96%, доза инсулина 0,50 ± 0,24 Ед/кг) [38]. Дозы инсулина гларгина титровались с использованием алгоритма «лечение до цели» до достижения целевой гликемии натощак < 5,5 ммоль/л. В конце исследования уровень HbA1c значимо снизился в группе эксенатида на 1,74% по сравнению с 1,04% в группе плацебо (р < 0,001). Важным показателем в КИ является количество пациентов, достигших целевого контроля: уровень HbA1c < 7,0% отмечался у 60% пациентов в группе эксенатида и у 35% в группе плацебо, уровень HbA1c < 6,5% в группе эксенатида – у 40%, в группе плацебо – всего у 12% (р < 0,001 между группами сравнения) (рис. 3). Применение эксенатида сопровождалось достоверно большим уменьшением постпрандиальной гликемии по сравнению с группой плацебо в дополнение к контролю гликемии натощак, который обеспечивало титрование дозы базального инсулина гларгина. Кроме того, терапия эксенатидом не привела к увеличению массы тела в сравнении с увеличением массы тела, отмеченным у пациентов группы плацебо (рис. 1).
Еще один принципиальный момент. Доказано, что комбинация эксенатида и базального инсулина не только высокоэффективна, но и безопасна в лечении СД 2 типа.
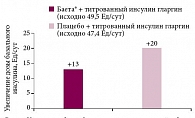
Веским доводом для широкого использования комбинации эксенатида и базального инсулина в клинической практике является то, что она помогает эффективнее достигать целей с меньшими дозами базального инсулина (рис. 4).
Кому показана терапия эксенатидом
В первую очередь такая терапия показана пациентам с СД 2 типа с сопутствующим ожирением, не достигающим индивидуальных целевых показателей на монотерапии метформином, при непереносимости метформина или при наличии противопоказаний к его применению; пациентам, получающим рациональную комбинированную терапию традиционными ПСП, но не достигающим компенсации углеводного обмена. Возможна другая клиническая ситуация: пациенты СД 2 типа с высоким риском гипогликемии и пациенты, у которых неудовлетворительный контроль связан в большей степени с постпрандиальной гипергликемией. Наконец, пациенты с недостаточным контролем гликемии на ПСП (уровень HbA1c < 9,0%). Рассматривается как этап лечения, предшествующего назначению инсулина, когда наряду с контролем гликемии удержание массы тела – основная цель лечения.
Рекомендуемые дозы препарата
Напомним режим дозирования препарата: эксенатид вводится подкожно в дозе 5 мкг два раза в сутки. Через месяц после начала лечения доза препарата может быть повышена до 10 мкг два раза в сутки с целью дальнейшего улучшения контроля гликемии. Инъекции препарата проводятся в течение 60 минут до приема пищи. При комбинации эксенатида c метформином или тиазолидиндионами их дозу можно не менять. Тем не менее при сочетании с секретагогами может потребоваться снижение дозы для уменьшения риска гипогликемии. У пациентов с умеренным нарушением функции почек (скорость клубочковой фильтрации (СКФ) 30–80 мл/мин) проводить коррекцию дозы не требуется. При СКФ менее 30 мл/мин эксенатид следует отменить.
При присоединении эксенатида к инсулинотерапии необходимо рассматривать возможность снижения дозы инсулина. В исследовании КИ J.B. Buse и соавт. добавление эксенатида к сахароснижающей терапии у пациентов с СД 2 типа, получавших базальный инсулин, зависело от исходного уровня НbА1с [26, 39]. Пациентам с уровнем НbА1с выше целевого значения, но не более 8% дозу базального инсулина (гларгин) рекомендовалось снижать на 20% для минимизации риска развития гипогликемии. В то же время пациентам с уровнем НbА1с выше 8% продолжали терапию инсулином в прежних дозах. При назначении эксенатида необходимо следовать рекомендуемым дозам (старт с 5 мкг два раза в сутки в течение четырех недель с последующим повышением дозы препарата до поддерживающей дозы 10 мкг два раза в сутки).
Заключение
Эффективность терапии СД 2 типа остается актуальным вопросом эндокринологии, поскольку число больных в России, как и в других странах мира, растет эпидемическими темпами. Весомый вклад в решение этой острой медико-социальной проблемы внесло появление эксенатида – первого представителя нового класса лекарственных средств, действие которых основано на эффектах инкретинов. Таким образом, открылись новые перспективы проведения патофизиологически обоснованной терапии СД 2 типа.