Иммуносупрессивная терапия и иммуногенность вакцин в ревматологии
- Аннотация
- Статья
- Ссылки
- English
В обзоре представлены данные об эффекте антиревматических препаратов на иммуногенность вакцин против гриппа, пневмококковой и новой коронавирусной инфекций у ревматологических больных. Продемонстрирована необходимость соблюдения определенных временных интервалов при проведении вакцинации в случае использования ряда иммуносупрессивных препаратов. Подчеркивается важность дальнейших клинических исследований с целью оценки воздействия иммуносупрессивной терапии на вакцинальный ответ и отработки методик его оптимизации.
В обзоре представлены данные об эффекте антиревматических препаратов на иммуногенность вакцин против гриппа, пневмококковой и новой коронавирусной инфекций у ревматологических больных. Продемонстрирована необходимость соблюдения определенных временных интервалов при проведении вакцинации в случае использования ряда иммуносупрессивных препаратов. Подчеркивается важность дальнейших клинических исследований с целью оценки воздействия иммуносупрессивной терапии на вакцинальный ответ и отработки методик его оптимизации.

Введение
В последнее время в ревматологической практике существенно возросла значимость коморбидных инфекций, особенно при иммуновоспалительных ревматических заболеваниях (ИВРЗ). Данная проблема обусловлена активным применением инновационных базисных противовоспалительных препаратов (БПВП), так называемых таргетных БПВП, а также генно-инженерных биологических препаратов (ГИБП), действие которых направлено на специфические звенья патогенеза ИВРЗ. По мере накопления клинического опыта стала четко прослеживаться ассоциация между применением указанных препаратов и возрастанием риска развития коморбидных инфекций различной природы и локализации, что, в частности, проявилось в период пандемии COVID-19.
Наиболее реальным способом борьбы с коморбидными инфекциями в ревматологии и других областях медицины представляется создание, совершенствование и внедрение в клиническую практику различных вакцин, главным показателем действенности которых является клиническая (профилактическая) эффективность. В то же время ряд антиревматических препаратов могут влиять на иммуногенность некоторых вакцин, снижая их эффективность.
Известно, что иммуногенность вакцины обычно выступает в качестве суррогата ее клинической эффективности. Однако интерпретация и сопоставление результатов исследований иммуногенности вакцин осложняются рядом факторов. Во-первых, арсенал БПВП/ГИБП быстро пополняется как за счет новых классов препаратов, так и за счет отдельных препаратов, у которых могут быть небольшие, но важные различия, например мишени для ингибиторов янус-киназ (иJAK). Во-вторых, увеличивается число новых вакцин, в частности против SARS-CoV-2, и происходит модернизация уже имеющихся, в частности против гриппа и пневмококковой инфекции. В-третьих, изучаемые параметры (поствакцинальный ответ, время и способ измерения данного ответа), а также дизайны исследований (контрольные группы, сопутствующая терапия метотрексатом (МТ) или низкими дозами глюкокортикоидов (ГК)) не всегда сопоставимы, нередко противоречивы, что затрудняет анализ истинного влияния препарата на иммуногенность или эффективность вакцины.
В настоящем обзоре проанализированы данные о влиянии различных антиревматических препаратов на иммуногенность трех наиболее актуальных вакцин (гриппозных, пневмококковых и антиковидных) у ревматологических больных, а также обобщены основные положения рекомендаций по их вакцинации.
Грипп
Согласно данным M.P. Somes и соавт., у больных ревматоидным артритом (РА), наиболее часто встречающимся ИВРЗ, заболеваемость гриппом в 1,2–1,8 раза выше, чем в популяции [1]. При этом риск развития осложнений в течение 30 дней после постановки диагноза «грипп» увеличивается в 2,75 раза [2]. Речь, в частности, идет о пневмонии, инсульте, инфаркте миокарда.
В настоящее время накоплен большой опыт применения вакцин против гриппа у пациентов с разными ИВРЗ, в том числе получавших БПВП и ГИБП. Так, иммунизация трехвалентной вакциной против сезонного гриппа в данной популяции способствовала снижению частоты случаев развития инфекции и ее бактериальных осложнений, госпитализации и летальных исходов [3, 4].
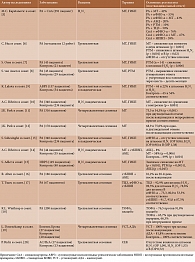
Данные о влиянии различных антиревматических препаратов на иммуногенность гриппозных вакцин, применяемых при ИВРЗ, представлены в табл. 1 [5–20].
Как видно из таблицы 1, ритуксимаб (РТМ) и MT снижают иммуногенность вакцины против гриппа.
Согласно данным шведских ученых, оценивших влияние различных схем лечения на иммунный ответ после вакцинации против пандемического гриппа у 291 пациента с воспалительными заболеваниями суставов, РТМ ассоциировался со значимо более низким иммунным ответом (p < 0,001) по сравнению с таковым на фоне применения других препаратов. Значимым прогностическим фактором сниженного постиммунизационного ответа был возраст старше 60 лет (p < 0,001). После вакцинации протективные уровни антител (АТ) в среднем поддерживались в течение 22 месяцев, за исключением получавших РТМ [5].
В рандомизированном контролируемом исследовании с участием 316 пациентов с РА оценивали влияние на иммуногенность гриппозной вакцины двухнедельной паузы в приеме MT по сравнению с непрерывным его приемом. У прерывавших лечение выявлены более высокие показатели удовлетворительного ответа на вакцину – 75,5 и 54,5% соответственно (p < 0,001). Однако при исходной терапии более низкими дозами MT (≤ 7,5 мг/нед) прерывание лечения не привело к значимому улучшению поствакцинального ответа [11]. В дальнейшем было показано, что у пациентов с РА, принимавших стабильную дозу МТ без ухудшения активности заболевания, недельный перерыв в терапии оказался таким же эффективным, как и двухнедельный, в плане устойчивого ответа на вакцинацию против сезонного гриппа. Таковой отмечался в течение 16 недель после вакцинации. Был сделан вывод, что больным следует пропускать прием МТ в течение одной или двух недель после вакцинации. Эта простая и безопасная стратегия может быть внедрена в рутинную клиническую практику и обеспечит адекватный охват вакцинацией без неопределенности в отношении безопасности и эффективности вакцин в данной популяции [12].
Абатацепт (АБЦ) способен снижать иммуногенность гриппозной вакцины, однако данные об этом малочисленны. В работах швейцарских и бразильских ученых по оценке вакцины против пандемического гриппа A/H1N1 2009 г. у лиц с ИВРЗ показано, что у применявших АБЦ имел место значимо меньший уровень сероконверсии, чем у лиц контрольной группы (p = 0,045 и p = 0,001 соответственно) [10, 15]. В то же время в работе R. Alten и соавт. отмечено, что вакцинация против сезонного гриппа позволила достичь протективных уровней антител у 81,2% больных РА, получавших АБЦ [16], что значимо не отличалось от показателей в популяции (89–97%) для каждого штамма вируса гриппа.
Несмотря на то что титры АТ после вакцинации снижались при лечении ингибиторами фактора некроза опухоли α (иФНО-α) и JAK, доля достигших серопротекции была аналогична таковой у не получавших эти препараты.
Ингибиторы интерлейкина (ИЛ) 6, ИЛ-12/ИЛ-23 и ИЛ-17, по-видимому, не влияют на вакцину против гриппа. V. Furer и соавт. оценивали иммуногенность трехвалентной гриппозной вакцины у 32 больных псориатическим артритом (ПсА), получавших секукинумаб (СЕК), и 17 здоровых лиц [21]. Через четыре – шесть недель уровни серопротекции были высокими и не различались у пациентов и здоровых добровольцев: для антигенов H1N1 – 81 и 93%, H3N2 – 90 и 100%, B – по 100% соответственно.
В Научно-исследовательском институте ревматологии им. В.А. Насоновой было проведено открытое проспективное сравнительное исследование с участием 93 пациентов с различными ревматическими заболеваниями (ревматоидный артрит, анкилозирующий спондилит (АС), системная склеродермия). Из них 54 получали МТ, 12 – иФНО-α + МТ, двое – АБЦ [22]. На вакцину ответили 70% пациентов и 75% лиц контрольной группы. Последнюю составили 40 здоровых добровольцев. Достоверных различий в отношении уровня поствакцинального ответа ни на одном из этапов контроля (первый, третий и шестой месяцы после вакцинации) не обнаружено.
В ходе многовариантного регрессионного анализа не выявлено значимого ухудшения ответа на гриппозную вакцину у больных РА, применявших ГК (в среднем 8 мг/сут) вместе с инфликсимабом и этанерцептом [23].
В высокодозной гриппозной вакцине концентрация антигенов в четыре раза превышает стандартную дозу. Поэтому несомненный интерес представляет использование таких вакцин при ИВРЗ, тем более что первые результаты свидетельствуют об их высокой эффективности. В двух рандомизированных контролируемых исследованиях у пациентов с РА при высокодозной вакцинации выявлены более высокие уровни сероконверсии по сравнению со стандартными дозами вакцины при аналогичных показателях безопасности [24, 25].
Пневмококковые инфекции
Значительная заболеваемость и смертность, связанные с инвазивными пневмококковыми инфекциями, подчеркивают важность профилактической вакцинации, особенно у пациентов с ИВРЗ. Для защиты от этих инфекций обычно применяют две пневмококковые вакцины: 13-валентную конъюгированную (ПКВ-13) и 23-валентную полисахаридную (ППВ-23). Иммуногенность обеих вакцин обычно определяется по постиммунизационным титрам АТ против серотипов, имеющихся в каждой вакцине. Однако показатель титра, произвольно выбранный в качестве защитного, может быть различным, поскольку уровень серопротекции для большинства пневмококковых заболеваний точно не установлен. В настоящее время в большинстве исследований иммунный ответ на вакцину расценивается как достаточный, если уровень пневмококковых АТ после иммунизации как минимум в два раза превышает исходный.
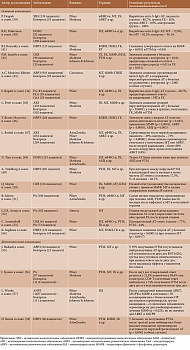
Данные по иммуногенности пневмококковых вакцин у больных ИВРЗ представлены в табл. 2 [18, 26–31].
При проведении метаанализа установлено, что у пациентов с ИВРЗ, получавших различные иммуносупрессивные препараты (МТ, иФНО-α, РТМ), иммунный ответ на ПКВ-13 и ППВ-23 был снижен по сравнению с контролем, при этом в большей степени на ПКВ-13 [32]. Среди применявших РТМ относительный риск (ОР) отсутствия сероконверсии, неспособности достичь двукратного увеличения концентрации АТ после вакцинации, варьировался от 4,91 при 95%-ном доверительном интервале (ДИ) 2,32–10,40 до 13,06 при 95%-ном ДИ 2,39–71,34 в зависимости от серотипа пневмококка. Несколько меньшим было влияние на иммунный ответ МТ, для которого значения ОР колебались от 2,0 (95% ДИ 1,06–3,77) до 5,41 (95% ДИ 2,09–13,98) в зависимости от пневмококкового серотипа. Ингибиторы ФНО-α действовали на поствакцинальный ответ в меньшей степени, при этом максимальное значение ОР составляло 0,65 (95% ДИ 0,29–1,44) [32]. Известно, что иФНО-α более избирательно влияют на иммунную систему, снижая миграцию дендритных клеток и выживаемость клеток памяти, ингибируя активацию Т-клеток [33]. Этим может быть объяснен менее выраженный их эффект на поствакцинальный ответ по сравнению с другими БПВП.
Точная интерпретация данных исследований по влиянию АБЦ на постиммунизационный ответ осложняется сопутствующим назначением МТ и/или отсутствием контрольных групп. Так, в неконтролируемом исследовании с участием вакцинированных ППВ-23 пациентов, получавших АБЦ подкожно (большинство из которых также принимали МТ), 74% достигли достаточного иммунологического ответа [16]. Однако в другом исследовании, включавшем 17 пациентов, получавших АБЦ внутривенно и вакцинированных ПКВ-7, 13 из которых одновременно получали МТ, наблюдалось снижение частоты достижения более чем двукратного увеличения поствакцинального титра пневмококковых антител по сравнению с принимавшими тоцилизумаб (ТЦЗ) или лицами контрольной группы [29]. Еще в одном исследовании бустерная стратегия (ПКВ-13, затем через восемь недель и более ППВ-23), примененная у получавших АБЦ, половина из которых также принимала МТ, способствовала улучшению поствакцинального ответа, который, однако, был ниже, чем у здоровых добровольцев [30].
Ингибиторы JAK ассоциируются с умеренным влиянием на частоту достижения положительных ответов на пневмококковые вакцины. В плацебо-контролируемом исследовании с участием больных РА, вакцинированных ППВ-23 после четырехнедельного приема тофацитиниба (ТОФА), отмечена меньшая частота удовлетворительного ответа по сравнению с применявшими плацебо (45,1 против 68,4%), особенно при одновременном применении МТ (31,6%). Прекращение приема ТОФА на одну неделю до и после вакцинации несколько улучшало ответ на ППВ-23 по сравнению с непрерывным приемом препарата, однако различия были статистически незначимы (84,6 и 75,0%) [18]. В другом исследовании с участием 106 пациентов с РА, получавших барицитиниб (БАРИ), 89% из которых также принимали МТ, и вакцинированных ПКВ-13, на вакцину ответили 68% [31]. Этот результат был аналогичен результату, полученному в исследовании по оценке ответа на ПКВ-13 у здоровых лиц и пациентов с РА, не принимавших БПВП [34].
Установлено, что низкие дозы ГК, принимаемые одновременно с другими БПВП/ГИБП, не влияют на уровень поствакцинальных пневмококковых АТ [31, 35, 36], в то время как повышенные дозы могут оказывать ингибирующий эффект. Среди пациентов с ИВРЗ, иммунизированных ППВ-23, 57% не ответивших на вакцинацию принимали преднизолон в дозе более 20 мг/сут, в то время как ответивших на вакцинацию было 22% (p = 0,07) [37]. В упомянутом выше исследовании БАРИ, в котором порядка 30% одновременно принимали ГК в низких дозах (в среднем 6,2 мг/сут), частота ответа на ПКВ-13 была сходной с таковой у не получавших ГК – 71 и 67% соответственно [31]. Среди принимавших МТ с инфликсимабом или без него сопутствующие низкие дозы ГК (менее 10 мг/сут в пересчете на преднизолон) не оказывали неблагоприятного воздействия на вакцинальный ответ [36]. Согласно результатам исследования, проведенного в Научно-исследовательском институте ревматологии им. В.А. Насоновой, терапия ГК в дозе 5–30 мг/сут (в пересчете на преднизолон) у больных системной красной волчанкой (СКВ), вакцинированных ППВ-23, не влияла негативно на показатели иммунного ответа. Более того, через год после вакцинации в 63,3% случаев сохранялось значимое повышение (в два раза и более) уровня антипневмококковых антител [38].
COVID-19
В настоящее время убедительно доказано, что пациенты с ИВРЗ составляют группу риска в отношении инфицирования SARS-CoV-2, тяжелого течения инфекции, обусловливающего необходимость госпитализации, в том числе в отделение реанимации и интенсивной терапии, и летального исхода. В качестве одного из методов борьбы с пандемией COVID-19 большинство экспертов указывают широкое применение вакцинации.
Данные, полученные при изучении иммуногенности вакцинации против COVID-19, в значительной степени согласуются с результатами исследований других вакцин.
Как следует из таблицы 3, РТМ, ГК, MT, АБЦ, микофенолата мофетил (ММФ) и иJAK ухудшают ответ на вакцину против SARS-CoV-2 у многих пациентов [39–58]. В крупнейшем на сегодняшний день обсервационном исследовании иммуногенности мРНК-вакцины BNT162b2 (Pfizer/BioNTech) у 686 пациентов с ИВРЗ по сравнению с контролем наблюдали 100%-ную сероконверсию, то есть появление IgG-антител к спайковому белку (анти-S-IgG-АТ). Показатели были значительно ниже у получавших РТМ – 39% (p < 0,0001), ММФ – 64% (p < 0,0001), АБЦ – 71% (p < 0,0001), иJAK – 90% (p = 0,02), МТ – 92% (p = 0,02) и ГК (средняя доза – 6,7 мг/сут) – 77% (p < 0,0001). Другие препараты (лефлуномид, гидроксихлорохин (ГХ), иФНО-α, ингибиторы ИЛ-6 и ИЛ-17) не оказывали значимого влияния на сероконверсию. В ходе логистического регрессионного анализа анти-В-клеточную терапию (АВКТ) (скорректированный OР 0,13 (p < 0,001)), терапию ГК (скорректированный OР 0,48 (p = 0,02)), АБЦ (скорректированный OР 0,14 (p < 0,001)) и ММФ (скорректированный OР 0,1 (p = 0,0013)) идентифицировали в качестве независимого предиктора плохого ответа на вакцину [59].
В исследовании с участием 66 пациентов с ИВРЗ, 33 из которых получали РТМ, не произошло сероконверсии после двух доз вакцины против SARS-CoV-2. После третьей вакцинации с использованием мРНК- или векторных вакцин у 49,2% наблюдалась сероконверсия, у 50% – нарастание уровня нейтрализующих АТ. У не получавших РТМ показатели сероконверсии и нейтрализующей активности были выше, чем у получавших данный препарат, – 78,8 и 18,2%, а также 80,0 и 21,9% соответственно. Гуморальные реакции на вакцинацию не различались у пациентов с положительным или отрицательным Т-клеточным ответом на исходном уровне – 59,3 и 49,7% соответственно. У больных, продолживших иммунизацию мРНК-вакцинами, отмечены сопоставимые ответы по сравнению с больными, перешедшими на векторные вакцины. Был сделан вывод, что полученные данные убедительно свидетельствуют в пользу проведения третьей вакцинации у пациентов с ИВРЗ, у которых отсутствует ответ на стандартную схему иммунизации, независимо от B-клеточного статуса [58].
Рекомендации по вакцинации при иммуновоспалительных ревматических заболеваниях
В соответствии с рекомендациями Европейского альянса ревматологических ассоциаций [60] и Американской коллегии ревматологов [61] вакцинация против гриппа является важной составляющей ведения больных ИВРЗ. С этой целью эксперты Американской коллегии ревматологов условно рекомендуют применять высокодозные или адъювантные гриппозные вакцины. В высокодозной гриппозной вакцине концентрация антигенов в четыре раза превышает стандартную дозу. Однако любая гриппозная вакцина лучше, чем ее отсутствие, а вакцинация против гриппа предпочтительнее ее отсрочки [61]. Поэтому при невозможности высокодозной иммунизации следует ввести стандартную дозу гриппозной вакцины. Адъювантная трех- или четырехвалентная вакцины против гриппа представляют собой вакцины со стандартной дозой, содержащие адъювант, индуцирующий выраженную продукцию антител без необходимости введения более высокой дозы антигена. На наш взгляд, большая реактогенность данных вакцин заставляет достаточно сдержанно относиться к рекомендации по их применению у больных ИВРЗ как минимум по двум причинам. Во-первых, в литературе отсутствуют данные о результатах крупномасштабных исследований, посвященных эффективности и, что не менее важно, безопасности адъювантных гриппозных вакцин у больных ИВРЗ. Во-вторых, за последнее десятилетие в ряде публикаций сообщалось, что вакцины, содержащие адъювант (в частности, алюминий), способны вызывать серьезные иммунологические побочные эффекты, включая развитие аутоиммунных заболеваний [62].
В соответствии с рекомендациями Консультативного комитета по практике иммунизации вакцинацию взрослых больных, получающих иммуносупрессивную терапию, необходимо начинать с 15-валентной ПКВ (пока не зарегистрирована в РФ), после которой не менее чем с восьминедельным интервалом может быть введена ППВ-23 [63]. Согласно российским федеральным клиническим рекомендациям, первоначальная вакцинация выполняется ПКВ-13, через восемь недель и более – ППВ-23, вторая доза ППВ-23 вводится через пять лет [64]. На наш взгляд, подобный подход к вакцинопрофилактике пневмококковых инфекций у взрослых пациентов ревматологического профиля неоднозначен, требует дальнейшего изучения и подтверждения целесообразности в ходе соответствующих клинических исследований. В то же время эксперты Европейского альянса ревматологических ассоциаций полагают, что нет оснований рекомендовать конкретную политику в отношении определенной пневмококковой вакцины исходя из имеющихся данных эффективности, иммуногенности и безопасности. Определенную роль в принятии решения о выборе вакцины может играть ее стоимость [60]. Следует отметить, что в настоящее время в США одобрена 20-валентная ПКВ [65], которая в ближайшем будущем может заменить схему бустерной вакцинации, по крайней мере у взрослых.
Несмотря на ряд нерешенных проблем, связанных с иммуногенностью и безопасностью вакцинации против SARS-CoV-2, эксперты всех международных и национальных ревматологических обществ [66, 67], включая Ассоциацию ревматологов России [68], придерживаются положения о том, что польза от вакцинации значительно превосходит потенциальный вред, связанный с развитием нежелательных явлений, поскольку вакцинация, несомненно, снижает риск инфицирования SARS-CoV-2 и тяжелого течения COVID-19. В соответствии с рекомендациями Ассоциации ревматологов России у пациентов с ИВРЗ, получающих иммуносупрессивную терапию, способную повлиять на иммуногенность вакцинации, целесообразно соблюдать следующие принципы [68]:
- МТ: отменить на одну неделю после каждой процедуры вакцинации;
- таргетные БПВП (иJAK), ММФ, циклофосфамид: пропустить применение в течение одной недели после каждой дозы вакцины;
- АБЦ для подкожного введения: пропустить применение в течение одной недели до и одной недели после первой дозы вакцины, вторая доза – без изменений;
- АБЦ для внутривенного введения: пропустить применение в течение четырех недель до и одной недели после первой дозы вакцины, вторая доза – без изменений;
- РТМ: начать вакцинацию минимально через 12 недель, оптимально через шесть месяцев от момента последнего введения препарата и за четыре недели до предстоящей инфузии;
- внутривенная пульс-терапия циклофосфамидом и ГК: вакцинация должна выполняться до проведения инфузий или не ранее чем через месяц после плановой инфузии.
Вопрос о временной отмене иммуносупрессивной терапии в связи с вакцинацией в каждом конкретном случае рекомендуется обсуждать предварительно.
Заключение
В настоящее время вакцинация является общепризнанной процедурой при оказании помощи пациентам с ИВРЗ, особенно получающим иммуносупрессивную терапию. В то же время указанное лечение может ухудшить ответ на вакцину. Этот вопрос становится все более актуальным в связи с выявлением новых патогенов, а также разработкой и внедрением инновационных вакцин. Однако исследования иммуногенности вакцин имеют определенные ограничения по причине несогласованности контролируемых параметров и неоднородности контрольных групп. По мере увеличения медицинского арсенала потребуются дополнительные клинические испытания, чтобы оценить влияние иммуносупрессивной терапии на вакцинальный ответ и отработать методики его оптимизации.
Конфликт интересов
Статья подготовлена в рамках научно-исследовательской работы ФГБНУ «Научно-исследовательский институт ревматологии им. В.А. Насоновой», № государственного задания 1021051503137-7.
Конфликт интересов отсутствует.
B.S. Belov, MD, PhD, N.V. Muravyeva, PhD, M.M. Baranova, A.N. Kulikov
V.A. Nasonova Research Institute of Rheumatology
Contact person: Boris S. Belov, belovbor@yandex.ru
The problem of comorbid infections in rheumatology seems to be very relevant in connection with the active introduction into clinical practice of innovative anti-inflammatory drugs, the action of which is directed at specific links in the pathogenesis of immuno-inflammatory rheumatic diseases. With the accumulation of global clinical experience, the association of the use of these drugs with an increasing risk of comorbid infections of various nature and localization has become clearly traced. The real way out of this situation is the creation, improvement and introduction into clinical practice of various vaccines. At the same time, a number of anti-rheumatic drugs may have a certain negative effect on the immunogenicity of some vaccines, which may lead to a decrease in the preventive effectiveness of the latter.
This review presents data on the effect of various anti-rheumatic drugs on the immunogenicity of vaccines against influenza, pneumococcal and new coronavirus infections in rheumatological patients. The necessity of observing certain time intervals when performing vaccination against the background of a number of immunosuppressive drugs used has been demonstrated. Further clinical studies are needed to assess the effect of immunosuppressive therapy on the vaccine response and to develop methods for its optimization.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.