Дупилумаб в дерматологии: атопический дерматит и перспективные направления
- Аннотация
- Статья
- Ссылки
- English
Данный дерматоз, как правило, отмечается у детей грудного и младшего возраста, в 80% случаев он саморазрешается к старшему детскому возрасту. Однако в последние годы патология все чаще встречается у взрослых.
Понимание иммунопатогенеза атопического дерматита привело к разработке и созданию препарата на основе моноклональных антител к интерлейкинам 4 и 13 дупилумаб. С 2019 г. препарат одобрен к применению в России у взрослых пациентов со среднетяжелым и тяжелым течением заболевания.
Существенно реже сообщается о применении дупилумаба при других дерматозах.
В статье представлены данные исследования эффективности и безопасности дупилумаба у взрослых больных (n = 21) со среднетяжелым и тяжелым течением атопического дерматита, в том числе перенесших COVID-19, которые получали лечение с 2021 по 2022 г. в отделении дерматовенерологии Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского.
Данный дерматоз, как правило, отмечается у детей грудного и младшего возраста, в 80% случаев он саморазрешается к старшему детскому возрасту. Однако в последние годы патология все чаще встречается у взрослых.
Понимание иммунопатогенеза атопического дерматита привело к разработке и созданию препарата на основе моноклональных антител к интерлейкинам 4 и 13 дупилумаб. С 2019 г. препарат одобрен к применению в России у взрослых пациентов со среднетяжелым и тяжелым течением заболевания.
Существенно реже сообщается о применении дупилумаба при других дерматозах.
В статье представлены данные исследования эффективности и безопасности дупилумаба у взрослых больных (n = 21) со среднетяжелым и тяжелым течением атопического дерматита, в том числе перенесших COVID-19, которые получали лечение с 2021 по 2022 г. в отделении дерматовенерологии Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского.


Введение
Атопический дерматит (АтД) является одним из наиболее распространенных хронических воспалительных заболеваний кожи, поражающим до 25% детей и 10% взрослых промышленно развитых стран [1]. Отмечаемое в последние годы дву- и трехкратное увеличение заболеваемости АтД взрослого населения может быть связано с влиянием таких провоцирующих факторов, как потливость, стресс, резкие колебания температуры окружающей среды, грубая одежда, использование мыла и детергентов [2, 3].
Наиболее важная роль в развитии АтД отводится генетическим, экзогенным и эндогенным факторам, приводящим к дисфункции эпидермального барьера, дисбалансу микробиома кожи и активации различных популяций Т-клеток. При этом в разные периоды течения заболевания может отмечаться активность как Th2-клеток, так и Th1-, Th17- и Th22-клеток.
В течение многих лет АтД рассматривался как дебют атопии – наследственной склонности к развитию опосредованных иммуноглобулином E (IgE) реакций, приводящих к высвобождению различных медиаторов воспаления, и первая ступень в развитии атопического марша – типичной последовательности развития АтД и пищевой аллергии на первом-втором годах жизни с последующим присоединением аллергического ринита и бронхиальной астмы, а также других иммуноопосредованных воспалительных заболеваний [4].
Клиническая картина
Проявления АтД варьируются в зависимости от возраста пациента. В настоящее время выделяют три фазы АтД: младенческую, которая приходится на возраст от двух-трех месяцев до двух-трех лет, детскую – от двух-трех лет до старшего детского возраста (периода пубертата) и подростковую (взрослую).
Примерно в 60% случаев заболевание манифестирует до года и характеризуется острым течением с выраженным экссудативным компонентом, интенсивным (нередко скальпирующим) зудом, а также генерализованной сухостью кожи. В младенческой фазе высыпания локализуются преимущественно на коже лица и разгибательных поверхностях конечностей. В 80% случаев процесс протекает в легкой форме, в 70% случаев разрешается спонтанно к старшему детскому возрасту [5–8].
Для детской фазы АтД характерны полиморфные высыпания: эритематозно-сквамозные очаги, фолликулярные и лихеноидные папулы, инфильтрация, а также обусловленные интенсивным зудом экскориации. Экссудативный компонент выражен в меньшей степени, чем в младенческой фазе. У пациентов детского возраста чаще поражаются кожа лица (эритема и шелушение вокруг глаз, складки Денни – Моргана, facies atopica) и сгибательные поверхности конечностей.
Для детей старшего возраста и взрослых характерны более выраженные участки лихенификации и инфильтрации кожи [9].
К факторам риска длительного течения АтД относят ранний и тяжелый дебют, семейный анамнез, а также наличие ранних аллергических реакций [5, 8].
Патогенез
Повышенный риск развития АтД наблюдается при отягощенном семейном анамнезе в отношении атопии, особенно АтД [10].
Одна из ключевых мутаций, связанная с развитием АтД, – это мутация гена, кодирующего филаггрин – белок, участвующий в формировании корнеоцитов. Мутация с потерей функции в этом гене приводит к нарушению барьерной функции кожи, увеличению трансэпидермальной потери воды и структурным изменениям кератиноцитов, что повышает проницаемость кожи для различных патогенов. Данная мутация ассоциируется с более тяжелым течением и менее благоприятным прогнозом АтД [11–14]. Помимо мутации гена, кодирующего филаггрин, идентифицировано более 34 локусов, генетические нарушения в которых обусловливают локальную или системную иммунную дисрегуляцию, дисфункцию эпидермального барьера и, как следствие, дебют АтД [15].
В основе патогенеза АтД лежит иммунозависимое Th2-воспаление кожи на фоне активации ILC2- и Th2-клеток, что сопровождается повышением ее чувствительности к внешним и внутренним раздражителям. Th2-клетки способствуют высвобождению интерлейкинов (IL) 5, 31, 13, 25 и 4, которые выполняют свои функции посредством внутриклеточных сигнальных путей JAK/STAT [16]. Высвобождение указанных интерлейкинов приводит к гиперпродукции специфического IgE [16]. IL-13 и IL-4 связаны с гиперпродукцией IgE посредством переключения класса синтеза иммуноглобулинов в В-клетках. IL-13 и IL-4 являются мощными индукторами TSLP. Высокий уровень данного белка в сочетании с повышением IL-31 обусловливает интенсивный зуд у пациентов. TSLP также может индуцировать выработку IL-5 и IL-13 ILC2-клетками.
При хронизации помимо сохраняющейся активности Th2-клеток в воспалительный процесс включаются Th1-, Th17- и Th22-клетки.
Дупилумаб
Эффективность и безопасность
Дупилумаб – полностью человеческое моноклональное антитело, нацеленное на α-цепь рецептора IL-4, являющуюся общей субъединицей рецепторов IL-4 и IL-13, что позволяет воздействовать на дифференцировку Th2-клеток, продукцию В-клетками IgE, альтернативную активацию макрофагов и таким образом блокировать механизмы, лежащие в основе иммунного Th2-воспаления [17].
Дупилумаб продемонстрировал высокую эффективность в лечении больных среднетяжелым и тяжелым АтД, а также благоприятный профиль безопасности. Так, на фоне его применения отмечалось небольшое количество побочных эффектов.
В проведенном в 2017 г. в США и Канаде рандомизированном двойном слепом клиническом исследовании эффект дупилумаба сравнивали с эффектом плацебо у 251 больного АтД в возрасте от 12 до 18 лет. Из них 43 получали препарат в дозе 200 мг раз в две недели, 39 – в дозе 300 мг в том же режиме, 84 – по 300 мг каждые четыре недели, 85 – плацебо. На 16-й неделе снижение на 75% по сравнению с исходным уровнем индекса площади и тяжести экземы (Eczema Area and Severity Index, EASI) было достигнуто в основных группах (группах дупилумаба) в 38,1–41,5% случаев, в контрольной группе (группе плацебо) – в 8,2%. Среди побочных эффектов терапии зафиксированы местные реакции на введение препарата и конъюнктивит, не приведшие к отмене препарата [18].
Согласно результатам проведенного в 2018 г. рандомизированного двойного слепого плацебоконтролируемого клинического исследования, в котором приняли участие 318 взрослых с АтД, ранее получавших циклоспорин с недостаточной эффективностью, к 16-й неделе комбинированное лечение дупилумабом и топическими глюкокортикостероидами (тГКС) способствовало снижению EASI как у получавших препарат один раз в неделю, так и у применявших его один раз в две недели [19]. Уменьшение EASI в этих двух группах было более существенным, чем в группе плацебо, использовавшей только тГКС, – -78,2 и -79,8 против -46,6% (p < 0,001) [19].
Еще в одном рандомизированном двойном слепом плацебоконтролируемом исследовании, в котором дупилумаб применялся в сочетании с тГКС, также был отмечен значимый эффект в отличие от группы плацебо на 16-й и 52-й неделях терапии [20]. Данное исследование проводилось в течение года и охватило 740 пациентов с АтД.
Долгосрочный, сопровождавшийся высоким профилем безопасности эффект дупилумаба, назначавшегося по 300 мг еженедельно, был продемонстрирован в исследовании с участием 2677 взрослых с АтД [21].
Несомненный интерес представляют результаты ретроспективного моноцентрового исследования эффективности препарата у 69 взрослых больных среднетяжелым и тяжелым АтД, получавших терапию дупилумабом в комбинации с системными препаратами (циклоспорином, преднизолоном, метотрексатом) и узкополосной УФВ-терапией в связи с неэффективностью дупилумаба в виде монотерапии. Переносимость комплексного лечения была удовлетворительной, побочные эффекты отсутствовали [22].
Побочные эффекты
Наиболее частым побочным эффектом, зафиксированным по данным трех основных исследований применения дупилумаба при АтД, был конъюнктивит (порядка 8% случаев). Он не требовал полной или временной отмены лечения, протекал в легкой или средней форме тяжести и полностью купировался на фоне симптоматической терапии [23].
В литературе встречается описание редких побочных эффектов терапии дупилумабом, например Т-клеточной лимфомы кожи (ТКЛК) [24]. Однако данная патология могла иметь место у пациентов с АтД изначально.
Применение у особых категорий пациентов
На момент написания статьи нам не удалось найти ни одного крупного исследования, в котором была бы доказана безопасность дупилумаба при ВИЧ-инфекции. Имеются лишь отдельные сообщения о его назначении в этой популяции. В частности, описан случай применения дупилумаба в дозе 300 мг каждые две недели у ВИЧ-инфицированной пациентки, получавшей антиретровирусную терапию, с диагнозом «узловатая почесуха». За месяц терапии удалось добиться выраженного улучшения кожного процесса: снижения EASI с 24 до 7 баллов, DLQI – с 9 до 5 баллов, NRSI – с 9 до 3 баллов [25].
Что касается терапии дупилумабом беременных с АтД, то на сегодняшний день нет убедительных данных о его эффективности и безопасности у этой категории больных. В то же время сообщалось о двух случаях его использования у беременных женщин, разрешившихся здоровыми и доношенными детьми в установленные сроки [26, 27]. Тем не менее применение дупилумаба в период беременности не рекомендовано [28].
Еще одна группа, у которой зачастую затруднено использование традиционных схем лечения АтД, – лица пожилого возраста. Перспективность применения дупилумаба у этой категории больных подтверждена результатами многоцентрового ретроспективного обсервационного исследования с участием 253 пациентов старше 65 лет с тяжелым течением дерматоза на фоне коморбидной патологии, такой как сахарный диабет, гипертоническая болезнь, хроническая почечная недостаточность, психические заболевания. При этом не было обнаружено статистически значимых различий в эффективности терапии у данной категории больных по сравнению с пациентами от 18 до 64 лет. Частота сходных побочных эффектов (гиперемия лица, конъюнктивит) в этих группах была также сопоставимой [29].
Результаты собственных исследований
Материал и методы
В отделении дерматовенерологии Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского курсовое лечение препаратом дупилумаб с 2021 г. и по настоящее время получал 21 пациент, из них 6 мужчин и 15 женщин в возрасте 31,8 ± 11,4 года. Длительность лечения от шести месяцев, в среднем 7,5 месяца.
В подавляющем большинстве случаев дебют заболевания приходился на грудной возраст. У 18 пациентов таковой отмечался до года, у одного – после трех лет, у одного – после пяти лет, еще у одного – после 11 лет.
У шести пациентов заболевание протекало на фоне атопической бронхиальной астмы. Аллергическим ринитом страдали восемь пациентов. У восьми ранее отмечались тяжелые аллергические реакции на лекарственные, бытовые и пищевые аллергены, включая отек Квинке (два пациента). У 19 больных в анамнезе имели место заболевания пищеварительной системы. Хроническим конъюнктивитом страдали два пациента, у одного из них была катаракта. Психоневрологические заболевания ранее были диагностированы у 17 больных, один из которых страдал эпилепсией.
Течение АтД в каждом случае характеризовалось устойчивостью к проводимой терапии и частыми рецидивами, даже несмотря на прием системных препаратов. Так, из 11 пациентов десять получали системные ГКС (сГКС), один – сГКС в комплексе с циклоспорином.
Как видно из табл. 1, у большинства (52,4%) больных заболевание носило торпидный характер, практически с отсутствием клинической ремиссии.
Степень тяжести АтД, оцениваемая по SCORAD, в среднем составляла 52,5 ± 15,7 балла. Этот показатель рассчитывался перед началом лечения и каждой последующей инъекцией дупилумаба.
В таблице 2 представлены данные о распределении больных в зависимости от величины SCORAD.
До начала терапии состояние 10 (47,6%) пациентов оценивалось как средней степени тяжести, 11 (52,4%) – как тяжелое (см. табл. 2).
У пяти больных обострения не купировались приемом сГКС в дозе от 30 до 40 мг/сут в сроки от семи месяцев до двух лет. При этом кожный процесс и связанные с ним субъективные ощущения (зуд, эстетические дефекты) существенно нарушали психологическое состояние пациентов.
Лечение дупилумабом в дозе 300 мг один раз в две недели с начальной дозой 600 мг проводилось в комплексе с эмолентами.
Результаты лечения
Инъекции дупилумаба все больные переносили удовлетворительно. Среди побочных эффектов отмечались конъюнктивиты, возникшие у четырех пациентов в течение первых четырех недель лечения.
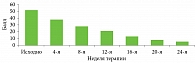
Положительная динамика значений SCORAD наблюдалась у всех лиц с АтД (рисунок).
В течение первых четырех недель от начала терапии дупилумабом все больные отмечали значительное уменьшение зуда, сухости и гиперемии очагов поражения. Через восемь недель величина SCORAD снизилась до 29,4 ± 11,4 балла от исходной 52,7 ± 13,7 балла (р < 0,05), то есть на 44%. К 16-й неделе лечения полного или почти полного регресса высыпаний (SCORAD < 5 баллов) достигли шесть пациентов. В связи с недостаточной эффективностью терапии 15 пациентам были назначены топические ГКС и топические ингибиторы кальциневрина (ТИК). В результате к 20-й неделе практически в каждом случае наблюдалось почти полное разрешение высыпаний (SCORAD < 6 баллов). Однако у двух пациентов с тяжелым АтД (SCORAD до лечения 91,7 и 78,5 балла соответственно), несмотря на назначение наружной терапии, SCORAD составлял 47,2 и 36,5 балла соответственно.
К 24-й неделе на фоне лечения дупилумабом у 19 зафиксирован полный или почти полный регресс высыпаний – SCORAD снизился до 6,8 ± 5,3 балла (р < 0,05), то есть на 87%. У двух пациентов с недостаточным ответом на указанную терапию после применения тГКС и ТИК показатели SCORAD уменьшились до 36,2 и 29,1 балла соответственно.
Несмотря на высокую эффективность лечения, у пациентов сохранялась склонность к сезонным обострениям АтД. Так, с октября по февраль у 12 пациентов отмечалось ухудшение кожного процесса (SCORAD при максимальном эффекте составлял 4,4 балла, при обострении – 14,3 балла), что, однако, не требовало назначения системной терапии, и в каждом случае процесс разрешался после аппликации ТИК и тГКС.
Особенности использования в период пандемии COVID-19
Важной особенностью работы стало изучение эффективности дупилумаба при АтД в период пандемии COVID-19. Два пациента из 21 перенесли COVID-19 до инициации терапии, четверо – во время лечения (одна пациентка была инфицирована дважды: до инициации и во время терапии). Трое переболевших продолжили получать терапию дупилумабом в соответствии с установленным режимом с удовлетворительной переносимостью и без ускользания эффекта. В одном случае произошел перерыв, из-за чего межинъекционный интервал был увеличен до 23 дней. В каждом случае коронавирусная инфекция протекала в легкой форме, состояние больных не требовало госпитализации. Лишь у одной пациентки наблюдалось обострение АтД, при этом назначения тГКС оказалось достаточно для устранения незначительного количества вновь появившихся высыпаний.
Ни один больной не сообщил о появлении специфических, характерных для COVID-19 высыпаний.
Один пациент отметил, что при близком контакте (проживание в одной квартире без соблюдения мер предосторожности) с больным COVID-19 (подтверждено положительным результатом ПЦР-теста) заражения не произошло (дважды отрицательный результат ПЦР-теста в отсутствие клинической картины).
Обсуждение результатов
Полученные нами результаты согласуются с данными других исследований о высокой эффективности и относительно удовлетворительной переносимости дупилумаба при АтД [21, 22]. На 16-й неделе применения препарата положительная клиническая динамика была зафиксирована у всех пациентов, что сопровождалось снижением значений SCORАD в среднем с 52,0 до 14,4 балла. Однако у 12 получавших терапию дупилумабом имело место незначительное обострение кожного процесса, связанное с осенне-зимним периодом. Для существенного снижения его выраженности было достаточно аппликаций тГКС и/или ТИК.
Таким образом, можно констатировать, что использование дупилумаба обеспечивало стойкую ремиссию заболевания.
Побочные эффекты, связанные с применением дупилумаба, были представлены аллергическим конъюнктивитом. У четырех (19,1%) пациентов на четвертой неделе лечения патология была купирована тГКС. В этой связи важно отметить, что ни у одного из них не было сопутствующей инфекции COVID-19, а также односторонности процесса. Ранее у данных больных также отмечалось развитие конъюнктивита во время обострения АтД (при контакте с аллергенами). В этой части наши данные не противоречат сообщениям зарубежных коллег. Так, частота возникновения конъюнктивита как побочного эффекта терапии дупилумабом фиксировалась у 8% больных АтД [23].
На сегодняшний день за рубежом активно обсуждаются практические аспекты применения дупилумаба, в частности риск развития ТКЛК. Поэтому нас насторожило отсутствие полного клинического эффекта у двух пациентов, а именно: наличие отдельных зудящих эритематозно-сквамозных лихенифицированных бляшек, локализовавшихся на нижних конечностях. Однако результаты гистологического исследования биоптата, взятого из очага поражения, не подтвердили наличия злокачественного процесса. В дальнейшем лечение этих больных дупилумабом было продолжено и привело к положительной динамике клинической картины. В этой связи следует отметить рекомендацию экспертной группы настороженно относиться к очагам поражений АтД, не поддающимся терапии дупилумабом, и с целью исключения ТКЛК проводить гистологическое и/или генотипическое исследование биоптата кожи [30]. Вопрос о возможности дупилумаба выступать в качестве триггера развития ТКЛК или влиять на ее прогрессирование требует дальнейшего изучения.
В связи с сообщениями о частой ассоциации АтД с узловатой почесухой [31] перспективным является применение дупилумаба и при данном заболевании. Однако широкое внедрение дупилумаба в терапию узловатой почесухи станет возможным только после публикации результатов масштабных клинических исследований PRIME. В настоящее время известно о его эффективном применении у 11 таких пациентов [32].
С учетом предполагаемой патогенетической роли IL-4 в развитии вульгарной пузырчатки дупилумаб, способный ингибировать рецепторы IL-4, может стать перспективной и многообещающей опцией и при этом заболевании [33].
На возможность применения дупилумаба при буллезном пемфигоиде Левера указывают данные о его эффективности у 12 таких больных [34].
Дупилумаб оказался эффективным у пациентки 32 лет при синдроме Нетертона (аутосомно-рецессивном врожденном ихтиозе), которая ранее длительно и безуспешно лечилась циклоспорином и аппликациями мази такролимус [35].
С начала пандемии COVID-19 перед врачами разных специальностей возникал вопрос о необходимости продолжения или отмены терапии хронического заболевания, особенно новым генно-инженерным препаратом. В этой связи важно отметить, что дупилумаб, не обладая качеством иммуносупрессанта, лишь ингибирует провоспалительные IL-4 и IL-13. Он не снижает количество CD4+-клеток и не повышает вирусную нагрузку при АтД на фоне ВИЧ-инфекции даже при применении в течение 23 месяцев [25]. Напротив, полагают, что дупилумаб способен предотвращать развитие цитокинового шторма при тяжелом течении COVID-19 за счет ингибирования IL-4 и IL-13 [36, 37].
В нашем исследовании четыре пациента в период лечения дупилумабом оказались инфицированными SARS-CoV-2. Все они перенесли инфекцию в легкой форме. При этом COVID-19 не ухудшал течение АтД. Только одна пациентка отметила появление незначительного количества высыпаний, субъективно никак не беспокоящих и полностью регрессировавших после применения тГКС.
Международные данные также свидетельствуют, что у пациентов с АтД, получавших дупилумаб, течение COVID-19 было менее тяжелым, чем у использовавших другую системную терапию АтД или в отсутствие ее [38].
Выводы
Полученные нами результаты подтвердили высокую эффективность и удовлетворительную переносимость ингибитора IL-4 и IL-13 дупилумаба у взрослых пациентов с АтД.
Наличие COVID-19 не влияло на эффективность терапии дупилумабом.
Yu.V. Molochkova MD, PhD, O.V. Karzanov, PhD, V.A. Molochkov, MD, PhD, Prof., M.K. Monayenkova
Moscow Regional Research and Clinical Institute
Peoples’ Friendship University of Russia
Contact person: Yuliya V. Molochkova, yulia.molochkova@yandex.ru
Atopic dermatitis is a common chronic skin disease of multifactorial nature. Its development is associated with inflammatory reactions mediated by immunoglobulin E.
This dermatosis, as a rule, is noted in infants and young children, in 80% of cases it resolves itself by older childhood. However, in recent years, it has become increasingly common in adults.
Understanding the immunopathogenesis of atopic dermatitis led to the development and creation of dupilumab – a drug based on monoclonal antibodies to interleukins 4 and 13. Since 2019, the drug has been approved for use in Russia in adult patients with moderate and severe course of the disease.
The use of dupilumab in other dermatoses is much less frequently reported.
The article presents data on the efficacy and safety of dupilumab in 21 adult patients with moderate to severe atopic dermatitis, including those who underwent COVID-19, who received treatment from 2021 to 2022 in the Department of Dermatovenerology of M.F. Vladimirsky Moscow Regional Research Clinical Institute.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.