Эффективность и безопасность комбинации мио-инозитола и фолиевой кислоты в восстановлении фертильности
- Аннотация
- Статья
- Ссылки
- English
Согласно данным Всемирной организации здравоохранения, количество бесплодных браков в развитых странах достигает 10–15%. В России эта цифра также высока, несмотря на внедрение новых подходов к лечению бесплодия и вспомогательных репродуктивных технологий [1, 2]. Так, в отдельных регионах нашей страны этот показатель приближается к критическому – 20% [3, 4]. Установлено, что каждая седьмая супружеская пара в России сталкивается с проблемами планирования семьи вследствие бесплодия [5]. При этом ситуация с каждым годом только ухудшается: в 2005 г. частота встречаемости бесплодия в возрастной группе от 18 до 49 лет составляла 146,6 случая на 100 тыс. населения, в 2016 г. эта цифра возросла до 278,8 случая на 100 тыс. населения [6].
В развивающихся странах с низкой доступностью вспомогательных репродуктивных технологий медицинская помощь, как правило, ограничивается профилактикой и лечением женской инфертильности [7], в экономически развитых странах существенная роль отводится коррекции мужского бесплодия и решению проблем индивидуальной совместимости. Так, наиболее высокая распространенность мужской инфертильности отмечена в Центральной и Восточной Европе (8–12%), Австралии (8–9%). В Северной Америке этот показатель достигает 4,5–6,0% при общей вариации от 2,5 до 12,0% [8]. Кроме того, увеличилось количество работ, подтверждающих особую роль мужского бесплодия [9, 10], в частности снижение в последние десятилетия количества и качества сперматозоидов.
В настоящее время под бесплодием понимается отсутствие беременности при регулярной половой жизни в течение года и неприменении средств контрацепции [2, 5]. Бесплодие пары может быть обусловлено как бесплодием женщины, так и бесплодием мужчины, часто констатируют сочетанное бесплодие. Один или оба партнера в бесплодном браке часто способны зачать ребенка в другой паре, поэтому всегда необходимо помнить о возможной партнерской несовместимости.
Наиболее частыми причинами бесплодия являются урогенитальная инфекция, психосексуальные расстройства, иммунологические факторы – 30,0–38,7% случаев [11, 12]. Однако иногда причину бесплодия установить не удается даже после тщательного обследования пары.
Факторы риска и возможные патогенетические механизмы
Причины бесплодия подразделяют на модифицируемые и немодифицируемые.
Фертильный потенциал мужчин снижается на фоне врожденных и приобретенных заболеваний мочеполовой системы, урогенитальных инфекций, повышения температуры органов мошонки (при варикоцеле), эндокринных расстройствах, генетических аномалиях и вследствие патологических иммунных реакций. Если этиологию мужского бесплодия выявить не удается, устанавливают диагноз «идиопатическое бесплодие» – частота встречаемости превышает 30% [13]. У таких пациентов не выявляют патологии при физикальном осмотре и по результатам лабораторных исследований (включая гормональный профиль). Необходимо отметить, что идиопатическое бесплодие обычно является результатом сочетанного воздействия различных факторов.
К модифицируемым факторам риска мужской инфертильности относят питание, употребление алкоголя и кофеина, избыточную массу тела, недостаточную физическую активность, психоэмоциональный стресс, курение, неконтролируемое использование лекарственных средств, выбор одежды, горячие ванны, а также воздействие факторов окружающей среды: биологических, физических (радиация, электромагнитные волны) и токсических (пестициды, тяжелые металлы, эндокринные дизрапторы и др.) [14]. В 2017 г. эксперты Организации Объединенных Наций заявили о ложности утверждения о необходимости использования пестицидов для обеспечения пищевой безопасности. В частности, были приведены данные о 200 тыс. смертельных отравлений различными пестицидами в год. Постоянный контакт с пестицидами ассоциируется с риском развития онкологических, эндокринных заболеваний, нарушениями развития, стерильностью населения [15]. В то же время в лекарственных препаратах и БАД растительного происхождения допускаются следы пестицидов. Чаще всего это дихлордифенил трихлорметилметан (ДДТ) и его метаболиты. Установлено, что ДДТ проникает через плаценту и обнаруживается в тканях эмбрионов или мертворожденных детей у женщин, даже не имевших производственного контакта с ДДТ (попадание с пищей) [16]. При рекомендации препаратов растительного происхождения стоит обратить особое внимание на их состав.
Среди факторов риска мужского бесплодия также указывают электромагнитное излучение мобильных телефонов, применение анаболических стероидов, опиоидов [17].
К основным причинам мужского бесплодия прежде всего следует отнести варикоцеле – расширение вен гроздевидного сплетения семенного канатика. Частота его встречаемости у мужчин без нарушения сперматогенеза составляет 8–13%, при инфертильности – 25–40% [18]. При варикоцеле изменяются гемодинамика и температурный режим в органе, что приводит к нарушению сперматогенеза [19].
Частота встречаемости крипторхизма при бесплодии достигает 9,4%, в общей популяции – 2,4% [20].
При азооспермии генетические нарушения выявляются в 20% случаев [21], однако данное состояние также может быть обусловлено экскреторным бесплодием (обструкция семявыносящих путей), тяжелыми гормональными нарушениями, приводящими к угнетению сперматогенеза.
Существует корреляция между фертильностью и массой тела. Так, доля пациентов с бесплодием и избыточной массой тела составляет 40%, бесплодием и ожирением – 34% [22].
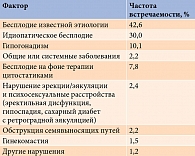
Факторы, ассоциированные с мужским бесплодием, представлены в таблице [23].
Одним из патогенетических механизмов развития бесплодия считается окислительный стресс. Патологическое накопление активных форм кислорода приводит к повреждению клеток репродуктивной системы, чувствительных к окислительному стрессу. При сбое антиоксидантной системы семенных канальцев происходит повреждение сперматозоидов. В результате отмечаются снижение их подвижности и способности к оплодотворению, нарушение созревания и быстрая гибель. Наиболее выражен окислительный стресс при воспалительных заболеваниях мочеполовой системы, варикоцеле, гормональных нарушениях [24, 25].
Следует также отметить роль антиспермальных антител (АСА). АСА могут образовываться в результате нарушения гемотестикулярного барьера [26]. Чаще АСА выявляют у пациентов после вазэктомии, травм, перекрута яичка, обструкции половых путей или при инфекционных процессах [27].
Ведущую роль в женском бесплодии играют трубно-перитонеальные патологии. Частота встречаемости такого бесплодия варьируется от 35 до 60%. Преобладает трубный фактор – 35–40%, перитонеальный отмечается лишь в 9,2–34% случаев [28]. При первичном бесплодии частота поражения маточных труб составляет 29,5–70,0%, при вторичном – 42–83%. Таким образом, трубно-перитонеальную патологию выявляют практически у половины пациенток, обратившихся по поводу бесплодия [29]. К основным причинам поражения маточных труб, сопровождающегося спаечным процессом в органах малого таза и формированием трубно-перитонеального бесплодия, относят воспалительные заболевания органов малого таза в анамнезе (инфекции, передаваемые половым путем), внутриматочные манипуляции (искусственные аборты, диагностические выскабливания эндометрия, осложнения после использования внутриматочных средств и т.д.), оперативные вмешательства на органах малого таза и брюшной полости, эндометриоз [28].
Эндокринное женское бесплодие характеризуется полиморфностью клинических и лабораторных проявлений. Причинами такового являются гонадотропная недостаточность, синдром поликистозных яичников (СПКЯ), яичниковая недостаточность, гиперпролактинемия, гипотиреоз.
Иммунная система принимает активное участие в процессе имплантации, адгезии и инвазии трофобласта и, как следствие, нормальном развитии беременности [30]. Иммунологическое бесплодие обусловливается появлением специфических антител к сперматозоидам, цервикальной слизи, эндометрию, фолликулярной и перитонеальной жидкости, а также к блестящей оболочке ооцита, клеткам зернистого слоя, возможно также существование тотальных аутоиммунных оофоритов.
Диагностика
Диагностика бесплодия предполагает проведение комплекса мероприятий.
- Сбор анамнеза: длительность бесплодия, зачатия/беременности, частота и особенности половой жизни, регулярность менструального цикла, наличие заболеваний, способных вызывать бесплодие, общее состояние здоровья, употребление алкоголя, курение, изменение массы тела.
- Физикальный осмотр: для женщин – состояние матки, яичников, влагалища (гинекологический осмотр), для мужчин – осмотр органов мошонки (наличие тестикул, придатков), оценка размера тестикул, наличие варикоцеле (урологический/андрологический осмотр).
- Инструментальный осмотр: ультразвуковое исследование органов половой системы, оценка проходимости маточных труб (у женщин) – гистеросальпингография, эхогистеросальпингоскопия, семявыносящих протоков (у мужчин), щитовидной железы (при необходимости), ультразвуковое исследование надпочечников (при клинических признаках гиперандрогении), компьютерная томография и/или магнитно-резонансная томография (показаны пациентам с повышением концентрации пролактина в плазме крови при подозрении на микроаденому гипофиза), гистероскопия (у женщин).
- Лабораторное обследование: оценка гормонов гипоталамо-гипофизарной системы, половых гормонов, функции надпочечников и щитовидной железы, спермограммы, совместимости пары по HLA II класса, инфекционный скрининг, генетическое исследование (при необходимости), иммунологический скрининг, тест на овуляцию.
Только после комплексного обследования обоих партнеров решается вопрос о терапии бесплодия.
Эффективность и безопасность Иноферта
Комбинация мио-инозитола, известного как витамин В8, или витамин юности, и фолиевой кислоты является безопасным и эффективным инструментом для улучшения прогноза при бесплодии, вызванном различными причинами, в том числе у пациенток с СПКЯ.
Одной из первых комбинаций мио-инозитола и фолиевой кислоты на европейском рынке стал Иноферт, зарегистрированный на российском рынке компанией «Италфармако». В России Иноферт применяется при различных патологиях, в том числе для поддержания овуляции.
Иноферт выпускается в виде порошка в саше. Как было отмечено ранее, в состав препарата входят особо чистый, очищенный в том числе от фитатов, а также всех видов пестицидов, мио-инозитол 1000 мг и фолиевая кислота 100 мкг.
Иноферт рекомендуется применять по схеме: по два саше утром и вечером. Длительность курса – от одного до шести месяцев. Содержимое саше предварительно разводят в 100–150 мл воды.
Важность мио-инозитола и его производных для поддержания физиологического протекания широкого круга процессов в организме была подтверждена результатами систематического анализа более чем 37 тыс. публикаций [10].
Мио-инозитол и его производные участвуют во внутриклеточной передаче сигнала и обеспечении функционирования рецепторов инсулина, репродуктивных гормонов, факторов роста, катехоламинов и др. Большое число производных мио-инозитола взаимодействуют со специфическими белками, играющими важную роль в функционировании репродуктивной системы и развитии эмбриона.
Мио-инозитол является важным синергистом фолатов и других витаминов (В₅, РР), а также минералов (кальция, магния).
Перечисленные эффекты мио-инозитола указывают на существенные перспективы его применения в гинекологической практике [10].
Иноферт способствует снижению концентрации лютеинизирующего гормона, пролактина, соотношения «лютеинизирующий гормон/фoлликулocтимулиpующий гopмoн». Таким образом мио-инозитол способствует восстановлению регулярности менструального цикла и овуляции.
Фосфат-производные мио-инозитола осуществляют передачу сигнала от инсулинового рецептора внутрь клеток разных тканей, что приводит к повышению экспрессии транспортера глюкозы, инициирует процессы адсорбции рецептора инсулина, стимулирует переработку углеводов и жиров для поддержания энергетического метаболизма клетки. Данные метаболические процессы обусловливают снижение риска развития инсулинорезистентности, диабета, повышения массы тела и ожирения [31].
Мио-инозитол и его производные необходимы для реализации эффектов гонадолиберина, лютеинизирующего гормона и фолликулостимулирующего гормона, тем самым они оказывают положительное влияние на репродуктивную функцию (воздействуя, в частности, на инвазию трофобласта при закреплении бластоцисты, функцию яичников, ооцитов и плаценты).
Следует подчеркнуть, что помимо прямых специфических воздействий мио-инозитол поддерживает функционирование репродуктивной системы опосредованно. Систематический анализ публикаций по мио-инозитолу показал, что основной функцией мио-инозитола и его производных является внутриклеточная передача сигнала в центральной нервной системе, сердечно-сосудистой, иммунной системах и др. [10]. Были установлены по крайней мере 120 инозитолфосфатзависимых белков, специфически участвующих в различных физиологических процессах. Более половины инозитолзависимых белков вовлечены в поддержание сердечно-сосудистой системы, иммунитета и структур соединительной ткани (включая кости, хрящ, кожу). Не менее важна роль мио-инозитола в метаболизме углеводов (прежде всего в сигнальном каскаде инсулина) и функционировании почек и печени. Все эти эффекты мио-инозитолзависимых белков, наряду с взаимодействием со специфическими белками, важны для нормального функционирования репродуктивной системы как женщин, так и мужчин.
Специфическое воздействие мио-инозитола на репродуктивную функцию связано с участием его производных в сигнальных каскадах белковых рецепторов гонадолиберина (гонадотропин-рилизинг-гормона), лютеинизирующего гормона и фолликулостимулирующего гормона.
В клинических исследованиях, проведенных в европейских странах у пациенток с гестационным сахарным диабетом, Иноферт снижал показатели глюкозы натощак и инсулина, а также способствовал повышению адипонектина [32].
У женщин с отягощенной наследственностью в отношении СД 2 типа Иноферт снижал риск развития гестационного сахарного диабета, частоту макросомии (статистически значимо), среднюю массу плода [33].
Дефицит мио-инозитола признан фактором риска формирования пороков развития лицевого черепа – расщелин губы и/или неба. У матери низкий уровень мио-инозитола сыворотки крови (< 13,5 мкмоль/л) ассоциировался с повышением риска развития пороков в три раза (95%-ный доверительный интервал (ДИ) 1,2–7,4), у детей (< 21,5 мкмоль/л) – в 3,4 раза (95% ДИ 1,3–8,6) [34].
У эмбриона на этапе органогенеза вследствие дефицита мио-инозитола индуцируются эмбриопатии, вызываемые гипергликемией [35].
Как было сказано выше, одной из основных причин бесплодия у женщин является гормонально-метаболическая дисфункция яичников. У пациенток часто отмечается инсулинорезистентность с компенсаторной гиперинсулинемией. Иноферт улучшает функции яичников, а также метаболические и гормональные показатели у пациенток с СПКЯ [36].
Применение Иноферта в дозе 2 г/сут в течение 24 недель у пациенток с СПКЯ способствовало снижению количества ановуляторных циклов в четыре раза, а в дозе 4 г/сут этот эффект достигался за три-четыре недели, что указывает на дозозависимость и возможность долговременного приема [37]. Мио-инозитол улучшал функциональное состояние ооцитов у пациентов с СПКЯ, прошедших циклы интрацитоплазматических инъекций сперматозоидов [38].
Комбинация мио-инозитола с фолиевой кислотой при проведении цикла стимуляции суперовуляции для ЭКО позволяла уменьшить число используемых зрелых ооцитов, сократить дозу гонадотропина и увеличить количество случаев успешной имплантации эмбрионов [39].
На фоне гиперинсулинемии при СПКЯ формируются нарушения метаболизма андрогенов, их клиническим проявлением служат гирсутизм, акне и ожирение по андрогенному типу. Установлено, что Иноферт в дозе 4 г/сут в течение трех месяцев снижал концентрацию лютеинизирующего гормона, тестостерона, свободного тестостерона, инсулина в плазме, а через шесть месяцев – гирсутизм и акне [40].
Мио-инозитол регулирует осмолярность и объем семенной плазмы, экспрессию белков, необходимых для эмбриогенетического развития, и подвижность сперматозоидов. Такая терапия у пациентов с олигоастенотератозооспермией улучшала подвижность сперматозоидов за счет значительного увеличения доли сперматозоидов с высоким митохондриальным мембранным потенциалом [41].
Применение мио-инозитола улучшает не только подвижность сперматозоидов, но и их способность к зачатию. Данная терапия положительно коррелировала с беременностью (пять пар из 50 участвовавших в исследовании) [42].
Безопасность Иноферта доказана в многочисленных исследованиях и метаанализах. При использовании комбинации «мио-инозитол + фолиевая кислота» (4000 мг/400 мкг) не наблюдалось никаких побочных эффектов, в том числе тех, которые обычно возникают при использовании других сенсибилизаторов инсулина, в частности метформина в высоких дозах (1500 мг/сут).
Заключение
Иноферт может быть применен при женском и мужском бесплодии различной этиологии, в том числе идиопатическом.
Эффективность и безопасность Иноферта доказаны не только в отдельных клинических исследованиях, но и в метаанализах. Иноферт повышает вероятность зачатия, улучшает исходы беременности, положительно влияет на инсулинорезистентность и ожирение.
A.N. Oranskaya, A.M. Mkrtumyan, A.A. Kamalov, E.V. Vartanyan, A.K. Tsaturova, V.A. Levin
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Lomonosov Moscow State University
RUDN University
Clinic of Assisted Reproductive Technologies ‘Children from the Test Tube’
Contact person: Alevtina Nikolayevna Oranskaya, anor2004@list.ru
The article considers the possible causes of male, female and combined infertility in married couples, modern approaches to the diagnosis and infertility treatment as well as possible ways to increase fertility. Provided issues for discussion and further analysis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.