Эффективность и профиль безопасности нового антигиперурикемического препарата Аденурик (фебуксостат) при подагре
- Аннотация
- Статья
- Ссылки
- English

Подагра – хроническое системное метаболическое заболевание, связанное с нарушением пуринового обмена и приводящее к гиперурикемии. Основными клиническими проявлениями заболевания признаны рецидивирующий острый артрит и подагрические тофусы.
В последние десятилетия распространенность данной патологии увеличивается [1]. Согласно результатам эпидемиологических исследований, подагрой страдает не менее 1–3% взрослого населения. Пик заболеваемости у мужчин приходится на 40–50 лет, у женщин – на 60 лет и старше. Соотношение мужчин и женщин – 4:1, среди пациентов старше 65 лет – 3:1 [2].
Особенности течения подагры сегодня во многом связаны с тем, что она все чаще развивается у лиц молодого возраста. Отмечается раннее вовлечение в патологический процесс почек и сердечно-сосудистой системы.
Для лиц пожилого возраста характерно более тяжелое течение заболевания – полиартикулярное поражение, частые и длительные обострения, множественные тофусы и более выраженная гиперурикемия.
Установлено, что с каждой декадой жизни число больных подагрой увеличивается, а у пациентов старше 60 лет расстройство экскреторной функции почек при менее выраженном суставном синдроме отмечается раньше и чаще [2, 3].
Согласно Американской ассоциации ревматологов (American College of Rheumatology – ACR) современная классификация подагры включает бессимптомную гиперурикемию, острый подагрический артрит, хроническую тофусную подагру, которая характеризуется формированием в течение ряда лет околосуставных тофусов в результате рецидивирующих подагрических атак, мочекаменный уролитиаз и другую ассоциированную с подагрой патологию почек [4].
Среди причин, приводящих к накоплению уратов в организме, на первом месте стоят повышенный биосинтез мочевой кислоты (МК) и снижение экскреции уратов почками.
Нормальный уровень МК в организме составляет 1000 мг при скорости обновления в пределах 650 мг/сут. Ее источник – пуриновые соединения, поступающие с пищей, а также образующиеся в организме в процессе обмена нуклеотидов.
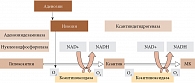
Мочевая кислота является конечным продуктом метаболизма пуринов и образуется в результате каскада реакций «гипоксантин – ксантин – мочевая кислота», контролируемых сложной системой ферментных реакций. На рисунке 1 представлены синтез, промежуточные и конечные этапы окисления гипоксантина и ксантина в МК, контролируемые ксантиноксидазой [5].
В норме МК не оказывает повреждающего действия на органы и ткани. Патогенетическое значение имеют лишь отложения МК в виде кристаллов. Растворимость МК зависит от рН мочи. При снижении рН до 5,75 кислота становится недиссоциированной.
В норме уровень МК в сыворотке крови у мужчин не должен превышать 0,41 ммоль/л (7 мг/дл), у женщин – 0,36 ммоль/л (6 мг/дл). В норме процессы синтеза и выведения МК сбалансированы, однако при нарушении одного из этапов обмена пуринов отмечается ее избыточное содержание в сыворотке крови – гиперурикемия [4].
В настоящее время выделяют две группы факторов, приводящих к гиперурикемии:
- обусловливающие повышенное образование МК:
- специфические ферментные дефекты;
- снижение активности гипоксантин-гуанинфосфорибозилтрансферазы;
- повышение активности фосфорибозилпирофосфат-синтазы;
- усиление обмена нуклеотидов;
- особенности питания;
- обусловливающие медленное выведение МК:
- нарушение функции почек;
- прием лекарственных препаратов;
- накопление кетоновых соединений;
- наличие артериальной гипертензии.
Кроме того, имеют значение раса, пол, возраст, нарушение липидного обмена, потребление алкоголя.
У больных подагрой уровень гипоксантина и ксантина в плазме крови повышен, в моче – снижен [4]. Выявлена положительная корреляция между почечным клиренсом МК, гипоксантина и ксантина. Это свидетельствует о том, что у большинства пациентов нарушена экскреция не только МК, но и ее предшественников.
Выбор фармакотерапии при подагре достаточно сложная задача, особенно при назначении уратснижающих препаратов: важно обеспечить длительное, непрерывное, нередко пожизненное лечение [5, 6].
Основными целями антигиперурикемической терапии являются [7]:
- достижение значений МК < 360 мкмоль/л;
- уменьшение очагов накопления уратов в организме;
- сокращение объема (размеров) тофусов;
- значительное снижение частоты приступов подагры.
Уратснижающие препараты влияют на продукцию МК посредством воздействия на ксантиноксидазу, участвующую в расщеплении пуринов: оксидации гипоксантина до ксантина, ксантина – до МК [8].
Аллопуринол – первый ингибитор ксантиноксидазы, который в течение длительного времени применяли для коррекции гиперурикемии при подагре. Однако аллопуринол имеет ряд недостатков. Его применение ассоциируется с серьезными побочными эффектами, такими как аллергические реакции (зуд, кожные высыпания, отек Квинке, васкулит), диспепсические явления, повышение температуры тела, острая почечная недостаточность, агранулоцитоз, синдром Стивена – Джонсона. Кроме того, у ряда пациентов с подагрой аллопуринол неэффективен даже в максимальной дозе [7–9].
Противопоказаниями к применению аллопуринола служат выраженные нарушения функции печени, гемохроматоз, беременность, детский возраст (кроме злокачественных заболеваний с гиперурикемией) [8].
Взаимодействие аллопуринола с другими лекарственными средствами способно приводить к cупрессии костного мозга (при сочетанном приеме с циклофосфамидом), увеличению частоты кожной сыпи (при сочетанном приеме с ампициллином).
Все сказанное выше способствовало разработке и внедрению фебуксостата – селективного ингибитора ксантиноксидазы.
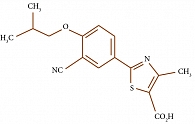
В апреле 2008 г. Европейский союз одобрил препарат к применению. Ему было присвоено торговое название Аденурик® (Adenuric). Фебуксостат – 2-(3-циано-4-изобутоксифенил)-4-метилтиазол-5-карбоксильная кислота (рис. 2) – сильный селективный непуриновый ингибитор ксантиноксидазы, его константа ингибирования in vitro не превышает 1 нМ. Важно, что фебуксостат в отличие от аллопуринола подавляет активность как окисленной, так и восстановленной формы фермента ксантиноксидазы. При этом ингибирование фермента осуществляется посредством образования высокоаффинных связей. Аллопуринол связывается только с окисленной формой фермента, и эта связь более слабая.
Фебуксостат практически не влияет на активность других ферментов пуринового и пиримидинового метаболизма [10–12].
После приема внутрь фебуксостат абсорбируется быстро и в большом объеме (примерно 84%). Период полувыведения составляет 5–8 часов и зависит от дозы препарата. Прием пищи, равно как и одновременный прием антацидов, на скорость всасывания и показатели концентрации вещества в плазме крови не влияет. Связь активного вещества фебуксостата с белками крови достигает 99,2%. Метаболизм осуществляется преимущественно в печени – благодаря связыванию с глюкуронозилтрансферазой и в незначительной степени с участием ферментов системы цитохромов Р450.
Фебуксостат и его метаболиты выводятся через кишечник и почки [12].
Рекомендуемая начальная доза фебуксостата составляет 80 мг/сут. Если в течение месяца уровень МК в крови не снижается до целевых значений (< 360 мкмоль/л), дозу увеличивают до 120 мг/сут.
Препарат можно принимать независимо от приема пищи. Противопоказаниями для назначения препарата являются повышенная чувствительность к фебуксостату и/или любому из вспомогательных веществ, возраст до 18 лет, беременность и период лактации, а также наследственная непереносимость галактозы, дефицит лактазы и синдром мальабсорбции глюкозы и сахарозы.
С осторожностью следует принимать препарат пациентам с застойной сердечной недостаточностью, почечной недостаточностью тяжелой степени.
Снижение уровня МК в сыворотке крови на фоне приема фебуксостата происходит быстро, поэтому контролировать ее концентрацию необходимо через две недели после начала лечения.
Прием фебуксостата не приводит к прогрессированию хронической болезни почек по сравнению с приемом аллопуринола, доза которого титруется в зависимости от функции почек.
Фармакокинетика фебуксостата не изменяется у пациентов с легкой или средней степенью дисфункции почек [13].
Лекарственное взаимодействие фебуксостата с другими препаратами клинически незначимо. Ибупрофен и варфарин не влияют на связывание фебуксостата с белками плазмы [14]. Получены данные об отсутствии взаимного влияния фебуксостата и колхицина, напроксена, индометацина [15]. В отношении взаимодействия с диуретиками установлено, что одновременное применение 80 мг фебуксостата и 50 мг гидрохлортиазида в сутки в течение семи дней не отражается на фармакокинетике фебуксостата, хотя приводит к небольшому повышению уровня МК в сыворотке крови [16].
Основные фармакологические и клинические различия между фебуксостатом и аллопуринолом представлены в таблице [11].
Эффективность фебуксостата изучена в большом количестве международных клинических исследований фаз II и III FACT, APEX, CONFIRMS, а также расширенных долгосрочных открытых исследованиях FOCUS, EXCEL. В этих исследованиях действие фебуксостата сравнивалось с действием плацебо и аллопуринола.
В многоцентровом плацебоконтролируемом клиническом исследовании FOCUS у пациентов с подагрой изучались эффективность и профиль безопасности фебуксостата в дозах 40, 80 и 120 мг/сут [13]. Результаты исследования продемонстрировали, что количество больных с уровнем МК < 6,0 мг/дл и степень снижения уровня МК были достоверно выше у принимавших фебуксостат, чем у получавших плацебо.
В общей сложности на момент последнего визита целевого уровня МК < 6,0 мг/дл достигли 83% пациентов, включенных в исследование (95/114).
Среднее процентное снижение уровня МК относительно исходного уровня для всех визитов колебалось в пределах 45–59%.
Для всех визитов доля пациентов, достигших уровня МК < 5 и < 4 мг/дл, варьировалась от 47 до 66% и от 11 до 28% соответственно [15].
Снижение уровня МК ассоциировалось с уменьшением риска развития обострений и тофусов.
В рандомизированном двойном слепом 52-недельном многоцентровом исследовании фазы III FACT, посвященном сравнительной оценке эффективности и безопасности фебуксостата и аллопуринола [16, 17], участвовали 760 пациентов с подагрой.
Уровень МК до начала лечения превышал 480 мкмоль/л. Достижение целевого уровня МК (< 360 мкмоль/л) отмечалось в трех последних измерениях у 53% пациентов, получавших фебуксостат в дозе 80 мг/сут, у 62% пациентов, принимавших фебуксостат в дозе 120 мг/сут, и только у 21% пациентов, получавших аллопуринол в дозе 300 мг/сут.
Количество нежелательных явлений было сопоставимым во всех группах. Наиболее часто наблюдались повышение уровня печеночных ферментов, диарея, головная боль.
Таким образом, в исследовании была продемонстрирована более высокая эффективность фебуксостата в снижении уровня МК по сравнению с аллопуринолом при сопоставимом профиле безопасности.
В другом плацебоконтролируемом исследовании – EXCEL [14] в течение 40 недель у пациентов с подагрой сравнивалась эффективность фебуксостата (80 или 120 мг) и аллопуринола (300 мг). В исследовании приняли участие свыше тысячи пациентов с уровнем МК > 480 мкмоль/л. После одного месяца терапии уровень МК < 360 мкмоль/л достигнут более чем у 80% больных, принимавших фебуксостат (обе дозы), и только у 46% больных, получавших аллопуринол. Тофусы устранены в 46, 36 и 29% случаев соответственно.
Во всех группах терапии частота нежелательных явлений (включая сердечно-сосудистые), скорректированная с учетом десятикратного различия доз фебуксостата и аллопуринола, была примерно одинаковой.
Таким образом, долговременная эффективность фебуксостата в обеих исследуемых дозах обеспечивала практически полное нивелирование подагрических приступов и уменьшение среднего количества тофусов.
Аналогичные результаты получены в ходе 28-недельного мультицентрового рандомизированного двойного слепого исследования фазы III CONFIRMS. В нем сравнивались эффективность и безопасность фебуксостата и аллопуринола
более чем у 2,2 тыс. пациентов с подагрой. У 65% из них диагностировано нарушение функции почек.
Участники исследования были рандомизированы на группы терапии фебуксостатом в дозе 40 или 80 мг/сут и аллопуринолом в дозе 200 или 300 мг/сут (в зависимости от функции почек) [18].
У пациентов с различной степенью тяжести почечной недостаточности получены следующие результаты. Среди принимавших фебуксостат в дозе 80 мг/сут целевого уровня МК достигли 72% пациентов, тогда как среди получавших фебуксостат в дозе 40 мг/сут или аллопуринол 200/300 мг/сут таковых насчитывалось 50 и 42% соответственно. Не получено статистически достоверных различий между группами по частоте развития неблагоприятных реакций, в том числе сердечно-сосудистых катастроф.
Базируясь на результатах клинических исследований фебуксостата под торговым названием Аденурик® (компания Menarini – Von Heyden GmbH), Европейское агентство по лекарственным средствам (European Medicines Agency – EMA) одобрило препарат к применению пациентами с хронической гиперурикемией при заболеваниях, сопровождающихся отложением кристаллов уратов, в том числе при наличии тофусов и/или подагрического артрита.
Особый интерес с точки зрения клинической практики представляют постмаркетинговые исследования эффективности и профиля безопасности фебуксостата. Одно из них – мультицентровое открытое проспективное обсервационное клиническое исследование, проведенное в условиях рутинной медицинской практики в Германии [19]. В нем участвовали 5948 тыс. пациентов, среди них 72,6% мужчины. Средний возраст участников составил 63,7 года.
Лечение фебуксостатом в течение четырех недель позволило статистически достоверно снизить уровень МК с 534,0 ± 114,6 до 372,0 ± 150,0 ммоль/л. При этом 67% пациентов достигли целевого уровня МК (366,0 ± 59,4 ммоль/л).
Всего зарегистрировано 178 нежелательных реакций (в основном обострений подагры) у 152 (2,6%) пациентов.
В Японии изучали эффективность фебуксостата у пациентов в возрастной категории ≥ 65 лет (2015 г.). Результаты исследования подтвердили эффективность фебуксостата в отношении снижения уровня МК в данной группе больных. При этом указанный эффект был более существенным среди женщин и не зависел от исходного уровня МК [20].
Таким образом, фебуксостат (Аденурик®) продемонстрировал эффективность в отношении снижения уровня МК. При этом профиль безопасности и его переносимость оказались значительно выше, чем таковые аллопуринола. Важно и то, что пациентам пожилого возраста не требуется коррекции дозы препарата и его можно назначать при хронической почечной недостаточности.
I.B. Belyayeva, V.I. Mazurov, M.S. Petrova
North-Western State Medical University named after I.I. Mechnikov
Contact person: Irina Borisovna Belyayeva, belib@mail.ru
Gout is a chronic systemic metabolic disorder linked to impaired purine turnover and resulting in hyperuricemia. Lowering of uric acid is a basis for anti-gout therapy allowing for preventing development of tophi, gouty nephropathy, cardiovascular and cerebral complications. Allopurinol used for a long time for controlling hyperuricemia has a number of disadvantages: limited/lacked effect in some patients, and serious side effects. In contrast, Adenuric® (febuxostat) as a selective xanthine oxidase inhibitor demonstrates high efficacy in lowering and subsequent maintenance of uric acid level as well as better tolerability.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.