Эффективность применения бемипарина у беременных с хронической болезнью почек разных стадий
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. В исследование включены 66 женщин с ХБП, имевших в анамнезе желанные беременности. Выбранная группа женщин рассматривалась и как исследуемая, и как контрольная. Были ретроспективно проанализированы исходы 117 анамнестических беременностей без использования низкомолекулярных гепаринов и антиагрегантов (контрольная группа). Проспективно наблюдали за течением и исходом последующих 68 беременностей у тех же пациенток на фоне применения бемипарина и дипиридамола.
Результаты. В исследуемой группе частота благоприятных исходов беременности была достоверно выше, чем таковая в группе сравнения – 97,1 и 49,6% соответственно (p < 0,001). Никому из пациенток не потребовалась постоянная заместительная почечная терапия в течение 12 месяцев после родов. Улучшение исходов беременности наблюдалось у всех женщин вне зависимости от стадии ХБП.
Заключение. У женщин с ХБП I–III стадии применение бемипарина и дипиридамола под контролем параметров тромбодинамики способствовало повышению частоты благоприятного исхода беременности – рождению живых детей и выживанию их в постнатальном периоде без значимого ухудшения функции почек у матерей в течение года наблюдения после родов.
Материал и методы. В исследование включены 66 женщин с ХБП, имевших в анамнезе желанные беременности. Выбранная группа женщин рассматривалась и как исследуемая, и как контрольная. Были ретроспективно проанализированы исходы 117 анамнестических беременностей без использования низкомолекулярных гепаринов и антиагрегантов (контрольная группа). Проспективно наблюдали за течением и исходом последующих 68 беременностей у тех же пациенток на фоне применения бемипарина и дипиридамола.
Результаты. В исследуемой группе частота благоприятных исходов беременности была достоверно выше, чем таковая в группе сравнения – 97,1 и 49,6% соответственно (p < 0,001). Никому из пациенток не потребовалась постоянная заместительная почечная терапия в течение 12 месяцев после родов. Улучшение исходов беременности наблюдалось у всех женщин вне зависимости от стадии ХБП.
Заключение. У женщин с ХБП I–III стадии применение бемипарина и дипиридамола под контролем параметров тромбодинамики способствовало повышению частоты благоприятного исхода беременности – рождению живых детей и выживанию их в постнатальном периоде без значимого ухудшения функции почек у матерей в течение года наблюдения после родов.





Хроническая болезнь почек (ХБП) является наднозологическим понятием, под которым следует понимать наличие любых маркеров повреждения почек, персистирующих в течение трех месяцев и дольше вне зависимости от нозологического диагноза. Согласно отечественным национальным рекомендациям, в медицинской документации сначала указывается нозологический диагноз и уже после него термин ХБП с указанием стадии, определенной по скорости клубочковой фильтрации (СКФ), индекс альбуминурии/протеинурии и вид заместительной почечной терапии (если таковая проводится).
ХБП устанавливается на основании следующих критериев:
- наличие любых клинических маркеров повреждения почек, подтвержденных с интервалом не менее трех месяцев;
- наличие любых маркеров необратимых структурных изменений органа, выявленных однократно при прижизненном морфологическом исследовании органа или при его визуализации;
- СКФ менее 60 мл/мин/1,73 м2, где 1,73 м2 – средняя площадь поверхности тела человека, в течение трех месяцев и дольше, вне зависимости от наличия других признаков повреждения почек.
Важно, что больные с трансплантированной почкой вне зависимости от наличия или отсутствия маркеров повреждения почек всегда рассматривались как пациенты с ХБП.
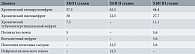
Согласно классификации, разработанной Национальным почечным фондом США (National Kidney Foundation) в 2002 г., ХБП стратифицируется на пять стадий по уровню СКФ, при этом стадия III подразделяется на две подстадии – А и B в зависимости от степени риска прогрессирования в сторону ХБП V стадии и развития сердечно-сосудистых осложнений (табл. 1) [1].
Беременность у пациенток с ХБП чаще, чем в общей популяции, имеет неблагоприятный исход из-за повышенной частоты акушерских и перинатальных осложнений, причем риск такого исхода и для плода, и для матери нарастает с ухудшением функции почек [2, 3]. Неблагоприятные исходы во многом обусловлены осложнениями беременности, связанными с патологией плаценты, преэклампсией, внутриутробной задержкой роста плода, его антенатальной, интранатальной или постнатальной гибелью, преждевременной отслойкой нормально расположенной плаценты, поздними потерями беременности. Несмотря на это, в настоящее время вероятность успешной беременности достаточно высока даже у женщин с хронической почечной недостаточностью, преимущественно при ХБП III стадии (СКФ 30–59 мл/мин/1,73 м2), особенно при планировании беременности, интенсивном наблюдении командой специалистов за течением беременности, использовании активной профилактики осложнений [3–7].
Одно из наиболее грозных осложнений беременности – преэклампсия, которая развивается после 16–18 недель гестации и проявляется артериальной гипертензией и протеинурией. Патологические процессы, приводящие к преэклампсии, начинаются задолго до клинической симптоматики. Развернутая клиническая картина преэклампсии всегда свидетельствует о глубоком поражении органов и систем. Эффективной терапии преэклампсии в настоящее время не существует, беременность прерывают, в том числе на таких сроках гестации, когда шансы новорожденного на выживание минимальны. Кроме того, присоединение преэклампсии приводит к острому повреждению почек, что у женщин с ХБП может существенно ускорить прогрессирование почечной недостаточности [8].
Частота преэклампсии растет по мере прогрессирования дисфункции почек, достигая 40% при уровне креатинина в сыворотке 125–180 мкмоль/л и 60% и более при значениях этого показателя выше 180 мкмоль/л [7]. В то же время хорошо известно повышение риска развития ХБП у женщин, ранее перенесших преэклампсию. Возможно, это отчасти объясняется наличием общих патогенетических механизмов ХБП и преэклампсии: дисбалансом ангиогенных и антиангиогенных факторов, а также нарушениями регуляции ренин-ангиотензин-альдостероновой системы [9].
Отсроченное развитие клинической симптоматики и отсутствие действенных методов лечения диктуют необходимость поиска эффективной профилактики преэклампсии. С этой целью широко используются антитромбоцитарные препараты. Описано успешное применение ацетилсалициловой кислоты и дипиридамола у женщин с заболеваниями почек [10]. По данным крупного систематического обзора, охватившего более 32 тыс. пациенток с высоким риском преэклампсии, прием антитромбоцитарных препаратов (ацетилсалициловой кислоты в низких дозах (75–100 мг) или дипиридамола 225 мг/сут) снижал риск развития преэклампсии, родов до 37 недель гестации и смерти новорожденных [11]. Следует отметить, что прием ацетилсалициловой кислоты в РФ в соответствии с инструкцией по медицинскому применению разрешен только во втором триместре беременности.
При высоком риске развития преэклампсии применяются и прямые антикоагулянты. Доказано, что у женщин с антифосфолипидным синдромом исходы беременности улучшаются при использовании низкомолекулярных гепаринов (НМГ) и малых доз ацетилсалициловой кислоты [12–14]. Не столь однозначны данные о приеме антикоагулянтов для профилактики неблагоприятного исхода беременности у женщин с отягощенным акушерским анамнезом, но без очевидных тромбофилий, хотя и в этом случае были получены положительные результаты. Например, при тяжелой преэклампсии в анамнезе применение НМГ в сочетании с ацетилсалициловой кислотой в качестве профилактики преэклампсии, внутриутробной задержки роста плода и неблагоприятного исхода беременности более эффективно, чем применение с этой целью только ацетилсалициловой кислоты [15–17].
В экспериментальных работах показана важная роль гепарина в процессе инвазии и дифференцировки трофобласта [18]. У женщин с привычным невынашиванием беременности неясной этиологии прием НМГ начиная с первого триместра и на протяжении всей беременности существенно снижал частоту ранних и поздних потерь плода [19]. Метаанализ 2014 г. показал эффективность НМГ в профилактике повторных тяжелых, связанных с повреждением плаценты, осложнений беременности – преэклампсии, рождения детей с низкой массой тела (менее 10-го перцентиля), преждевременной отслойки нормально расположенной плаценты, поздних выкидышей [20]. В то же время систематический обзор P. de Jong и соавт. не подтвердил снижение частоты развития акушерских осложнений у женщин с необъяснимым повторным невынашиванием беременности (имеющих или не имеющих врожденную тромбофилию) на фоне приема НМГ и/или антиагрегантов. Авторы отмечают необходимость проведения дальнейших хорошо организованных рандомизированных контролируемых исследований [21].
Безусловно, важную роль в описанном выше профилактическом эффекте гепарина играет его антикоагулянтный эффект. Беременность в норме является гиперкоагуляционным состоянием, но чрезмерная гиперкоагуляция способствует развитию осложнений, в том числе тяжелой преэклампсии [21]. Поэтому применение гепарина патогенетически оправданно, но его действие не ограничивается антикоагулянтным эффектом. Гепарин прямо и опосредованно участвует в адгезии бластоцисты к эндометрию и последующей инвазии [22], усиливает ангиогенез в кондиционированной клетками плаценты человека среде, что косвенно подтверждает роль дополнительных (неантикоагулянтных) эффектов гепарина в профилактике преэклампсии [23]. Имеются клинические данные о достоверном повышении уровня циркулирующего плацентарного фактора в третьем триместре беременности у женщин, получавших НМГ, при этом уровень sFlt1 был сравним с таковым в контрольной группе [24]. Эти находки могут объяснять эффективность НМГ в профилактике осложнений беременности, связанных с нарушением функции плаценты. Особенно важным условием профилактического действия антиагрегантов и гепарина является их своевременное назначение – на этапе планирования или в ранние сроки беременности (первый триместр), это позволяет добиться полноценной имплантации и плацентации и снизить риск развития преэклампсии [18].
Очень небольшое число работ посвящено оценке эффективности применения НМГ и антиагрегантов с целью улучшения исходов беременности у пациенток с ХБП, а также лабораторных исследований, необходимых для контроля дозы препарата, послужили побудительным мотивом проведения нашего исследования.
Цель
Оценить эффективность использования бемипарина и дипиридамола под контролем параметров теста тромбодинамики для улучшения исходов беременности у женщин с ХБП.
Материал и методы
По этическим причинам невозможно провести рандомизированное сравнительное исследование эффективности влияния антикоагулянтов и антиагрегантов на исход беременности у женщин с хронической почечной недостаточностью. В этой связи из 159 пациенток с ХБП, наблюдавшихся во время беременности в Московском областном научно-исследовательском институте акушерства и гинекологии (МОНИИАГ) и у нефролога в Московском областном научно-исследовательском клиническом институте им. М.Ф. Владимирского, было отобрано 66 женщин. Женщины имели в анамнезе желанные беременности, в течение которых не получали антикоагулянты и антиагреганты. Во время последней (последних) беременности, протекавшей под наблюдением специалистов МОНИИАГ, эти же пациентки получали дипиридамол и НМГ (бемипарин). Таким образом, выбранная для изучения группа женщин рассматривалась и как исследуемая проспективная группа, и как ретроспективная контрольная. Сравнивались исходы 117 желанных беременностей без использования антикоагулянтов и антиагрегантов (проанализированных ретроспективно) и результаты проспективного наблюдения за течением и исходом последующих 68 беременностей у тех же пациенток на фоне применения гепарина и дипиридамола (две пациентки вынашивали две последние беременности на фоне приема гепарина и дипиридамола). Все пациентки в начале наблюдения в МОНИИАГ были проинформированы о высоком риске беременности для матери и для плода при ХБП, особенно при почечной недостаточности, однако женщины приняли решение о пролонгировании беременности.
В исследуемой группе 41 беременность протекала при ХБП I стадии, восемь – ХБП II стадии, 19 – ХБП III стадии, а в группе сравнения – 79 беременностей – при ХБП I стадии, 13 – ХБП II стадии, 25 – ХБП III стадии. Стадия ХБП определялась в соответствии со значением СКФ до беременности, поскольку из-за физиологических изменений почечного кровотока и плазмотока СКФ возрастает уже в ранние сроки беременности [25, 26]. Беременности без профилактического применения антикоагулянтов и антиагрегантов протекали либо при той же стадии ХБП, либо ХБП была менее выраженной.
Средний возраст на момент наступления последней беременности у пациенток с ХБП I стадии составил 31,1 ± 4,5 года, с ХБП II стадии – 30,2 ± 5,7 года, а с ХБП III стадии – 30,8 ± 4,3 года. Ни у кого из пациенток на момент зачатия (при последней беременности) не отмечалось обострения заболевания почек. В структуре нозологических форм ХБП при всех ее стадиях преобладали хронический гломерулонефрит и хронический пиелонефрит (табл. 2).
В исследуемой группе 30 (44,1%) из 68 беременностей протекали на фоне артериальной гипертензии, проводилась медикаментозная коррекция повышенного артериального давления. Среди женщин с ХБП I стадии имело место десять (24,4%) случаев артериальной гипертензии (в девяти случаях артериальная гипертензия была до беременности, в одном выявлена впервые во время беременности). Среди женщин с ХБП II стадии – шесть (75%) наблюдений (пять исходно, одно впервые). Среди женщин с ХБП III стадии – 14 (73,7%) случаев (13 исходно, один впервые).
Благоприятным исходом беременности считалось рождение ребенка без аномалий развития и выживание его в постнатальном периоде в отсутствие значимого ухудшения функции почек у матери после родов (отсутствие стойкого снижения СКФ или снижения СКФ менее 25% от исходного уровня). Неблагоприятным исходом – антенатальная или интранатальная гибель плода, или смерть в младенческом возрасте (в течение первого года жизни) и/или стойкое снижение СКФ у матери на 25% и более от уровня до беременности, или необходимость начала постоянной заместительной почечной терапии в течение года после родов.
При беременностях, протекавших под наблюдением акушера-гинеколога МОНИИАГ и нефролога, на этапе планирования беременности или на ранних сроках гестации (первый триместр) пациентки начинали получать бемипарин 0,2 мл = 3500 анти-Ха МЕ. Все пациентки принимали дипиридамол внутрь в дозе 225 мг/сут (по 75 мг три раза в день). Антикоагулянты отменялись не позднее чем за 12 часов до родов, но в первые сутки послеродового периода (не ранее чем через шесть часов после родов) введение гепарина возобновлялось и продолжалось в течение пяти-шести недель.
Интегральную оценку системы гемостаза проводили с помощью теста тромбодинамики на системе диагностической лабораторной «Регистратор тромбодинамики Т-2» («Гемакор», Россия). При этом определяли следующие параметры: время задержки роста сгустка (Tlag), начальную скорость роста сгустка (Vi), стационарную скорость роста сгустка (Vst), размер сгустка на 30-й минуте исследования (cs), плотность сгустка (D). Плазму для анализа получали из образцов крови из локтевой вены, заготовленных стандартным образом в вакуумных пластиковых пробирках с 3,3%-ным (0,109 М) цитратом натрия при соотношении «кровь:цитрат» 9:1. Определение параметров теста тромбодинамики проводилось в свободной от тромбоцитов плазме. Для этого сначала кровь центрифугировали в течение 15 минут при 1600 g и комнатной температуре, далее отбирали верхнюю часть (-75%) полученной плазмы и дополнительно ее центрифугировали пять минут при 10 000 g и комнатной температуре.
Статистическая обработка данных. Показатели, подчиняющиеся нормальному распределению, были представлены в виде M ± SD (среднее значение ± стандартное отклонение). Показатели с распределением, отличающимся от нормального, описывались при помощи медианы и диапазона колебаний, качественные показатели – в долях (процентах) либо абсолютных значениях. Для оценки достоверности различия качественных признаков (долей в группах) использовался точный критерий Фишера. В качестве критического уровня достоверности различий был принят уровень менее 0,05.
Результаты
В группе проспективного наблюдения были проанализированы частота развития и тяжесть преэклампсии, а также сроки родоразрешения и масса тела детей при рождении (табл. 3). Частота преэклампсии на всех стадиях ХБП была выше, чем в общей популяции беременных, и возрастала по мере прогрессирования ХБП. При этом у беременных с ХБП III стадии преэклампсия развивалась достоверно чаще, чем у женщин с ХБП I стадии (52,6 и 19,5% соответственно, p = 0,015). Тяжелая преэклампсия также наблюдалась чаще при ХБП III стадии по сравнению с ХБП I стадии (21,0 против 2,4%, p = 0,017). Течение беременностей на фоне ХБП II и III стадии по этим показателям достоверно не различалось. При сравнении течения беременностей при ХБП I и II стадии отмечалась лишь тенденция к повышению частоты преэклампсии в целом (p = 0,088) и умеренной преэклампсии (p = 0,068) при ХБП II стадии, хотя преэклампсия при ХБП II стадии встречалась более чем в два раза чаще. По-видимому, отсутствие статистической достоверности объясняется небольшим числом пациенток с ХБП II стадии.
Медиана срока родов при беременностях, протекавших на фоне ХБП III стадии, как и медиана массы тела детей при рождении, была достоверно ниже по сравнению с таковыми при беременностях у пациенток с ХБП I и II стадии.
Ни в одном случае у беременных и новорожденных не наблюдалось серьезных геморрагических осложнений. Никто из женщин не нуждался в заместительной почечной терапии в течение 12 месяцев после родов.
Мы не исследовали частоту и тяжесть преэклампсии в группе сравнения (беременности в анамнезе), поскольку в представленных медицинских документах было недостаточно данных для проведения такого анализа.
Среди неблагоприятных исходов беременности в группе сравнения наблюдались самопроизвольный выкидыш (16,2% от всех желанных беременностей), неразвивающаяся беременность (13,7%) и перинатальная смерть (10,3%) (табл. 4). В 8,6% случаев беременность была прервана по медицинским показаниям, связанным с заболеванием почек (высокая протеинурия, и/или тяжелая артериальная гипертензия, и/или ухудшение функции почек), или ранним развитием преэклампсии. В 1,7% случаев отмечена внематочная беременность.
В исследуемой группе была одна перинатальная смерть (1,5% от всех беременностей) глубоко недоношенного плода женского пола, родившегося с массой 670 г при сроке беременности 25 недель у пациентки с тяжелой преэклампсией, и одно (1,5%) прерывание беременности в связи с развившейся преэклампсией и нефротическим синдромом при сроке беременности 21 неделя. Оба этих неблагоприятных исхода наблюдались у женщин с ХБП III стадии, то есть в группе пациенток с наиболее высоким риском развития осложнений беременности. Примечательно, что в проспективной группе не наблюдались самопроизвольные выкидыши и неразвивающиеся беременности.
Был проведен анализ исходов беременностей в зависимости от стадии ХБП. На фоне профилактического применения бемипарина и дипиридамола благоприятный исход имел место в 97,1% случаев, в то же время анамнестические беременности без использования бемипарина и дипиридамола в 49,6% случаев закончились неудачей, p < 0,001 (табл. 5). При этом беременности в основной группе развивались в заведомо менее благоприятных условиях – при большей продолжительности ХБП, а у отдельных женщин – и при более выраженном снижении функции почек.
При ХБП II стадии получены сходные результаты: на фоне применения антикоагулянтов и антиагрегантов все исходы были благоприятными, а в группе сравнения доля неблагоприятных исходов составила 46,2%. Разница не была достоверной (p = 0,076), вероятно, из-за небольшого числа пациенток в данной группе. У пациенток с ХБП III стадии при последней беременности использование бемипарина и дипиридамола достоверно повышало долю благоприятных исходов беременности: 44% в группе сравнения и 89,5% в основной группе (p = 0,005), несмотря на то что женщины имели явную хроническую почечную недостаточность.
Значения параметров теста тромбодинамики (начальная и стационарная скорость роста сгустка, а также размер сгустка на 30-й минуте исследования в точке до терапии) демонстрировали выраженную гиперкоагуляцию (табл. 6). При этом у части пациенток присутствовали очаги спонтанного тромбообразования. Совокупность гиперкоагуляции и очагов патологического спонтанного тромбообразования свидетельствовала о риске развития тромботических осложнений и являлась показанием к назначению бемипарина. На пиковой концентрации препарата в профилактической дозе регистрировалось статистически значимое снижение стационарной скорости роста сгустка (с 51,0 до 28,1 мкм/мин, p < 0,001). При этом стационарная скорость роста сгустка укладывалась в нормальный референсный диапазон. Таким образом, значения стационарной скорости роста сгустков статистически различались, что позволяет использовать этот параметр для мониторинга антикоагулянтной терапии НМГ.
Обсуждение
В сравнительном ретроспективно-проспективном исследовании влияния антикоагулянтов и антиагрегантов на исход беременности при ХБП с участием 66 пациенток с ХБП, имевших 185 желанных беременностей, было получено достоверное улучшение исходов для плода на фоне профилактики дипиридамолом и бемипарином осложнений, связанных с функцией плаценты. Если в исследуемой группе было 97,1% успешных беременностей, то в группе сравнения, не получавшей антиагреганты и антикоагулянты, – только 49,6%. При этом стаж ХБП в группе сравнения был меньше, и у некоторых женщин к моменту последней беременности (а именно последние беременности вошли в исследуемую группу) произошло снижение функции почек, то есть беременности основной группы протекали в заведомо менее благоприятных условиях.
Статистически значимое улучшение исхода беременности наблюдалось у пациенток вне зависимости от стадии ХБП (в исследование включены беременные с ХБП I–III стадии). Несмотря на более высокую по сравнению с таковой в общей популяции частоту преэклампсии и более раннее родоразрешение (особенно при ХБП III стадии), у большинства пациенток, получавших во время беременности бемипарин и дипиридамол, родились живые дети, выжившие в постнатальном периоде. Беременность у этих женщин не привела к существенному снижению функции почек, по крайней мере, в течение одного года наблюдения после родов.
Безусловно, данное исследование имеет ряд недостатков: небольшое число включенных больных, не рандомизированное, не полностью проспективное (беременности группы сравнения анализировались ретроспективно). Можно также предположить, что на улучшение исходов беременности на фоне профилактики осложнений бемипарином и дипиридамолом оказал влияние «эффект центра». Последний подразумевает более тщательное наблюдение и возможность более полного обследования пациенток в научно-исследовательском институте, лучшую техническую оснащенность параклинических подразделений, раннее распознавание осложнений и их лечение, своевременное принятие решений о необходимости досрочного родоразрешения, наличие современной неонатологической службы и т.д. Тем не менее наиболее существенным отличием протокола ведения беременных с ХБП, применявшегося в МОНИИАГ, стало использование бемипарина и дипиридамола с ранних сроков беременности, под лабораторным контролем гемостаза, что, как мы считаем, и позволило добиться высокой частоты благоприятных исходов беременности у женщин с неблагоприятным соматическим статусом и отягощенным акушерским анамнезом.
Выводы
У женщин с ХБП I–III стадии применение бемипарина и дипиридамола способствует повышению частоты благоприятного исхода беременности – рождению живых детей и выживанию их в постнатальном периоде без ускорения прогрессирования ХБП у матерей.
Тест тромбодинамики регистрирует гиперкоагуляцию, обусловленную патологическим состоянием системы гемостаза у пациенток с ХБП, и может использоваться для контроля антикоагулянтной терапии низкомолекулярными гепаринами, которые наиболее удобны для длительного применения во время беременности и обладают оптимальным фармакокинетическим профилем, обеспечивающим пациенткам с ХБП стабильный клинический эффект.
Для уточнения механизмов благоприятного влияния антикоагулянтов и антиагрегантов на исход беременности при ХБП и разработки оптимальных режимов применения данных препаратов у беременных с заболеваниями почек требуются дальнейшие исследования.
T.S. Budykina, M.I. Sidorkina, Ye.I. Prokopenko, I.G. Nikolskaya
Moscow Regional Research Institute of Obstetrics and Gynecology
Moscow Regional Research and Clinical Institute named after M.F. Vladimirsky
Contact person: Tatyana Sergeyevna Budykina, renalnephron@gmail.com
Objective: to assess the effectiveness of bemiparin and dipyridamole by blood coagulation dynamics for prevention of complications and improvement of pregnancy outcomes in women with chronic kidney disease (CKD) 1–3 stages.
Subjects and methods. The study included 66 women with CKD and a history of a wanted pregnancy, during which has not been treated with anticoagulant and antiplatelet agents. At last pregnancy all were treated by bemiparin and dipyridamole for the prevention of preeclampsia and placental insufficiency. Study group consisted of 68 pregnancies with bemiparin and dipyridamole, and the control group – 117 anamnestic pregnancies without receiving anticoagulants and antiplatelet agents in the same women.
Results. In the study group the frequency of favorable outcomes of pregnancies was significantly higher compared with the control group – 97.1% versus 49.6%, p < 0,001. None of the patients did need to start a permanent renal replacement therapy during 12 months after delivery. Improving pregnancy outcomes observed in all stages of CKD.
Conclusion. In women with CKD 1–3 stages bemiparin and dipyridamole by blood coagulation dynamics helped to improve pregnancy outcomes – live birth and survival in the postnatal period without significant deterioration in renal function in mothers during the year after delivery.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.