Эффективность терапии ингибитором интерлейкина-23 гуселькумабом и показатели качества жизни больных псориазом
- Аннотация
- Статья
- Ссылки
- English
Цель исследования – оценить эффективность терапии ингибитором ИЛ-23 гуселькумабом и его влияние на показатели качества жизни у пациентов со среднетяжелым и тяжелым псориазом в реальной клинической практике.
Материал и методы. Проведено ретроспективное исследование 30 пациентов с диагнозом «распространенный вульгарный псориаз». Исходные показатели оценивали по индексам PASI (Psoriasis Area and Severity Index), BSA (Body Surfase Area), sPGA (Static Physician Global Assessment). Показатели качества жизни оценивали по шкалам DLQI (Dermatology Life Quality Index) и SF-36 (Social Functioning). Все пациенты получали лечение ингибитором ИЛ-23 гуселькумабом по стандартной схеме. Оценку эффективности терапии осуществляли по динамике показателей PASI, BSA, sPGA, DLQI и SF-36 через 12 недель терапии.
Результаты. Биологическая терапия гуселькумабом привела к статистически значимому улучшению всех показателей через 12 недель для каждого пациента (р < 0,001). Продемонстрирована высокая статистическая значимость разницы между исходным уровнем и после терапии гуселькумабом по индексам PASI, BSA, PGA (p < 0,001). Все пациенты с «суперответом» достигли полного очищения кожи PASI 100 к 12-й неделе терапии. Изменение показателей индекса PASI привело к статистически значимому улучшению показателей качества жизни по шкале дерматологического индекса качества жизни (p < 0,001). По шкале SF-36 получен статистически значимый результат (p < 0,001) как по шкале физического компонента здоровья (Physical Health – PH), так и по шкале психологического компонента здоровья (Mental Health – MH) после лечения гуселькумабом.
Заключение. Биологическая терапия ингибитором ИЛ-23 гуселькумабом высокоэффективна для снижения тяжести заболевания и достижения высоких показателей качества жизни больных псориазом.
Цель исследования – оценить эффективность терапии ингибитором ИЛ-23 гуселькумабом и его влияние на показатели качества жизни у пациентов со среднетяжелым и тяжелым псориазом в реальной клинической практике.
Материал и методы. Проведено ретроспективное исследование 30 пациентов с диагнозом «распространенный вульгарный псориаз». Исходные показатели оценивали по индексам PASI (Psoriasis Area and Severity Index), BSA (Body Surfase Area), sPGA (Static Physician Global Assessment). Показатели качества жизни оценивали по шкалам DLQI (Dermatology Life Quality Index) и SF-36 (Social Functioning). Все пациенты получали лечение ингибитором ИЛ-23 гуселькумабом по стандартной схеме. Оценку эффективности терапии осуществляли по динамике показателей PASI, BSA, sPGA, DLQI и SF-36 через 12 недель терапии.
Результаты. Биологическая терапия гуселькумабом привела к статистически значимому улучшению всех показателей через 12 недель для каждого пациента (р < 0,001). Продемонстрирована высокая статистическая значимость разницы между исходным уровнем и после терапии гуселькумабом по индексам PASI, BSA, PGA (p < 0,001). Все пациенты с «суперответом» достигли полного очищения кожи PASI 100 к 12-й неделе терапии. Изменение показателей индекса PASI привело к статистически значимому улучшению показателей качества жизни по шкале дерматологического индекса качества жизни (p < 0,001). По шкале SF-36 получен статистически значимый результат (p < 0,001) как по шкале физического компонента здоровья (Physical Health – PH), так и по шкале психологического компонента здоровья (Mental Health – MH) после лечения гуселькумабом.
Заключение. Биологическая терапия ингибитором ИЛ-23 гуселькумабом высокоэффективна для снижения тяжести заболевания и достижения высоких показателей качества жизни больных псориазом.



Псориазом страдает приблизительно 2% населения мира. Известно, что псориаз оказывает значительное негативное воздействие на качество жизни (КЖ), сравнимое с другими серьезными заболеваниями, такими как ишемическая болезнь сердца (ИБС), сахарный диабет, онкология и депрессия [1, 2]. Пациенты с псориазом испытывают социальную стигматизацию, потерю уверенности в себе, выраженную боль, дискомфорт, физические ограничения и психологический стресс [3, 4]. Часто пациенты сообщают о чувстве тревоги, гнева и депрессии от умеренного до крайне выраженного, а также о более высокой частоте суицидальных мыслей [5]. КЖ включает в себя все факторы, оказывающие влияние на жизнь человека, и представляет собой степень, в которой надежды человека совпадают с опытом, тогда как КЖ, обусловленное состоянием здоровья (Health Related Quality of Life, HRQoL), касается только аспектов здоровья, включая психологическое, социальное и физическое благополучие. На сегодняшний день известно, что псориаз – это заболевание, разочаровывающее как пациента, так и врача вследствие влияния на КЖ и связанных с заболеванием ограничений повседневной деятельности, профессионального и сексуального, психосоциального функционирования, а также снижения физической активности [6–9].
Низкое КЖ пациентов с псориазом можно объяснить различными факторами, особенно хроническим и рецидивирующим течением заболевания, отсутствием контроля и страхом неожиданного обострения, а также чувством безнадежности в плане излечения [10].
Еще в 1993 г. M.A. Gupta и соавт. в результате исследования 127 пациентов с псориазом выяснили, что 9,7% пациентов сообщили о своем желании умереть, а 5,5% – об активных суицидальных мыслях на момент исследования [11, 12].
Для определения КЖ человека доступно несколько методов, включая универсальные опросники, такие как опросник SF-36 (Socia lFunctioning) [13], а также инструменты, специфичные для заболевания, а именно дерматологический индекс качества жизни (Dermatology Life Quality Index, DLQI) [14].Однако опросники КЖ (Quality of Life, QoL) имеют один существенный недостаток: хотя и отражают точку зрения пациента в целом, они не учитывают личные терапевтические цели с помощью взвешивания индивидуальных предпочтений пациентов [15]. A.B. Kimball и соавт. недавно выдвинули гипотезу, что кумулятивный эффект биопсихосоциальных последствий псориаза может привести к невозможности достижения «полноценного жизненного потенциала» у некоторых пациентов – концепция, получившая название «кумулятивное нарушение жизненного цикла» (CLCI) [16, 17]. Ухудшение КЖ влияет на отношения, социальную деятельность, работу и эмоциональное благополучие. Социально-экономические последствия и утрата возможностей, вызванные псориазом в течение нескольких лет, часто носят необратимый характер.
Так как псориаз оказывает огромное социально-экономическое влияние на жизнь пациентов, важно подготовить практический и реалистичный план лечения, где главной целью является максимальное сохранение КЖ путем достижения контроля над заболеванием.
Поскольку хронический характер псориаза часто требует пожизненной терапии, существует высокая потребность в эффективных и безопасных методах долгосрочного контроля заболевания с улучшением КЖ больных.
Одним из перспективных системных биологических препаратов для лечения среднетяжелого и тяжелого псориаза является ингибитор интерлейкина (ИЛ) 23 гуселькумаб.
Цель исследования – оценить эффективность терапии ингибитором ИЛ-23 гуселькумабом и его влияние на показатели КЖ пациентов со среднетяжелым и тяжелым псориазом в реальной клинической практике.
Материал и методы
Проведено одноцентровое экспериментальное неконтролируемое исследование пациентов с распространенным бляшечным псориазом.
Критерии включения:
- возраст старше 18 лет;
- тяжелая степень тяжести псориаза c PASI (Psoriasis Areaand Severity Index) > 15 баллов;
- поражение псориазом более 10% поверхности тела (Body Surfase Area, BSA);
- оценка изменений кожи врачом (Static Physician Global Assessment,sPGA) более 3 баллов;
- все пациенты были бионаивными и не получали лечения препаратами генно-инженерной биологической терапии (ГИБТ) до начала терапии;
- прошли тестирование по шкалам PASI, BSA, sPGA, DLQI и SF-36 до начала и через 12 недель после лечения;
- подписали добровольное согласие на участие в исследовании, информированное согласие с общим планом обследования и лечения.
Критерии невключения:
- противопоказания к назначению гуселькумаба;
- наличие сопутствующих соматических, а также инфекционных заболеваний в стадии декомпенсации, онкологические заболевания, наркомания, алкоголизм, гипертиреоз;
- нарушения со стороны системы кроветворения в анамнезе (клинически значимая анемия, тромбоцитопения, лейкопения, гипоплазия костного мозга);
- беременность, период лактации.
Критерии исключения:
- добровольное желание пациента завершить участие в исследовании;
- несоблюдение пациентом режима, а также назначенной схемы диагностики и терапии.
Для установления диагноза осуществлялось клинико-анамнестическое обследование (сбор жалоб, анамнеза жизни и заболевания, антропометрические данные, сопутствующие заболевания, время с момента постановки диагноза, предшествующая терапия, оценка клинических проявлений и определение их степени тяжести) c учетом индексов PASI, BSA, sPGA.
Индекс площади и тяжести псориаза PASI использовали для измерения площади пораженной области и оценки тяжести распространенного псориаза. Если показатель PASI менее 10, поражение кожи считается легким, от 10 до 20 – умеренным, а при балле, равном или превышающем 20, – тяжелым.
Индекс BSA определяли путем измерения ладони пациента до средних фаланг пальцев, при этом каждая единица равна 1% площади тела. Значение BSA менее трех указывает на легкую степень тяжести псориаза, от трех до 10 – на среднюю степень тяжести, более 10 – на тяжелую степень тяжести.
Статическая глобальная оценка врача sPGA – это фиксированная шкала, используемая врачами для оценки тяжести псориаза. Этот показатель предполагает оценку трех факторов (инфильтрация, шелушение, эритема). Оценка «ноль» указывает на отсутствие признаков псориаза, а оценка «пять» – на крайне тяжелое проявление заболевания.
Оценку степени тяжести псориаза проводили на нулевой и 12-й неделях лечения.
Для измерения показателей КЖ у больных псориазом были использованы две диагностические шкалы: дерматологический индекс качества жизни – ДИКЖ (DLQI) и универсальный опросник SF-36.
ДИКЖ (DLQI) – это опросник из десяти вопросов, используемый для измерения влияния кожных заболеваний на КЖ, который применяется специалистами с 1993 г. [14] и переведен на 115 языков, в том числе на русский (в 2001 г.). Баллы ДИКЖ (DLQI) варьируются от 0 (отсутствие влияния кожных заболеваний на КЖ) до 30 (максимальное влияние).
SF-36 представляет собой опросник для оценки физического (PCS) и психического компонента (MCS) [18]. Опросник SF-36 является одним из самых изученных и применяется с 1992 г. [25], переведен более чем на 100 языков, в том числе на русский (в 2000 г.). Библиография применения опросника насчитывает более 1000 публикаций в различных странах мира, с участием самых разных когорт пациентов [26].
Опросник SF-36 содержит 36 вопросов, которые сгруппированы в восемь шкал: 1) физическое функционирование (Physical Functioning – PF); 2) ролевое функционирование, обусловленное физическим состоянием (Role-Physical Functioning – RP); 3) интенсивность боли (Bodilypain – BP); 4) общее состояние здоровья (General Health – GH); 5) жизненная активность (Vitality – VT); 6) социальное функционирование (Social Functioning – SF); 7) ролевое функционирование, обусловленное эмоциональным состоянием (Role-Emotional Functioning – RE); 8) психическое здоровье (Mental Health – MH). Показатели каждой шкалы варьируют от 0 до 100 баллов, чем выше значение показателя, тем лучше оценка по выбранной шкале.
Все шкалы опросника объединены в два показателя – физический (1–4 шкалы) и психологический (5–8 шкалы) компоненты здоровья. Клинически значимые улучшения определяются как улучшение по шкале SF-36 на ≥ 5 баллов [19–21].
Существует укороченная версия этого опросника с 12 вопросами, предполагающая ускорение процесса заполнения опросника пациентом [27]. Но на сегодняшний день наиболее часто используется усовершенствованная, вторая версия опросника SF-36, в которой были учтены замечания, высказанные исследователями в процессе пользования предыдущим вариантом опросника. Таким образом, опросник позволяет интегрально оценить влияние различных симптомов у пациентов на качество как физической, так и эмоционально-психологической активности.
Оценку КЖ больных псориазом проводили до назначаемой терапии и на 12-й неделе лечения.
Пациенты получали терапию ингибитором ИЛ-23 гуселькумабом. Разовая доза – 100 мг/мл, инъекции проводили на нулевой, четвертой, 12-й неделях, длительность наблюдения – 12 недель.
Оценку эффективности терапии осуществляли по динамике показателей PASI, BSA, sPGA, ДИКЖ и SF-36. Также были сделаны цифровые фотографии больных до начала и после окончания терапии.
Размер выборки предварительно не рассчитывали.
Сбор данных, их последующая коррекция, систематизация исходной информации и визуализация полученных результатов осуществлялись в электронных таблицах Excel (Microsoft Office 365 (Microsoft, США)). Статистическую обработку результатов проводили при помощи языка Питон (Python 3.11). Количественные показатели оценивали на предмет соответствия нормальному распределению, для этого использовали критерий Шапиро – Уилка. Проверка на нормальность распределения показала, что данные в исследовании не имеют нормального распределения. Поэтому в дальнейшем расчеты производили с помощью методов непараметрической статистики. В качестве центра распределения была посчитана медиана, а в качестве показателей вариации – квартили (Me [Q1; Q3]). Для проверки различий между двумя сравниваемыми парными выборками применяли W-критерий Уилкоксона. Результаты качественных признаков выражены в абсолютных числах с указанием долей (%).
С целью изучения взаимосвязи между явлениями, представленными количественными данными, использовали непараметрический метод – расчет коэффициента ранговой корреляции Спирмена (r). Интерпретацию полученных значений корреляции производили по шкале Чеддока, предполагающей качественную и количественную оценку от 0,1 до 0,99: слабая вероятность наступления рисков – 0,1–0,3 балла, умеренная вероятность наступления рисков – 0,3–0,5 балла, заметная вероятность наступления рисков – 0,5–0,7 балла, высокая вероятность наступления рисков – 0,7–0,9 балла, весьма высокая вероятность наступления рисков – 0,9–0,99 балла. Коэффициент корреляции дополнен 95%-ным доверительным интервалом, который рассчитывали методом бутстреп (bootstrap) при выборке 1000 экземпляров. Различия считали статистически значимыми при р < 0,05.
Результаты
В исследовании приняли участие 30 пациентов, из них было 19 (63,0%) мужчин и 11 (37,0%) женщин, в трудоспособном возрасте от 20 до 60 лет, в среднем – 45,5 [35,5; 52,75] лет, возраст дебюта псориаза – от двух до 44 лет, в среднем 29,0 [18,25; 30,75] лет, то есть манифестация псориаза преобладала в молодом возрасте, длительность заболевания варьировала от 1 года до 44 лет, в среднем – 17,5 [7,5; 21,75] лет. Основные клинико-анамнестические характеристики пациентов представлены в табл. 1.
Ожирение было диагностировано у 22 (73,0%) пациентов, индекс массы тела у пациентов с ожирением был в диапазоне от 30,3 до 35,7. Самый низкий балл до лечения гуселькумабом по индексу PASI составил 18, самый высокий достигал 55 баллов, что свидетельствует о тяжести клинических проявлений псориаза. Баллы DLQI варьировались от 7 до 30, оценка интенсивности зуда пациентом по визуальной аналоговой шкале (ВАШ) составила от 2,5 до 10,0 (максимальное значение). Псориатический артрит диагностирован у 18 (60,0%), сердечно-сосудистые заболевания: гипертоническая болезнь – у 12 (40,0%), ИБС – у 4 (13,0%), сахарный диабет – у 3 (10,0%) пациентов (табл. 2).
Пациенты были резистентны к стандартной противовоспалительной терапии. Из анамнеза установлено, что больные были бионаивными и не получали лечение препаратами ГИБТ.
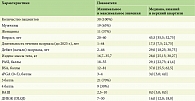
В процессе анализа было выявлено статистически значимое (p < 0,001) изменение тяжести псориаза до лечения и через 12 недель после терапии ингибитором ИЛ-23 гуселькумабом по индексу PASI с 29,1 [22,73; 41,4] до 0,0 [0,0; 0,0], по индексу BSA с 37,0 [25,5; 62,5] до 0,0 [0,0; 0,0], по PGA с 3,0 [3,0; 4,0] до 0,0 [0,0; 0,0] и по ДИКЖ с 16,0 [12,0; 18,0] по 3,5 [1,25; 9,0] (табл. 3, рис. 1).
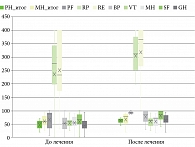
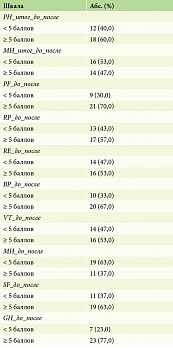
Анализ, проведенный по шкале SF-36, показал, что у пациентов с псориазом до и после лечения гуселькумабом отмечались статистически значимые (p < 0,05) изменения по физическому компоненту здоровья (Physical Health – PH_итог) с 54,32 [34,56; 61,74] до 64,14 [56,54; 68,73] и по психологическому компоненту здоровья (MH_итог) с 61,76 [48,33; 79,04] до 78,6 [52,08; 86,12]. По обеим шкалам рост в среднем составил более 5 баллов, что говорит о клинически значимом изменении физического и психологического состояния КЖ пациентов (табл. 4, рис. 2). Однако более детальный анализ показал, что изменение по физическому компоненту здоровья более 5 баллов произошло у 18 (60%) пациентов, а по психическому компоненту – у 14 (47%) пациентов (табл. 5).
Также следует отметить, что статистически значимые изменения до и после терапии у пациентов произошло по подшкалам SF-36 шкалы «физическое функционирование» (p < 0,001), «общее состояние здоровья» (p < 0,001), «социальное функционирование» (p < 0,001), «ролевое функционирование, обусловленное эмоциональным состоянием» (p = 0,003), «ролевое функционирование, обусловленное физическим состоянием» (p = 0,011). Изменения по подшкалам «жизненная активность» (p = 0,058) и «психическое здоровье» (p = 0,072) произошли, но они статистически незначимые.
Выявлено статистически значимое снижение баллов по индексу PASI на фоне терапии гуселькумабом. Все пациенты с «суперответом» достигли полного очищения кожи PASI 100 к 12-й неделе терапии. Изменение показателей индекса PASI привело к статистически значимому улучшению показателей КЖ по шкале ДИКЖ (p < 0,001). По шкале SF-36 получен статистически значимый результат как по шкале физического компонента здоровья (PH) (p < 0,001), так и по шкале психологического компонента здоровья (MH) (p < 0,001) до и после лечения гуселькумабом. Статистически значимые различия до и после лечения гуселькумабом получены в значениях шкалы физического компонента здоровья по составляющим шкалам: «физическое функционирование» (p < 0,001), «интенсивность боли» (p < 0,001), «общее состояние здоровья» (p < 0,001) и психологического компонента по составляющей шкале «социальное функционирование» (p < 0,001).
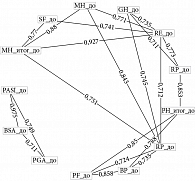
Выявлено, что оценки по шкалам PАSI, BSA и PGA статистически значимо высоко коррелируют между собой (p < 0,001) (рис. 3). Высоко коррелируют между собой и отдельные компоненты шкалы SF-36. Однако из графика видно, что в исследовании не выявлено статистически значимой корреляции между шкалами, определяющими оценку тяжести псориаза и оценку КЖ пациента до лечения гуселькумабом.
Обсуждение
Проблема изучения КЖ пациентов с псориазом волнует исследователей достаточно давно, однако комбинировать классическую клиническую оценку с оценкой КЖ стали недавно. Помимо первичных клинико-лабораторных измерений это позволяет отслеживать течение заболевания, получать комплексное представление о состоянии пациента и оперативно вносить необходимые коррективы в лечение [22, 23].
Особенностями исследования КЖ являются активное вовлечение самого пациента в оценку, изменяемость оценки с течением времени и ее многомерность (учет множества аспектов КЖ). При этом в настоящее время существует несколько инструментов для оценки КЖ. Одни из них являются универсальными опросниками, например, опросник SF-36 для больных с различными хроническими заболеваниями [24], а другие – специфичными для псориаза, а именно дерматологический индекс качества жизни (DLQI).
Проспективное многоцентровое исследование по изучению сравнения Skindex-29, DLQI, PDI и SF-36 показало, что SF-36 оказался более чувствительным, чем другие инструменты, при выявлении ухудшения КЖ у пациентов мужского пола, тогда как Skindex-29 имел слабую, хотя и статистически значимую корреляцию с тяжестью клинической картины [28, 29]. Опросник ДИКЖ (DLQI) является психометрически обоснованным и чувствительным показателем исходов, специфичных для псориаза. Он наиболее полно отражает влияние клинических признаков и симптомов на благополучие пациента [30].
По шкале SF-36 получен статистически значимый результат как по шкале физического компонента здоровья (PH) (p < 0,001), так и по шкале психологического компонента здоровья (MH) (p < 0,001) до и после лечения гуселькумабом. Статистически значимые различия до и после лечения гуселькумабом получены в значениях шкалы физического компонента здоровья по составляющим шкалам: «физическое функционирование» (p < 0,001), «интенсивность боли» (p < 0,001), «общее состояние здоровья» (p < 0,001)и психологического компонента по составляющей шкале «социальное функционирование» (p < 0,001).
Понятие «социальное функционирование» подразумевает способность человека нормально или привычно взаимодействовать в обществе и может использоваться как мера качества медицинской помощи [31]. Это понятие объединяет такие функции, как социальные контакты и деятельность, партнерство, сексуальное поведение, социальная деятельность, спорт, работа и карьера. В публикации R. Gaikwad и соавт. [32] показано, что псориаз влияет на социальное функционирование 48% пациентов, приводит к снижению работоспособности у 51,1% и к субъективному дистрессу на работе у 62,8%.
В многочисленных публикациях показано, что такие факторы, как социальная стигматизация, высокий уровень стресса, физические ограничения, депрессия, проблемы с трудоустройством и другие психосоциальные состояния, включая социальную тревогу и негативное преодоление трудностей, с которыми сталкиваются пациенты с псориазом, часто непредсказуемы и не всегда пропорциональны клиническим проявлениям псориаза [33–35]. Более того, удовлетворенность лечением и формулирование целей лечения, по-видимому, являются предикторами КЖ. Соответственно, эти компоненты могут быть потенциальными целями для раннего назначения высокоэффективных препаратов во избежание долгосрочных потерь КЖ.
Таргетное лечение, раннее вмешательство с формулированием целей лечения – это новый подход в медицине, который был реализован в последние годы в нескольких дисциплинах, в том числе и в дерматологии [36]. Известно, что пациентам с хроническим заболеванием, таким как псориаз, требуется длительное лечение, и на данный момент существует несколько классов биологических препаратов, которые обеспечивают различные уровни очищения кожи [37, 38]. В последние годы ингибиторы ИЛ-17 и ИЛ-23 продемонстрировали более высокую эффективность по сравнению с ингибиторами фактора некроза опухоли, которые когда-то считались стандартом лечения [39]. Кроме того, с увеличением числа вариантов биологического лечения, доступных для лечения псориаза, более важным для пациентов становится выбрать терапию, которая может обеспечить долгосрочную эффективность и благоприятную безопасность на протяжении всего периода их заболевания [40, 41]. Несколько исследований показали, что полное очищение кожи является целью многих пациентов с псориазом средней и тяжелой степени [42] и связано с улучшением КЖ человека [43, 44].
В представленном нами исследовании, а также в предыдущем нашем исследовании [45] мы получили высокую статистическую значимость разницы между исходным уровнем – до терапии и последующим уровнем – после терапии гуселькумабом по индексам PASI, BSA, PGA (p < 0,001). Все пациенты с «суперответом» достигли полного очищения кожи PASI 100 к 12-й неделе терапии. Изменение показателей индекса PASI привело к статистически значимому улучшению показателей КЖ по шкале ДИКЖ (p < 0,001) и по шкале SF-36 (p < 0,001) физического компонента здоровья (PH) (p < 0,001) и психологического компонента здоровья (MH) (p < 0,001). Полученные результаты доказывают высокую терапевтическую активность ингибитора ИЛ-23 гуселькумаба в достижении «суперответа» и высоких показателей улучшения КЖ у пациентов со среднетяжелым и тяжелым течением псориаза.
Таким образом, применение ингибитора ИЛ-23 гуселькумаба в реальной клинической практике приводит к полному/почти полному очищению кожи и существенному улучшению показателей КЖ по шкалам физического и психологического благополучия общего опросника SF-36 и опросника ДИКЖ. Устойчивое достижение полного очищения кожи потенциально может улучшить серьезные нарушения КЖ при псориазе и открыть пациентам более широкий горизонт жизненного опыта.
Заключение
Достижение высоких показателей КЖ у пациентов с тяжелым течением псориаза играет ведущую роль. Ингибитор ИЛ-23 гуселькумаб позволяет успешно достигать основных целей лечения – контроля заболевания и сохранения КЖ пациентов.
В проведенном нами исследовании на фоне терапии гуселькумабом у пациентов с достижением чистой кожи отмечены лучшие показатели КЖ.
Раннее и более эффективное лечение псориаза может иметь долгосрочные преимущества на протяжении всей жизни пациентов.
Авторы заявляют об отсутствии конфликта интересов.
I.S. Vladimirova, PhD, L.S. Kruglova, PhD, Prof.
Dermatovenerologic Dispensary No. 10 – Clinic of Dermatology and Venereology, St. Petersburg
St. Petersburg State University
Military Medical Academy named after S.M. Kirov, St. Petersburg
Central State Medical Academy of Department of Presidential Affairs, Moscow
Contact person: Irina S. Vladimirova, ivladimirva@rambler.ru
Psoriasis is a chronic immune-mediated systemic disease that significantly affects the lives of patients. It is associated with social stigma, loss of self-confidence, pain, discomfort, physical disability and psychological stress. Controlling the disease and improving the quality of life of patients is the main goal of treating psoriasis. It is important to prepare a highly effective and realistic treatment plan. One of the promising drugs that significantly improves the quality of life of patients with moderate and severe psoriasis is the interleukin (IL) 23 inhibitor guselkumab.
Purpose of the study. To evaluate the effectiveness of therapy with the IL-23 inhibitor (guselkumab) and its impact on quality-of-life indicators in patients with moderate and severe psoriasis in real clinical practice.
Material and methods. A retrospective study of 30 patients diagnosed with widespread vulgar psoriasis was conducted. Initial indicators were assessed using the PASI, BSA, sPGA. Quality of life indicators were assessed using the DLQI and SF-36 scales. All patients received treatment with guselkumab according to the standard regimen. The effectiveness of therapy was assessed by the dynamics of PASI, BSA, sPGA, DLQI and SF-36 indicators after 12 weeks of therapy with the IL-23 inhibitor (guselkumab).
Results. Biologic therapy with the IL-23 inhibitor guselkumab resulted in significant improvements in all measures at 12 weeks for each patient (p < 0.001). A high statistical significance of the difference between the baseline and after guselkumab therapy was demonstrated in terms of the PASI, BSA, and PGA indices (p < 0.001). All patients with a “super response” achieved complete PASI 100 skin clearing by the 12th week of therapy. Changes in PASI index scores led to a statistically significant improvement in quality-of-life scores on the DQL scale (p < 0.001). On the SF-36 scale, a statistically significant result was obtained both on the scale of the physical component of health (PH) (p < 0.001) and on the scale of the psychological component of health (Mental Health – MH) (p < 0.001) before and after treatment with guselkumab.
Conclusion. Biological therapy with the IL-23 inhibitor guselkumab is highly effective in reducing the severity of the disease and achieving high quality of life in patients with psoriasis.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.