Эффекты моксонидина у больных с метаболическим синдромом
- Аннотация
- Статья
- Ссылки



Согласно критериям, которые были разработаны комитетом экспертов Национальной образовательной программы по холестерину (ATPIII, 2001 г.), диагноз МС устанавливается, если у пациента обнаруживается 3 и более из следующих признаков (9):
- абдоминальное ожирение (ОТ > 102 см у мужчин, ОТ>88 см у женщин);
- уровень триглицеридов ≥ 1,7 ммоль/л (≥150 мг/дл);
- ХС ЛПВП < 1 ммоль/л (<40 мг/дл) у мужчин, <1,3 ммоль/л (< 50 мг/дл) у женщин;
- артериальная гипертензия (АД ≥ 130/85 мм рт. ст);
- показатели глюкозы натощак ≥ 6,1 ммоль/л (≥110 мг/дл).
Новая редакция определения МС была представлена в 2005 году на І Международном конгрессе по предиабету и метаболическому синдрому, а также на 75-м Конгрессе Европейского общества по атеросклерозу. Принципиально новой позицией является утверждение абдоминального ожирения, как основного маркера для диагностики МС. Изменены следующие параметры: объема талии (< 94 см – для мужчин, < 80 см – для женщин), ХС ЛПВП (< 0,9 ммоль/л – для мужчин, < 1,1 ммоль/л – для женщин) и гипергликемии натощак (≥5,6 ммоль/л) или диагностированный ранее сахарный диабет типа 2.
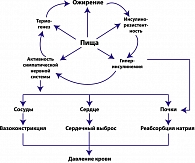
Артериальная гипертензия АГ является ранним и довольно частым клиническим проявлением МС (18). Повышение артериального давления (АД) на каждые 6 мм рт.ст. увеличивает риск развития инсульта на 40%, инфаркта – на 20%. Взаимосвязь гиперинсулинемии (ГИ) и АГ настолько прочна, что при выявлении у больного высокой концентрации инсулина в плазме крови можно прогнозировать у него в скором времени повышение АД. Изучение механизмом развития АГ при МС свидетельствует, что гиперактивация СНС в условиях ИР и ГИ приводит к появлению АГ за счет симпатической стимуляция сосудов, сердца и почек (4, 18) (рисунок 1). Существует клинически подтвержденная обратная зависимость между чувствительностью к инсулину и АД, которая усиливается при ожирении, особенно висцеро-абдоминальной формы (18).
Длительная гиперактивность СНС повышает артериальное давление, вызывая сужение периферических сосудов и повышая реабсорбцию натрия в почках (18). Системное повышение активности СНС сопровождается повышением локальной симпатической активности почек, ключевого органа кардиоваскулярного гомеостаза. Наряду с ГИ и ИР, в качестве причин гиперактивации СНС при МС рассматриваются молекулярно-генетические факторы, гиперлептинемия и высокая концентрация свободных жирных кислот (СЖК). Среди факторов окружающей среды большое значение придается хроническому стрессу, гиподинамии и вредным привычкам.
Активация СНС вызывает выброс ренина юкстагломерулярными клетками почек и, соответственно, повышение образования ангиотензина II, усиливающего симпатическую иннервацию почек и способствующего поддержание повышенного АД. Другой причиной повышения активности ренин-ангиотензин-альдостероновой системы (РААС) у больных МС считается повышенная выработка жировыми клетками ангиотензиногена, экспрессия которого избыточна именно у висцеральных адипоцитов, что также инициирует повышенную секрецию ангиотензина II (4, 19). Ангиотензин II активизирует ростовые факторы, инициируют гипертрофию гладкомышечных клеток сосудов, экспрессию гена коллагена. Кроме того, непосредственно и гиперактивность СНС стимулирует пролиферацию гладкомышечных клеток сосудов, тем самым, способствуя развитию атеросклеротического процесса. Вазоконстрикторный эффект ангиотензина II способствует реабсорбции натрия и нарушает натрийурез. Нельзя не отметить, что дифференцировка человеческих мезенхимальных стволовых клеток в адипоциты ассоциируется с усилением эндогенной локальной продукции ангиотензина II. Стимуляция РААС приводит к образовании избыточных количеств альдостерона (18). Альдостерон повышает артериальное давление посредством взаимодействия с минералокортикоидными рецепторами, локализованными в различных тканях, в том числе почках, сосудистой сети, мозге.
Гиперактивность СНС оказывает негативное влияние на скелетные мышцы и их кровоснабжение. Изменения, происходящие в скелетных мышцах, включают повышение доли «быстрых волокон», содержащих на 30% меньше капилляров, чем «медленные» мышечные волокна и уменьшение количества функционирующих артериол (14). Эти расстройства приводят к нарушению утилизации глюкозы мышечной тканью и способствуют ИР.
Таким образом, гиперактивация СНС играет важную роль в патогенезе артериальной гипертензии при МС, последствия которой непосредственно ухудшают периферическую чувствительность к инсулину.
Важная роль в современной фармакотерапии МС принадлежит антигипертензивной терапии, целью которой является достижение и длительное поддержание целевых показателей АД, положительное влияние на состояние органов-мишеней, а главное, снижение риска развития сердечно-сосудистых осложнений и улучшение качества жизни пациентов (4, 19). Несмотря на то, что в наши дни возможности современной фармакотерапии АГ достаточно широки, по-прежнему остается актуальной проблема выбора эффективного антигипертензивного препарата у больных МС и в клинической практике часто приходится решать вопрос, какой из препаратов назначать первым (24).
Лечение артериальной гипертензии у больных с МС имеет ряд особенностей. Проводя коррекцию АГ у больных МС необходимо достигать целевых показателей артериального давления. Фармакотерапия АГ у больных МС связана с длительным применением антигипертензивных препаратов и частыми причинами недостаточного контроля АД являются, в первую очередь, противопоказания и нежелательные эффекты, присущие тем или иным препаратам. Помимо высокой антигипертензивной эффективности, препарат, обладая органопротективными эффектами, не должен оказывать отрицательного влияния на метаболические процессы. Проводимое лечение должно быть направлено не только на нормализацию АД, но и способствовать устранению ИР и ГИ. Некоторые широко используемые антигипертензивные препараты могут ухудшать периферическую чувствительность к инсулину. Другой проблемой клинической практики, является несоблюдение больным рекомендаций по режимам лечения. К сожалению, только небольшая часть пациентов регулярно принимают рекомендованные им антигипертензивные средства. Причиной тому является неудобство схемы приема некоторых препаратов. В целом эффективность антигипертензивной терапии у больных с МС, как правило, снижена. Это может быть обусловлено следующими механизмами: высокий исходный уровень артериального давления, более низкая эффективность препаратов некоторых групп и недостаточные дозы антигипертензивнных препаратов.
В настоящее время длительно действующие селективные агонисты имидазолиновых рецепторов (I1-рецепторы, моксонидин) занимают особое место в лечении АГ у больных с МС, поскольку не только эффективно снижают АД, но и оказывают благоприятное метаболическое действие (8, 15) (рисунок 2).
I1-рецепторы принято подразделять на два основных типа, получивших названия I1 и I2-рецепторы (8). I1-рецепторы локализованы в мембранах нейронов ствола головного мозга, клетках мозгового вещества надпочечников, почках, поджелудочной железе, тромбоцитах. I2-рецепторы обнаружены в нейронах коры больших полушарий, клетках почек, печени, тромбоцитах, но их роль как возможного объекта фармакологического воздействия пока изучена меньше (5, 7). Основной механизм действия препаратов этой группы определяется селективным агонизмом в отношении I1-рецепторов нейронов, расположенных в ростральных вентролатеральных ядрах продолговатого мозга, и минимальной a2-адренегрической активностью (17, 23). Ростральные вентролатеральные ядра гипоталамуса являются участком головного мозга, где происходит активация СНС (15). Активация I1-рецепторов под влиянием моксонидина ведет к снижению тонуса сосудодвигательного центра, уменьшению активности симпатических нервов, вследствие чего ослабляется выброс норадреналина из адренергических нейронов. В дополнение к описанному механизму уменьшается выделение адреналина из мозгового вещества надпочечников (3).Взаимодействуя с I1-рецепторами почек, моксонидин уменьшает задержку натрия и воды (7, 15).
Наряду с этим центральные I1-рецепторы гипоталамической области вовлечены в регуляцию углеводного обмена, показанное в эксперименте с селективным агонистом I1-рецепторов агматином, вызывающим снижение уровня глюкозы в крови. Аналогичным действием обладает и моксонидин (7). Предполагается, что активация I1-рецепторов поджелудочной железы приводит к увеличению секреции инсулина (8).
Обладая выраженным антигипертензивным действием, моксонидин, как свидетельствуют результаты экспериментальных и клинических исследований, повышает чувствительность тканей к инсулину, т.е. влияет на ключевой патофизиологический механизм МС – ИР (10, 13, 17). Результаты эксперимента Velliquette R. A. с соавт. на животных моделях ИР (крысы с артериальной гипертензией и ожирением) свидетельствуют о том, что терапия моксонидином положительно влияет на различные гормонально-метаболические нарушения на фоне ИР (23). Так, наряду с нормализацией показателей АД, лечение препаратом сопровождается снижением в плазме натощак концентрации иммунореактивного инсулина (ИРИ), глюкагона, холестерина, триглицеридов, СЖК, уменьшением площади под кривой концентрации глюкозы при проведении глюкозотолерантного теста (ГТТ). Представленные результаты указывают на улучшение чувствительности тканей к инсулину на фоне терапии моксонидином. Данный важный эффект, по-видимому, обусловлен способностью моксонидина ингибировать симпатическую активность и повышать экспрессию и фосфорилирование тирозина инсулинового рецептора и субстрата инсулинового рецептора в печени.
В другом исследовании, проведенном на крысах линии Zucker, отмечено, что моксонидин улучшает захват и утилизацию глюкозы скелетными мышцами, снижает гепатическую продукцию глюкозы, уровень ИРИ в ходе ГТТ и концентрацию СЖК (12) (таблица 1). Кроме того, моксонидин снижает потребление пищи и массу тела у генетически тучных гипертензивных крыс линии Zucker. Терапия моксонидином приводила к снижению потребления пищи у тучных крыс на 20% , в результате чего к концу исследования средняя масса тела в группе тучных крыс была на 15% меньше, чем в группе не получавшей моксонидин (6). Кроме того, применение моксонидина у крыс линии Zucker вызывало снижение уровня гипоталамического нейропептида Y, что может быть одним из механизмов, объясняющих эффекты моксонидина в виде уменьшения потребления пищи, стимуляции термогенеза и снижения избыточной массы тела (1).
Открытые клинические исследования показывают, что моксонидин снижает систолическое АД на 20-30 мм. рт.ст. и диастолическое на 10-20 мм. рт.ст (13, 21, 22). В исследовании Sanjuliani A.F. и соавт. с параллельными группами, рандомизированными на прием моксонидина и амлодипина (препарат сравнения), участвовало 40 человек с ожирением и АГ (21). Эффективный контроль АД был достигнут у 58% в группе моксонидина и 52% в группе амлодипина. Через 24 недели терапии моксонидином, назначавшимся в небольшой дозе 0,4 мг/сут., с подбором средней дозы до 0,6 мг/сут, уровни адреналина и норадреналина в артериальной крови в положении пациента «лежа на спине» достоверно снизились на 22,5% и 20,4% соответственно. Также наблюдалось достоверное снижение уровня норадреналина в венозной крови в ортостазе. Терапия амлодипином не сопровождалась достоверными изменениями концентрации катехоламинов плазмы. Помимо этого на фоне лечения моксонидином улучшались и другие гормонально-метаболические показатели. Концентрация ИРИ натощак снизилась на 23%, через 120 минут после нагрузки глюкозой на 45,6% (с 139,7±31,2 до 76,0±15,2 Ед/мл), индекс ИР при оценке по модели HOMA – на 18%. Амлодипин был нейтрален в отношении показателей углеводного обмена. Через 6 месяцев терапии только моксонидин достоверно снижал уровни лептина в плазме до 22,6 пг/мл при исходной концентрации 27,2 пг/мл (на 16,9%). Важно отметить, что у пациентов с эффективным контролем АД на фоне терапии моксонидином концентрации ИРИ и лептина в плазме крови достоверно снижались в большей степени, в отличие от пациентов с неэффективным контролем АД.
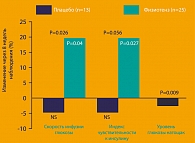
В плацебо-контролируемом исследовании с участием 77 пациентов с АГ и избыточной массой тела, лечение моксонидином в течение 8 недель вызывало достоверное улучшение чувствительности к инсулину (10) (рисунок 3). Этот эффект наблюдался только в группе с предшествующим нарушением толерантности к глюкозе. У 40 больных была выявлена ИР и индекс чувствительности к инсулину у них составил 3,6 и ниже. У пациентов с нормальной толерантностью к глюкозе моксонидин не влиял на чувствительность к инсулину. (Haenni A,) 30.
Важной особенностью действия моксонидина, помимо его основного антигипертензивного эффекта, является благоприятное влияние на эндотелиальную функцию (22). В исследовании Orynchak M.A. и соавт. показано, что эффективный контроль АД на фоне терапии моксонидином сопровождается снижением концентрации маркеров эндотелиальной дисфункции: тромбомодулина плазмы (с 51 до 44 нг/мл) и ингибитора активатора плазминогена-1 (с 15,8 до 11,5 МЕ/мл) (16). Кроме того, по сравнению с группой контроля на 25% снизилась концентрация сосудистого эндотелиального фактора роста.
Физиотенз имеет длительный период полувыведения, который у пациентов с нормальной функцией почек составляет около 2,5 часа (8) (таблица 2), поэтому его назначают в дозах 0,2-0,4 мг один раз в сутки, при необходимости увеличивая суточную дозу до 0,6 мг (в 2 приема). Антигипертензивный эффект препарата сохраняется на протяжении более 24 часов, что предполагает задержку его в центральной нервной системе посредством прочного связывания с I1-имидазолиновыми рецепторами (17). Не метаболизируясь при первичном прохождении через печень, препарат выделяется в основном в неизменном виде в течение 24 часов с мочой (15). Благодаря селективности действия на I1-рецепторы, моноксидин обладает лучшей переносимостью, чем ранее использовавшиеся антигипертензивные препараты с центральным механизмом действия (клонидин) (7, 23). Оказывая влияние также на a2-адренорецепторы, данные препараты вызывали такие побочные эффекты, как сухость во рту, сонливость, запоры, слабость, неприемлемые для многих пациентов при длительном применении. Моксонидин является центрально действующим селективным агонистом I1-имидазолиновых рецепторов, аффинность к которым более чем в 30 раз превышает аффинность препарата к α2-адренорецепторам (7).
В целом моксонидин хорошо переносится больными МС, обладая лишь несколькими нежелательными эффектами (сухость во рту, слабость, диарея, тошнота, головокружение). Все побочные эффекты моксонидина, за исключением сухости во рту, слабости, не связаны с ингибированием α2-адренорецепторов. Поскольку антагонизм по отношению к α2-адренорецепторам не является основным механизмом действия моксонидина, препарат в отличие от клонидина не вызывает рикошетного повышения АД при отмене. Помимо этого, у большинства пациентов, получающих моксонидин, отсутствует седативный эффект, особенно при назначении препарата на ночь.
В заключение следует отметить, что при выборе эффективного препарата для фармакотерапии АГ больных МС всегда нужно помнить о доказанных преимуществах моксонидина – метаболических эффектов у такой категории больных. Несомненное достоинство длительно действующего агониста имидазолиновых рецепторов моксонидина заключается в том, что снижение артериального давления сочетается с улучшением чувствительности тканей к инсулину, позволяющее рекомендовать его в качестве препарата первого выбора при АГ у больных МС.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.