Церебральная микроангиопатия, ассоциированная с артериальной гипертензией и метаболическими нарушениями
- Аннотация
- Статья
- Ссылки
- English

Введение
Артериальной гипертензией (АГ) страдает более 60% людей в возрасте 55 лет и старше и более 80% людей в возрасте старше 85 лет [1]. Мозг является одним из органов-мишеней, наиболее рано поражаемых при АГ: в первую очередь страдают сосуды мелкого калибра, в результате чего наблюдаются повреждение белого вещества, расширение периваскулярных пространств и лакунарные инфаркты.
Поражение церебральных сосудов мелкого калибра (церебральная микроангиопатия или дисциркуляторная энцефалопатия) – основной фактор развития когнитивных нарушений и сосудистой деменции. Ввиду распространенности и медицинской значимости проблемы тонкие механизмы патогенеза церебральной микроангиопатии, а также связь между ангиопатией и когнитивными нарушениями находятся в фокусе современных научных исследований. Более сложные взаимосвязи возникают при кумулятивном поражении церебральных сосудов АГ и коморбидными патологическими состояниями, в первую очередь сахарным диабетом и метаболическим синдромом. Уже давно известно, что АГ коррелирует с различными метаболическими нарушениями, включая ожирение, нарушение липидного обмена, интолерантность глюкозы, инсулинорезистентность и гиперурикемию. Коморбидность АГ и метаболических нарушений чрезвычайно распространена: например, более 70–80% больных сахарным диабетом второго типа имеют артериальную гипертензию [2]. Пациент с АГ и метаболическими нарушениями – типичный пациент на амбулаторном приеме терапевта, кардиолога, невролога.
Основным этиопатогенетическим фактором поражения церебральных сосудов мелкого калибра, ассоциированным с АГ и метаболическими нарушениями, является эндотелиальная дисфункция – наиболее ранний признак атеросклероза и риска развития таких осложнений цереброваскулярной болезни, как инсульт и когнитивные нарушения [3].
Не вызывает сомнений, что эндотелий – важный гомеостатический орган, контролирующий регуляцию сосудистого тонуса. В норме он поддерживает структуру и тонус сосуда, регулируя баланс между вазодилатацией и вазоконстрикцией, ингибицией и активацией роста эндотелия, антитромбогенезом и протромбогенезом, антивоспалительными и провоспалительными реакциями, а также антиоксидантными и прооксидантными эффектами. Эндотелиальные клетки способны синтезировать широкий спектр антиатеросклеротических веществ, в частности оксид азота (NO), который вырабатывается в результате метаболизма L-аргинина под воздействием эндотелиальной NO-синтазы (eNOS), конститутивно синтезируемой в эндотелиальных клетках. Различные физиологические состояния, стимулирующие эндотелий, индуцируют продукцию NO. Протективный механизм NO включает вазодилатацию, ингибирование адгезии лейкоцитов, пролиферации клеток мышечной стенки сосуда, экспрессии молекул адгезии, а также адгезии и агрегации тромбоцитов [4].
На ранних стадиях повреждения эндотелия возникают только обратимые изменения эндотелиальной функции, которые принято обозначать термином «эндотелиальная дисфункция». Фундаментальный признак дисфункции – нарушение биодоступности NO и соответственно ослабление сосудорасширяющей реакции на эндотелиальные раздражители. При уменьшении биодоступности NO эндотелий пытается компенсировать дефицит различными физиологическими путями.
Окислительный стресс, при котором происходит накопление в крови большого количества активных форм кислорода (свободнорадикальных соединений), значительно стимулирует прогрессирование эндотелиальной дисфункции [5]. В случае выраженного окислительного стресса даже при нормальном синтезе NO происходит его быстрая инактивация. Связь эндотелиальной дисфункции и сердечно-сосудистых факторов риска, как правило, двусторонняя. Например, у женщин в постменопаузальном периоде эндотелиальная дисфункция может быть, с одной стороны, предрасполагающим фактором для развития АГ [6] и сахарного диабета [7], а с другой – пусковым патогенетическим механизмом для их появления.
Следует отметить роль эндотелиальной дисфункции в прогрессировании атеросклеротического повреждения органов-мишеней, в первую очередь сердца, почек, артерий, питающих мозг. В настоящее время нет специфических исследований, оценивающих связь функции периферического эндотелия и эндотелия церебральных сосудов. Однако имеющиеся данные свидетельствуют об увеличении циркулирующих маркеров повреждения эндотелия: молекул адгезии сосудистого эндотелия первого типа, тромбомодулинов, тканевых факторов свертывания крови и ингибитора пути тканевого фактора – у пациентов с церебральной микроангиопатией.
Эндотелиальная дисфункция и артериальная гипертензия
Большинство экспертов рассматривают нарушение свойств эндотелия как основной механизм становления АГ. Механизм развития эндотелиальной дисфункции при гипертонической болезни окончательно не выяснен. Однако значение имеет снижение активности NO-синтазы, вследствие чего уменьшается выработка NO или повышается его инактивация свободными радикалами – продуктами перекисного окисления липидов. Основное последствие нарушения эндотелий-зависимой вазодилатации – усиление периферического сопротивления. Артериальная ригидность способствует увеличению импульсного давления, что является гемодинамическим стрессором для мозга, который имеет низкую резистентность к пульсовому ударному потоку. Ударное давление в первую очередь наносит ущерб сосудам головного мозга мелкого калибра. Нарушение функционирования пенетрирующих артерий и артериол приводит к расстройству механизмов ауторегуляции мозгового кровообращения и нарушению целостности гематоэнцефалического барьера [8]. Повышение проницаемости гематоэнцефалического барьера сопровождается экстравазацией компонентов плазмы непосредственно в артериальную стенку (что способствует ее утолщению и дезинтеграции), прилегающие области мозга с развитием периваскулярного отека (что может быть одним из механизмов поражения белого вещества), а также процессами асептического воспаления. Эти изменения – важный этап, предшествующий повреждению ткани мозга, включая инсульт лакунарного подтипа. Ввиду более неблагоприятных условий кровоснабжения подкорковое и перивентрикулярное белое вещество полушарий головного мозга может страдать в большей степени, чем серое вещество мозга, что обусловливает клиническую картину хронической ишемии мозга. В результате повреждения мелких сосудов головного мозга нарушается перфузия в лобных-подкорковых областях мозга. В белом веществе появляются обширные зоны неполных инфарктов с демиелинизацией, утратой олигодендроцитов и аксонов. В последнее время накапливаются работы, показывающие связь артериальной ригидности и структурных изменений головного мозга: гиперинтенсивность белого вещества в Т2-режиме магнитно-резонансной томографии (лейкоареоз), лакунарных инфарктов и атрофии коры головного мозга [9, 10].
Эндотелиальная дисфункция и сахарный диабет
У больных сахарным диабетом, как правило, наблюдается нарушение эндотелий-зависимой вазодилатации. Отчасти это связано с высокой коморбидностью диабета с другими факторами воздействия на эндотелий, включая АГ, ожирение и дислипидемию, вкусовые предпочтения (употребление высококалорийных продуктов с последующим образованием свободнорадикальных соединений, способных per se индуцировать нарушение функции эндотелия) [11].
В последнее время появляется все больше публикаций о взаимодействии инсулина и eNOS. Показано, что в норме инсулин способен индуцировать дозозависимое увеличение кровотока за счет снижения сосудистого сопротивления в скелетной мышце и вазодилатации микрососудистого русла [12]. Сосудорасширяющее действие инсулина опосредуется повышенным синтезом NO благодаря активации инсулиновых рецепторов фосфоинозитид-3-киназного пути и повышению экспрессии eNOS [13]. Таким образом, инсулин через прямое взаимодействие с системой эндотелиальной eNOS/NO или другими внутриклеточными системами участвует в регуляции сосудистого тонуса и реактивности. Инсулинорезистентность нарушает вышеописанную регуляцию сосудистого тонуса. Кроме того, гипергликемия приводит к образованию продуктов ускоренного гликирования, которые формируются в результате неферментативных реакций белков с глюкозой и ее производными. Продукты ускоренного гликирования инициируют экспрессию генов коллагена и других белков капиллярной мембраны, обладающих проатерогенными свойствами.
Важная роль в развитии сосудистых осложнений диабета принадлежит неферментативному аутоокислительному гликозилированию и окислительному стрессу, вызванному нарушением углеводного обмена. Снижение биодоступности NO и редукция антиоксидантной защиты – основные механизмы эндотелиальной дисфункции независимо от причины повреждения эндотелия. Собственно метаболические нарушения и сахарный диабет, коморбидный с АГ, независимо или совместно нарушают эндотелиальную функцию по общим механизмам, провоцируя развитие атеросклероза и тромбоэмболических осложнений.
Эндотелиальная дисфункция и тромбогенез
У всех пациентов с эндотелиальной дисфункцией, включая самые ранние формы, имеются однонаправленные изменения гемореологии и гемостаза, выражающиеся прежде всего в повышении агрегационной активности тромбоцитов. Тромбоциты играют решающую роль в тромбозе, воспалении и атерогенезе. Артериальные тромбы состоят преимущественно из тромбоцитов, образующихся в условиях повышенного кровотока в местах атеросклеротического поражения сосудов. Хроническая атеросклеротическая болезнь часто клинически не проявляется, но при осложнении тромбозом может привести к острому коронарному синдрому, инсульту, транзиторной ишемической атаке. Тромбоциты – ключевой фактор клинических событий при атеротромбозе.
Важный фактор, способствующий развитию атеротромбоза, – окислительный стресс. Известно, что поврежденный эндотелий сосудистой стенки продуцирует активные формы кислорода и способствует активации лейкоцитов и тромбоцитов. Развивающаяся агрегация тромбоцитов за счет образования тромбоцит-тромбоцитарных взаимодействий связана с увеличением потребления кислорода. Образующиеся активированные тромбоцитарно-нейтрофильные комплексы высвобождают NO, который взаимодействует с супероксид-анион-радикалом, модулируя таким образом воспалительный процесс в сосудистой стенке. Активированные тромбоциты вступают в контакт с субэндотелиальным слоем, образуют отростки с формированием тромбоцитарных конгломератов (агрегация) и приклеиваются (адгезия) на этих участках, образуя белый тромб.
Длительно сохраняющаяся повышенная активность тромбоцитов – одна из причин тромботических осложнений многих заболеваний. Антиагрегантные препараты ингибируют агрегацию тромбоцитов и эритроцитов, уменьшают их способность к склеиванию и прилипанию к эндотелию кровеносных сосудов. Антиагреганты способны не только предупреждать агрегацию, но и вызывать дезагрегацию уже агрегированных кровяных пластинок.
Клиническая манифестация церебральной микроангиопатии, ассоциированной с артериальной гипертензией и метаболическими нарушениями
Выявление снижения когнитивных способностей на ранних стадиях у пациентов с АГ предоставляет уникальную возможность для проведения профилактической терапии до развития деменции. Церебральная микроангиопатия длительное время протекает асимптомно и обычно игнорируется. Поэтому важно ориентироваться не только на нарушения когнитивной функции, но и на неспецифические церебральные симптомы. Развернутая клиническая картина включает три кластера симптомов (табл. 1).
Наиболее ранний клинический маркер недостаточности церебральной перфузии – расстройства тревожно-депрессивного спектра, проявляющиеся множеством неспецифических жалоб преимущественно астенического круга, за фасадом которых скрываются мягкие когнитивные нарушения. Обычно это нарушение регуляторных когнитивных функций и внимания при полном сохранении бытовой независимости и профессиональных навыков. В таких случаях пациенты редко жалуются на грусть, печальное настроение, тоскливое ожидание будущего. Напротив, их в большей степени беспокоят неспецифические соматические симптомы (астения, быстрая утомляемость, боли, плохой сон, снижение аппетита и др.). Тревога часто сопровождает депрессию позднего возраста. Маской психических симптомов депрессии также могут быть раздражительность, ворчливость, которые часто расцениваются окружающими как особенность пожилого возраста. Сочетание нарушения концентрации внимания с легкими или умеренными симптомами тревожно-депрессивного спектра и едва заметными изменениями походки в виде замедления, укорочения шага, неустойчивости (жалоба на головокружение) может свидетельствовать о клиническом дебюте сосудистой энцефалопатии.
При прогрессировании заболевания усугубляется когнитивный дефицит. Врачу не следует пренебрегать активной жалобой пациента на забывчивость. Необходимо проанализировать, как забывчивость отражается на ежедневном функционировании пациента. Кроме того, важно получить объективное свидетельство родственников о чрезмерной забывчивости пациента в последнее время: например, пациент не может запомнить новые имена, имеет затруднения при счетных операциях.
Умеренные когнитивные нарушения характеризуются постоянной забывчивостью, утомляемостью при выполнении обычной умственной работы. Описанные нарушения вызывают у пациента сложности, но не лишают его независимости. Такой пациент не может правильно организовать свою деятельность, быстро устает, часто допускает ошибки из-за невнимательности. Во время беседы врач может заметить, что пациент затрудняется самостоятельно полно изложить анамнез, не понимает его рекомендаций. Если такой пациент оказывается на приеме с сопровождающим, например с родственником, то при попытке ответить на вопрос врача он поворачивается к сопровождающему лицу, ища поддержки или подсказки. Данный феномен получил название «симптом поворачивающейся головы».
Множество неспецифических жалоб у пожилого пациента также должно настораживать клинициста, особенно если пациент не может объяснить их суть. Когнитивные нарушения сосудистой природы обязательно сопровождаются нарушениями со стороны неврологического статуса, в частности почти всегда нарушается походка. Это может легко заметить даже врач, не имеющий навыков неврологического осмотра. Походка у пациента становится осторожной, замедленной, он испытывает трудности при начале ходьбы, поворотах, иногда шаркает, вероятны падения. Пациент может активно жаловаться на неустойчивость.
Синдромальная диагностика включает установление факта снижения когнитивных способностей по сравнению с индивидуальной нормой и оценку тяжести когнитивных нарушений. Значительную помощь в синдромальной диагностике могут оказать нейропсихологические тесты. Простой в использовании тест Mini-Cog применяется для скрининговой оценки когнитивной сферы. Наиболее чувствительна и специфична к умеренным когнитивным нарушениям Монреальская шкала оценки когнитивных функций, включающая исследование различных когнитивных сфер: концентрации внимания, исполнительных функций, памяти, языка, зрительно-конструктивных навыков, абстрактного мышления, счета и ориентации.
На втором этапе диагностического поиска определяются наиболее вероятные причины когнитивных расстройств, то есть осуществляется нозологическая диагностика. При подозрении на когнитивный дефицит в анамнезе у пациента следует попытаться выявить и взвесить факторы риска сосудистых когнитивных нарушений: артериальную гипертензию неустановленной давности, избыточную массу тела в прошлом, кардиальную патологию, нарушение гликемического контроля и др. Соматическое обследование абсолютно необходимо для диагностики ведущего сосудистого фактора риска либо равноценного комплекса таких факторов, например метаболического синдрома. При наличии у пациента двух из пяти диагностических критериев метаболического синдрома (повышенного артериального давления и абдоминального ожирения) [14] проводится инициальное лабораторное исследование, включающее стандартную биохимическую панель для оценки обмена глюкозы, липидов и почечной функции. Для верификации сосудистой природы когнитивных нарушений большое значение имеют результаты нейровизуализации. В соответствии с современными требованиями диагноз сосудистых когнитивных расстройств неправомерен при отсутствии нейровизуализационного подтверждения. Магнитно-резонансная томография помогает выявить различные варианты морфологических изменений, связанных с патологией мелких мозговых артерий, главные из которых диффузное поражение белого вещества (лейкоэнцефалопатия), лакунарные инфаркты, микрокровоизлияния, вторичная церебральная атрофия. Оценка структурных изменений, ассоциированных с микроангиопатией, значительно улучшилась за последнее десятилетие благодаря достижениям в области нейровизуализации.
Дальнейшее прогрессирование заболевания у некоторых больных может привести к развитию деменции с ограничением повседневной активности, формированием зависимости от посторонней помощи. Прогрессирование двигательных нарушений (ходьбы и равновесия) может приводить к падениям, которые в значительной степени ограничивают мобильность пациента. Бремя сосудистой деменции для пациента, его окружения и общества в целом – важный фактор, побуждающий врача к ранней диагностике и лечению церебральной микроангиопатии.
Лечение
На ранних этапах церебральной микроангиопатии лечение проводится с учетом факторов риска и целью предотвратить или значительно замедлить прогрессирование заболевания, в том числе развитие острых состояний. Основные стратегии включают:
- нормализацию артериального давления, углеводного и липидного обмена при их нарушении;
- борьбу с курением, ожирением и гиподинамией;
- ограничение употребления алкоголя, соли, животных жиров.
Для реализации этих мероприятий в первую очередь следует мотивировать пациента к увеличению физической активности, соблюдению диеты, богатой антиоксидантами. Лица, предпочитающие так называемую средиземноморскую диету, реже имеют когнитивные нарушения.
В качестве гипотензивных средств наиболее обоснованным считается применение ингибиторов ангиотензинпревращающего фермента и антагонистов ангиотензиновых рецепторов, поскольку эти препараты повышают реактивность мелких церебральных сосудов, а также обладают антиоксидантной и антивоспалительной активностью [15]. Кроме того, этот класс гипотензивных средств имеет некоторые преимущества для пациентов, страдающих сахарным диабетом. Риск инсульта и сердечно-сосудистых событий значительно уменьшается при уровне систолического артериального давления менее 140 мм рт. ст., а диастолического – менее 90 мм рт. ст. Некоторые эксперты рекомендуют более мягкие целевые цифры артериального давления, например для лиц старше 60 лет – 150/90 мм рт. ст. Однако у пациентов с сахарным диабетом или заболеванием почек следует стремиться к уровню артериального давления ниже 130/80 мм рт. ст.
Метформин обычно используется в инициирующий период лечения для контроля гипергликемии у пациентов с метаболическим синдромом. Некоторые исследования демонстрируют, что метформин помогает обратить вспять патофизиологические изменения у таких пациентов.
При нарушении липидного обмена следует рассмотреть назначение статинов. Существуют убедительные доказательства того, что снижение уровня холестерина липопротеинов низкой плотности увеличивает показатель эндотелий-зависимой вазодилатации [16]. Это связано с тем, что помимо снижения уровня холестерина в крови статины обладают холестерин-независимыми плейотропными эффектами. Обсуждается влияние статинов на уменьшение риска инсульта. Кроме того, статины не дают откладываться бета-амилоиду в сосудистой стенке, что замедляет течение микроангиопатии. Если не удается достигнуть желаемого результата, используя диету в сочетании с приемом статинов, можно добавить препараты нестатинового ряда, снижающие уровень липидов, например из группы фенофибратов или содержащие омега-3-полиненасыщенную жирную кислоту.
Главное клиническое показание к антиагрегантной терапии – профилактика артериального тромбоза. В ходе многочисленных исследований изучалась роль антиагрегантных средств в первичной и вторичной профилактике цереброваскулярных осложнений. Польза антиагрегантной терапии при вторичной профилактике не вызывает сомнений. Напротив, при первичной профилактике данные о рутинном применении ацетилсалициловой кислоты или любого другого антиагрегантного средства неоднозначны, что предполагает назначение антиагрегантной терапии на индивидуальной основе, если тромботический риск перевешивает риск серьезных осложнений кровотечения.
Дополнительное показание для назначения антиагрегантной терапии – сочетание АГ с сахарным диабетом или метаболическим синдромом. У этой категории больных, имеющих начальные клинические проявления церебральной микроангиопатии, целесообразно использовать антиагреганты с максимальными преимуществами по совокупному показателю «эффективность – безопасность» и при условии строгого контроля состояния гемостаза. Один из наиболее безопасных препаратов – дипиридамол, антиагрегантное действие которого не сопровождается подавлением активности циклооксигеназы и уменьшением синтеза простациклина, как при приеме ацетилсалициловой кислоты, благодаря чему не нарушается протекция слизистых оболочек. Важный аспект безопасности дипиридамола – возможность управляемого антитромботического эффекта путем подбора оптимальной дозы. Антитромботический эффект дипиридамола реализуется через два дополняющих друг друга механизма: антиагрегантное действие, которое препятствует формированию тромба, и действие, связанное с активацией плазмина, которое редуцирует образовавшийся тромб.
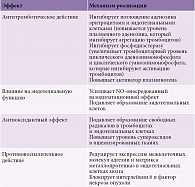
Более чем 30-летний период клинического использования дипиридамола подтверждает его эффективность в профилактике инсульта, причем и в режиме монотерапии, и в комбинации с ацетилсалициловой кислотой. Но при ведении пациентов с церебральной микроангиопатией крайне важны дополнительные эффекты дипиридамола (табл. 2), в первую очередь его влияние на эндотелиальную дисфункцию. Известно, что дипиридамол усиливает NO-опосредованный вазодилататорный эффект [17] и подавляет образование эндотелиальных клеток, выделяющих активные формы кислорода, что улучшает окислительно-восстановительный баланс эндотелия. Таким образом, дипиридамол регулирует одновременно NO-опосредованную вазодилатацию и выделение супероксида из эндотелия [18]. В результате этого комбинированного (антиагрегантного и вазодилататорного) эффекта дипиридамол приводит к улучшению микроциркуляции и перфузии ткани.
Как потенциальный окислительный агент, передающий электроны от гидрофильных и гидрофобных молекул, дипиридамол устраняет продукты свободнорадикального окисления, вследствие чего повышается васкулярная протекция. Как показали многие экспериментальные исследования, нейтрализация свободных радикалов предупреждает развитие патологической вазореактивности и нарушение проницаемости гематоэнцефалического барьера [19, 20], что важно для профилактики церебральной микроангиопатии. Установлено, что дипиридамол в низких дозах эффективно предотвращал ангиопатию и нефропатию на экспериментальных моделях сахарного диабета за счет снижения вазоренального окислительного стресса [21].
Наконец, противовоспалительный эффект дипиридамола направлен на ключевое звено патогенеза атеросклероза. Важнейшая особенность дипиридамола – его способность увеличивать образование эндотелиального фактора роста и стимулировать развитие капиллярной сети за счет действия аденозина на аденозиновые рецепторы в капиллярах. Этот эффект стимуляции ангиогенеза важен для пациентов с ишемической болезнью сердца, у которых в результате повышается толерантность к физической нагрузке, и для больных с левожелудочковой дисфункцией, у которых увеличивается фракция выброса.
Обзор плейотропных эффектов дипиридамола свидетельствует о перспективности его применения для лечения церебральной микроангиопатии и первичной профилактики сосудистых нарушений. Первичная профилактика может проводиться дипиридамолом в режиме монотерапии – по 25 или 75 мг три раза в сутки.
Заключение
Профилактика и лечение церебральных осложнений АГ и метаболических нарушений требуют изменения стиля жизни, пищевых привычек и комплексного медикаментозного вмешательства, воздействующего на все патогенетические звенья, с целью улучшения или обратного развития эндотелиальной дисфункции.
O.V. Vorob'eva
I.M. Sechenov First Moscow State Medical University
Contact person: Olga Vladimirovna Vorob’eva, ovvorobeva@mail.ru
Endothelial dysfunction is the main etiopathogenetic factor of cerebral vascular lesions of small caliber associated with hypertension and metabolic disorders. Endothelial dysfunction is the earliest sign of atherosclerosis and the risk of complications of cerebrovascular disease, such as cognitive impairment. Timely complex therapy is a decisive factor in the reverse development of endothelial dysfunction and reliable prevention of vascular cognitive impairments. The drug dipyridamole, which has pleiotropic effects, can be considered as one of the pathogenetically justified means in the complex drug therapy of endothelial dysfunction.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.