Факторы, определяющие риск возникновения переломов у больных ревматоидным артритом*
- Аннотация
- Статья
- Ссылки
- English



Ревматоидный артрит (РА) – наиболее распространенное аутоиммунное воспалительное заболевание неизвестной этиологии, характеризующееся хроническим эрозивным артритом (синовитом) и системным поражением внутренних органов. В мире этим заболеванием страдают от 0,5 до 1% людей [1]. Среди наиболее частых социально значимых, жизнеугрожающих осложнений течения и терапии РА рассматриваются сердечно-сосудистые катастрофы, тяжелые инфекции, амилоидоз и переломы различных локализаций, которые, по данным зарубежных авторов, у больных РА возникают в 1,5–2 раза чаще, чем в популяции. Что касается перелома шейки бедра (ШБ), наиболее опасного перелома в отношении дальнейшего прогноза для жизни и трудоспособности, его относительный риск (ОР) достигает 2,1 [2]. По данным финских авторов, этот показатель еще выше – 3,26 [3]. Не менее значимыми причинами снижения качества жизни и инвалидизации являются деформации и переломы позвонков. У больных РА они случаются в 2–4 раза чаще, чем в популяции [4–6].
К наиболее значимым факторам риска переломов у больных РА относятся: снижение минеральной плотности кости (МПК), прием и кумулятивная доза глюкокортикостероидов (ГКС), менопауза, низкий индекс массы тела (ИМТ), склонность к падениям. Однако наибольший интерес представляет вклад самого заболевания и его течения, хронического воспаления и концентрации провоспалительных цитокинов в моделирование и ремоделирование костной ткани, в увеличение риска переломов у больных РА.
Как известно, периартикулярный остеопороз – наиболее ранний признак изменений в костной ткани при РА. Генерализованный остеопороз присоединяется позже. Установлено, что в патогенезе вторичного остеопороза и эрозивно-деструктивных изменений в суставах при РА ключевую роль играют провоспалительные цитокины (фактор некроза опухоли альфа, интерлейкины 6, 1 и др.). Провоспалительные цитокины способны связываться с рецепторами на поверхности остеокластов и запускать процессы костной резорбции. Из-за дисбаланса между костеобразованием и костной резорбцией нарушается минерализация, изменяется структура и микроархитектоника костной ткани, уменьшается плотность кости. Это приводит к возникновению остеопороза, снижению прочности кости, а в конечном итоге – к переломам.
В ряде зарубежных исследований были проанализированы возможные факторы риска (ФР) переломов у больных РА. В некоторых работах использовали небольшие выборки, что повлияло на репрезентативность полученных результатов [7, 8]. В одних исследованиях изучались конкретные локализации переломов (только вертебральные [1, 4, 7, 9] или, напротив, вневертебральные [3, 10]), в других – круг анализируемых потенциальных факторов риска был слишком мал и многие важные характеристики РА или терапии ГКС не рассматривались [11]. Таким образом, вопросы, у каких больных РА имеется максимальный риск переломов, кому из них в первую очередь назначать профилактические или лечебные мероприятия и на каком этапе, остаются нерешенными.
Цель исследования – охарактеризовать группы больных РА с переломами и без переломов в анамнезе для дальнейшего выделения возможных факторов риска переломов.
Материалы и методы исследования
Данная работа представляет собой фрагмент многоцентровой программы «Остеопороз при ревматоидном артрите: диагностика, факторы риска, переломы, лечение», проведенной в 2010–2011 г. и включавшей мужчин и женщин в возрасте 18 лет и старше с достоверным диагнозом «ревматоидный артрит» в соответствии с критериями Американской коллегии ревматологии (American College of Rheumatology, ACR) 1987 г., с исходной денситометрической оценкой МПК и возможностью динамического наблюдения на протяжении не менее 3 лет. Для настоящего исследования были отобраны 254 женщины в возрасте от 18 до 85 лет с давностью заболевания от полугода до 42 лет. На всех больных были заполнены специально разработанные тематические карты, данные внесены в таблицу Exсel для дальнейшей статистической обработки. Сведения о больных включали результаты опроса, оценку коморбидных состояний, осмотр, анализы крови (скорость оседания эритроцитов (СОЭ), тест на C-реактивный белок (СРБ), гемоглобин, общепринятые биохимические показатели), оценку активности заболевания (DAS28 – disease activity score) и опросник для оценки состояния здоровья (HAQ – Health Assessment Questionnaire). Пациенткам была выполнена рентгенография кистей и стоп, грудного и поясничного отделов позвоночника в боковой проекции. Подсчет общего числа эрозий и сужений суставных щелей по методу Sharp проведен у 108 больных, оценка индекса деформаций по методу Genant – у 173 больных в возрасте от 18 до 65 лет. МПК в поясничном отделе позвоночника (L1–L4) определена у 198 больных, в проксимальном отделе бедренной кости – у 184, в костях предплечья (средняя треть лучевой кости) – у 134 с использованием двухэнергетической рентгеновской абсорбциометрии (dual-energy X-ray absorbtiometry – DXA) на аппарате Hologic QDR1000. У женщин в постменопаузальном периоде диагноз остеопороза был установлен по T-критерию ≤ -2,5 стандартных отклонения (СО) от пика костной массы, у женщин с сохраненным менструальным циклом – по Z-критерию ≤ -2,5 СО в соответствии с рекомендациями Международного общества по клинической денситометрии 2007 г. [12]. Значения МПК от -1 до -2,5 СО по T- или Z-критерию у женщин после/до менопаузы соответственно свидетельствовали об остеопении.
Были проанализированы данные анамнеза: характер перелома (низкоэнергетический или полученный в результате травмы при падении с высоты собственного роста), возраст больных на момент возникновения перелома, возникновение перелома до/после наступления РА, менопаузы, количество и локализация переломов. Сведения о переломах подтверждены медицинской документацией или рентгенограммами.
Статистическая обработка материала выполнена с использованием программ Microsoft Excel, Biostatistics Version 4.03, Statistic 6.
Результаты
254 больных РА были разделены на две группы. В 1-ю группу вошла 101 (39,8%) пациентка с низкоэнергетическими переломами в анамнезе, во 2-ю группу – 153 (60,2%) пациентки без переломов. Основные характеристики больных каждой группы представлены в табл. 1.
Средний возраст пациенток 1-й группы составил 59,8 ± 11,8 года, 2-й группы – 56,1 ± 11,4 года (р < 0,05). Антропометрические характеристики, такие как рост, вес, ИМТ, окружность талии и бедер, в обеих группах были сопоставимы. У 89 (88,1%) и 119 (77,8%) больных 1-й и 2-й группы соответственно на момент обследования наступила менопауза (p < 0,05). Длительность менопаузы и средний возраст больных при ее наступлении в группах не различался. Пациентки обеих групп были сопоставимы по возрасту, однако продолжительность болезни у больных с переломами была существенно выше (15,5 ± 9,7 года), чем у пациенток без переломов (11,5 ± 7,8 года) (р < 0,001). В 1-й группе у большинства (61,6%) пациенток длительность болезни превысила 10 лет. Во 2-й группе таких пациенток было меньше – 45%.
Больше половины больных обеих групп имели III или IV рентгенологическую стадию РА по Штейнброкеру. При этом IV стадия РА встречалась достоверно чаще в группе больных с переломами (р < 0,05). Общий подсчет числа эрозий и сужений суставных щелей по Sharp в группах с переломами и без переломов статистически не различался (р > 0,05).
Различий в оценке степени активности заболевания по показателю DAS28 между группами не выявлено. В обеих группах на момент исследования преобладали больные с умеренной степенью активности. Среднее значение показателя HAQ оказалось выше в группе больных с переломами – 1,720 ± 0,755 vs 1,431 ± 0,806 (р < 0,05). Значение показателя HAQ > 2 баллов имели 39,5 и 24,8% женщин 1-й и 2-й группы соответственно (р < 0,05). Низкие значения HAQ (< 1 балла), напротив, достоверно чаще (р < 0,01) встречались среди больных 2-й группы (29,1%) по сравнению с больными 1-й группы (11,6%).
Внесуставные проявления РА отмечались у 58 (59,8%) пациенток с переломами и у 58 (39,5%) пациенток без переломов (р < 0,01). Количество обострений суставного синдрома в течение предшествовавшего года было сопоставимым в обеих группах.
Больных, получавших терапию ГКС свыше 3 месяцев, было достоверно больше в 1-й группе (78,2 vs 66,7%, р < 0,05), кумулятивная доза ГКС также была достоверно выше – 19,037 ± 18,724 vs 13,999 ± 13,769 г (р < 0,05). Продолжительность ГКС-терапии составила 84,4 ± 67 vs 63,8 ± 55,2 месяца (р < 0,01). При этом начальная и среднесуточная дозы ГКС, возраст больных на момент начала ГКС-терапии, процент пациенток с назначением препаратов до/после наступления менопаузы были сопоставимы.
Что касается терапии базисными противовоспалительными препаратами (БПВП), на момент обследования в 1-й группе меньшее количество больных получали БПВП (80,2 vs 89,5%, р < 0,05). При этом средняя продолжительность терапии БПВП между группами не различалась. Пациенток, получавших в анамнезе терапию генно-инженерными биологическими препаратами, было немного – 49 человек. Их количество в группах было сопоставимым.
Особое внимание уделялось анализу показателей МПК (табл. 2). Так, остеопороз в поясничном отделе позвоночника (L1–L4), по данным рентгеновской денситометрии, был установлен у 42,7% больных 1-й группы и у 26,5% больных 2-й группы (р < 0,05), остеопения – у 42,7 и 43,6% (р > 0,05) соответственно. Остеопороз в ШБ также достоверно чаще наблюдали у больных с переломами в анамнезе по сравнению с пациентами без переломов (39,4 vs 24,1%, р < 0,05). Частота остеопении была сопоставима в 1-й и 2-й группе – 46,5 и 50% (р > 0,05) соответственно. В костях предплечья остеопороз диагностирован у 67,3% женщин в группе с переломами и у 41% – в группе без переломов (р < 0,05).
Мы сопоставили в группах частоту осложнений РА (амилоидоз и остеонекроз) и сопутствующих заболеваний (гипотиреоз, артериальная гипертония, сахарный диабет, эрозивно-язвенные поражения желудочно-кишечного тракта, хронические обструктивные заболевания легких), негативное влияние которых на состояние костной ткани подтверждено данными литературы. Сопутствующие заболевания были выявлены у 85 (84,2%) больных 1-й группы и у 108 (70,6%) пациенток 2-й группы (р < 0,05). Артериальной гипертонией страдали 71 (70,3%) и 86 (56,2%) больных 1-й и 2-й группы соответственно (р < 0,05). Однако количество больных, постоянно принимавших антигипертензивные и мочегонные препараты, оказалось сопоставимым. Сердечно-сосудистые катастрофы (инсульт головного мозга, инфаркт миокарда) в анамнезе с равной частотой встречались в группах с переломами и без таковых: 10 случаев в 1-й группе vs 8 случаев во 2-й. При этом амилоидоз достоверно чаще выявляли у больных с переломами – 6 (5,9%) vs 2 (1,3%) случаев в группе без переломов (р < 0,05) (диагноз подтвержден биопсией). В 1-й группе было значительно больше больных с остеонекрозом определенной локализации – 31 (30,7%) vs 20 (13,1%) и после эндопротезирования – 19,8 vs 5,9% (р < 0,001).
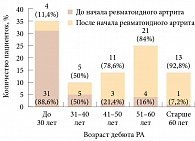
При анализе возраста больных на момент возникновения первого низкоэнергетического перелома, его характера и локализации, связи с РА, приемом ГКС и менопаузой выяснилось, что у 45 (44,5%) женщин перелом возник до начала РА в возрасте 26,5 ± 16 лет, у 56 (55,5%) – после начала заболевания. Средний возраст на момент перелома составлял 51,6 ± 13,7 года (рисунок). У 46 (46,5%) больных переломы возникли после наступления менопаузы, у 53 (53,5%) – до наступления. У 50 пациенток из 101 в анамнезе было более одного случая низкоэнергетического перелома. Всего установлено 178 случаев переломов. Наиболее частыми локализациями переломов оказались кости предплечья – 32 (18%) случая – и кости голени – 24 (13,5%) случая. Переломы позвонков (в том числе деформации с индексом по Genant < 0,80, выявленные при рентгенографии грудного и поясничного отделов позвоночника в боковой проекции) имели 19 (18,8%) женщин. У 10 (9,9%) больных в анамнезе были переломы проксимального отдела бедренной кости; шести из них проведено эндопротезирование тазобедренного сустава. Средний возраст на момент перелома шейки бедра составлял 50,5 ± 16 лет (табл. 3).
Мы выделили подгруппу больных (n = 20) с переломами, дебют заболевания у которых приходился на возраст от 16 до 30 лет (в период моделирования костной ткани и формирования пика костной массы). Средний возраст на момент возникновения первого перелома у этих пациенток составил 32,3 ± 17 лет. У 9 (45%) больных в подгруппе было более одного перелома, всего отмечено 37 случаев переломов, или 20,8% всех проанализированных переломов. На переломы предплечья пришлось 7 (21,9%) случаев в группе с дебютом РА от 16 до 30 лет, переломы голени – 4 (16,7%), переломы позвонков – 5 (26,3%), переломы бедра – 4 (40%) случая.
Обсуждение
Из 254 больных РА, включенных в исследование, более трети (39,8%) имели в анамнезе низкоэнергетические переломы. Согласно результатам анализа, полученным в ходе данного исследования, переломы ассоциировались с возрастом (59,8 ± 11,8 года), наступлением менопаузы, большей длительностью РА, в том числе свыше 10 лет. Также для больных с низкоэнергетическими переломами были характерны более частая терапия ГКС свыше 3 месяцев, длительный прием ГКС (в среднем 84,4 ± 67 месяцев) и кумулятивная доза в среднем 19,037 ± 18,724 г. У таких больных чаще отмечались внесуставные проявления, осложнения РА (амилоидоз и остеонекроз). Не вызвала сомнений связь между возникновением переломов и низкой МПК.
В отличном по дизайну исследовании S.Y. Kim, в котором ФР переломов определялись путем сопоставления больных РА и пациентов без РА, авторы установили, что высокому риску остеопоротических переломов подвержены лица в возрасте 65–74 лет (относительный риск (ОР) 2,18 для больных РА по сравнению с пациентками без РА). Однако наибольшее значение, по результатам данного исследования, имели предшествующие переломы (ОР 5,97, 95% доверительный интервал (ДИ) 5,29–6,75) и женский пол (ОР 1,89, 95% ДИ 1,73–2,07). Прием пероральных ГКС в анамнезе также имел значение (ОР 1,15, 95% ДИ 1,03–1,27). Авторами не отмечено существенного влияния снижения МПК на риск возникновения переломов у больных РА [13].
В самой масштабной по количеству участников работе британских ученых проанализированы наиболее значимые факторы риска переломов у больных РА и пациентов группы контроля. Показано, что больные РА имели повышенный риск переломов, особенно переломов бедра и позвонков. Наибольшее влияние на вероятность возникновения переломов (в частности, переломов бедра) оказали, по мнению авторов, длительность РА свыше 10 лет, низкий ИМТ, а также прием ГКС. Исследователи отметили, что риск переломов у больных РА оставался высоким даже при исключении при расчетах лиц, когда-либо принимавших ГКС: ОР составил 1,3 (95% ДИ 1,2–1,4) для остеопоротических переломов и 1,7 (95% ДИ 1,5–2) для переломов бедра. Как отметили сами авторы, незначительная роль ГКС в возникновении переломов, вероятно, связана с тем, что в данном исследовании лишь четверть больных РА принимали ГКС, что отражает ситуацию в Европе, но не в странах Нового Света (в том числе в США), где терапией ГКС охвачены до 75% больных РА [5].
В проспективном когортном исследовании японских ученых с участием 1733 женщин, больных РА, были определены наиболее значимые ФР переломов, в частности возраст старше 70 лет, высокие значения HAQ, низкий СРБ и переломы в анамнезе. О влиянии ограничения функциональных возможностей и снижения физической активности, которые в значительной мере отражаются при подсчете показателя HAQ, сообщалось неоднократно. В данном исследовании особенно высоко оценено значение данного показателя для риска возникновения переломов костей любой из анализируемых авторами локализаций [11]. В нашем исследовании группе больных РА с переломами в анамнезе также соответствовало высокое среднее значение HAQ.
При анализе показателей мы не получили статистически значимых различий и связи переломов с активностью РА по DAS28 и рентгенологической характеристикой заболевания по индексу Sharp на момент исследования. Субъективные оценки врача степени активности РА и функциональной недостаточности также не различались. В большинстве работ, посвященных изучению ФР переломов у больных РА, в которых выявлена связь между высокой активностью болезни и случаями переломов, помимо клинических параметров активности учитывали лабораторные показатели (СРБ, СОЭ, ревматоидный фактор и др.) [1, 6]. Другой причиной таких результатов может быть особенность выборки больных для исследования (например, только госпитализированные в лечебно-профилактические учреждения больные, текущая активность заболевания большинства из которых была высокой). В нашем исследовании были использованы данные как амбулаторных, так и стационарных больных. Более чем у половины из них активность заболевания была умеренной. Следует отметить, что для оценки вклада воспалительной активности в риск возникновения переломов необходимо наблюдать больных в динамике с анализом эффективности антиревматической терапии и приверженности лечению.
Нельзя не сказать и о связи между низкими показателями МПК во всех анализируемых областях и переломами у наших больных. Как известно, характеристика костной ткани (масса, плотность, архитектоника, степень минерализации и др.) – показатель прочности кости, а остеопороз – чрезвычайно значимый ФР возникновения переломов у больных РА. Негативная роль снижения МПК неоднократно подтверждена в зарубежных исследованиях ФР переломов [1, 10, 14, 15]. Казалось бы, связь между остеопорозом и риском возникновения переломов не должна вызывать сомнений: лица с низкой костной массой подвержены большему риску переломов [16]. Тем не менее, по литературным данным, этот вопрос остается спорным [4, 8, 17] и требует дальнейшего изучения. РА является фактором, способствующим потере МПК, заболеванием, увеличивающим риск развития остеопороза (уровень доказательности А) [18].
Таким образом, нами получены и проанализированы сведения о больных РА с переломами и без таковых в анамнезе, включающие антропометрические, клинико-рентгенологические характеристики и результаты денситометрии. Представлены данные о случаях низкоэнергетических переломов в анамнезе у больных РА и предварительные результаты сравнительного анализа ФР в группах больных с переломами и без таковых. Более детальный (корреляционный и дискриминантный) последующий анализ позволит установить вклад каждого фактора и определить индивидуальный прогноз развития переломов у больных РА, разработать тактику лечебно-профилактических мероприятий.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.