Фармакокинетический подход к персонализации антигипертензивной фармакотерапии
- Аннотация
- Статья
- Ссылки
- English




Сегодня индивидуализация фармакотерапии сердечно-сосудистых заболеваний остается одной из актуальных проблем кардиологии. Инновационным направлением персонализации фармакотерапии считается фармакокинетический подход. Он позволяет определить различия в механизме действия лекарственных средств у конкретных пациентов и оптимизировать медикаментозное вмешательство с учетом таких различий [1–4]. Среди гипотензивных препаратов основных классов имеются лекарственные средства, фармакодинамический эффект которых связан с особенностями фармакокинетики, в частности генетически обусловленной скоростью биотрансформационных процессов. К таким препаратам относится представитель дигидропиридиновых блокаторов кальциевых каналов (БКК) амлодипин [5, 6]. В то же время большинство пациентов с артериальной гипертонией (АГ) нуждаются в комплексной терапии. В связи с этим представляется практически важным изучение выраженности фармакодинамических эффектов комбинированной терапии амлодипина и представителей одного из ведущих классов антигипертензивных средств – ингибиторов ангиотензинпревращающего фермента (ИАПФ) у больных АГ с различными фенотипами окислительного метаболизма.
Целью работы стала оценка влияния фенотипа окислительного метаболизма на выраженность фармакодинамического эффекта комбинированной гипотензивной терапии у больных АГ высокого и очень высокого риска.
Материал и методы исследования
В исследование было включено 120 больных АГ 2–3-й степени с высоким и очень высоким риском развития сердечно-сосудистых осложнений [7].
Критериями исключения из исследования стали:
- порок сердца, инфаркт миокарда, инсульт, стабильная стенокардия напряжения III–IV функционального класса (ФК) в период обследования или в анамнезе;
- хроническая сердечная недостаточность III–IV ФК;
- нарушения ритма и проводимости сердца, требующие антиаритмической терапии;
- симптоматическая АГ;
- хроническая бронхолегочная патология, сахарный диабет;
- сопутствующая патология, требующая постоянной медикаментозной терапии.
Основную группу составили 84 (70%) мужчины и 36 (30%) женщин в возрасте от 45 до 65 лет (средний возраст – 63 (58–64) года). Длительность АГ – 10,60 ± 2,89 года. Среди участников исследования преобладали пациенты с 3-й степенью АГ (95 (79,1%) пациентов). 2-я степень имела место у 25 (20,9%) больных. Высокий риск отмечался у 58 (48,3%) пациентов, очень высокий – у 62 (51,7%).
Тем, кто удовлетворял критериям включения в основную группу, в течение трехдневного плацебо-периода проводили клинические, лабораторные и инструментальные исследования, после чего пациенты были рандомизированы (стратификационным методом) на три группы в зависимости от схемы фармакотерапии – фиксированной и свободной комбинации ИАПФ и дигидропиридинового БКК. В скрининговом периоде при необходимости больные могли использовать каптоприл.
Для фармакологической коррекции АГ в качестве стартовых схем терапии использовали комбинации препаратов:
- первая группа: амлодипин (Нормодипин) 5–10 мг/сут + рамиприл (Амприлан) 5–10 мг/сут;
- вторая группа: амлодипин (Нормодипин) 5–10 мг/сут + лизиноприл (Диротон) 10–20 мг/сут;
- третья группа: фиксированная комбинация амлодипина и лизиноприла (Экватор) 1 таб. (5 + 10 мг)/сут – 1 таб. (10 + 20 мг)/сут.
В каждой из трех групп проводили титрование доз препаратов, критерием увеличения которых служило отсутствие достижения целевого артериального давления (АД) – менее 140/90 мм рт. ст., оцениваемого во время очередного визита пациента. Общая длительность наблюдения составила четыре недели. При оценке казуальных («офисных») значений АД исходили из существующих методических требований [7]. За исходные уровни системных гемодинамических параметров принимали показатели, зафиксированные перед началом фармакотерапии. До скринингового периода было получено информированное согласие всех пациентов на участие в исследовании.
Фенотип окислительного метаболизма определяли на основании оценки фармакокинетических параметров препарата-маркера – аминофиллина (Эуфиллина) методом высокоэффективной обращенно-фазовой жидкостной хроматографии. Верифицирующим показателем для определения фенотипа окислительного метаболизма служил период полувыведения (Т1/2) Эуфиллина. Его определяли по концентрации тест-препарата в слюне в течение суток после перорального приема с последующим расчетом фармакокинетических параметров на основании одночастевой кинетической модели с учетом всасывания первого порядка. Дозу Эуфиллина рассчитывали в соответствии с весом пациента: 45–60 кг – 150 мг препарата, 60–75 кг – 300 мг, 75–90 кг – 450 мг. Первую биопробу брали через три часа после приема препарата, вторую – через пять часов, третью – через семь часов, четвертую – через десять часов, пятую – через 12 часов, шестую – через 24 часа. Пробы хранили в морозильной камере до предварительной подготовки. Последняя заключалась в следующем. Пробы слюны центрифугировали при 1500 об/мин в течение 10–15 минут. Затем к надосадочной жидкости добавляли равное количество осадительной смеси (0,1%-ная серная кислота в этаноле). Встряхивали в течение одной минуты. Далее центрифугировали при 6000 об/мин в течение 40 минут. Супернатант отбирали и хранили в холодильнике до количественного определения. Фенотип окислительного метаболизма оценивали по граничным уровням периода полуэлиминации тест-препарата (Т1/2): менее девяти часов – быстрый фенотип окислительного метаболизма, от девяти до 15 часов – медленный фенотип, более 15 часов – очень медленный [4, 8–10]. Фармакокинетические исследования были выполнены с использованием хроматографа «Милихром».
Статистическую обработку данных проводили с помощью программы Statistica 8.0. Предварительно оценивали принадлежность совокупностей данных к нормальному распределению. При нормальном распределении изучаемые параметры описывали исходя из их среднего значения (М) и стандартного отклонения (SD). При распределении значений показателей, отличных от нормального, их описывали с помощью медианы (Ме) и межквартильного интервала (нижний квартиль – 25%, верхний – 75%). Количественные показатели оценивали по t-критерию (критерий Стьюдента) для независимых и зависимых переменных. При распределении переменных, значения которых отличались от нормального, достоверность различий оценивали непараметрическими методами Вилкоксона и Манна – Уитни (для зависимых и независимых переменных соответственно). Статистически значимыми считали различия при значениях двустороннего р < 0,05. Для устранения ошибочных оценок наличия достоверности различий параметров при множественном сравнении подгрупп применяли поправку Бонферрони. При сравнении дискретных величин в системе четырехпольных таблиц с помощью критерия χ2 последний оценивали с коррекцией на непрерывность по Йетсу. При наличии в одном из полей таблицы 2 × 2 значения признака менее 5 применяли точный критерий Фишера [11, 12].
При оценке степени взаимосвязи между различными параметрами использовали коэффициент корреляции Пирсона.
Значение влияния различных факторов на исследуемые показатели оценивали на основании дисперсионного анализа. При определении степени детерминированности вариации критериальной (зависимой) переменной предикторами (независимыми переменными) и прогнозировании значения зависимой переменной с помощью независимых использовали регрессионный анализ.
Результаты исследования
Возможность проведения анализа влияния генетически детерминированной скорости окислительного метаболизма на степень гипотензивного эффекта применяемых в работе лекарственных препаратов была обусловлена их фармакокинетическими характеристиками. Единственным из используемых лекарственных веществ, фармакодинамический эффект которых зависел от скорости окислительного метаболизма, определяемого по тест-препарату, был амлодипин [5, 6]. Фармакокинетика остальных препаратов не зависела от генетически детерминированного полиморфизма скорости окислительных процессов [13, 14].
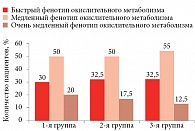
Другим фактором, определяющим возможность проведения указанного анализа, послужило полимодальное распределение пациентов по фенотипам окислительного метаболизма в каждой исследуемой группе (рис. 1).
Данные (представленные в модульных значениях) о степени снижения АД в исследуемых фенотипических группах больных, получавших различные варианты комбинированной фармакотерапии, отражены в табл. 1.
Степень снижения АД у больных первой группы с медленным и очень медленным фенотипом окислительного метаболизма была достоверно больше, чем у пациентов с быстрым вариантом окислительного процесса. Первые две фенотипические группы также значимо различались по уровню снижения систолического АД (САД). По величине снижения диастолического АД (ДАД) существенных различий между медленными и очень медленными фенотипами окислительного метаболизма не выявлено. Статистический анализ, оценивающий выраженность степени снижения АД в фенотипических группах больных, получавших в качестве стартовой терапии свободную комбинацию амлодипина и лизиноприла, выявил зависимость, аналогичную той, которая наблюдалась у больных первой группы. В третьей группе пациенты с медленным и очень медленным фенотипом окислительного метаболизма были идентичны (p > 0,05) по уровню снижения АД при четырехнедельной терапии Экватором и существенно превосходили по указанному эффекту лиц с высокой скоростью окислительного процесса.
Сравнение степени снижения АД у больных разных групп с одинаковой скоростью биотрансформационных процессов показало достоверное (p < 0,001 для САД и p < 0,01 для ДАД) превалирование выраженности гипотензивного эффекта у пациентов с медленным фенотипом окислительного метаболизма из третьей группы по сравнению с аналогичной когортой лиц первой и второй групп.
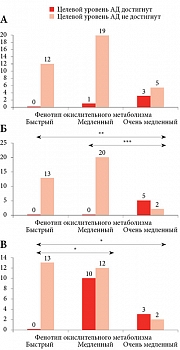
Анализ количества больных, достигших целевого АД, выявил тенденцию (р > 0,05) к увеличению среди пациентов с низкой и очень низкой скоростью окислительной биотрансформации лекарственных средств в первой группе (рис. 2). Во второй группе зарегистрировано достоверное преобладание больных с целевым уровнем АД среди лиц с очень низкой скоростью окислительного метаболизма. В третьей группе пациентов с медленным и очень медленным фенотипом окислительного метаболизма зафиксировано достоверно больше, чем пациентов с быстрым фенотипом.
Градации скорости окислительного метаболизма, рассматриваемые как детерминирующий фактор при проведении дисперсионного анализа, достоверно влияли на степень снижения САД и ДАД (F = 18,7, p < 0,001; F = 9,89, p < 0,001 соответственно) как в первой, так и во второй (F = 46,1, p < 0,001; F = 14,1, p < 0,001 соответственно) и третьей группах (F = 39,9, p < 0,001; F = 33,0, p < 0,001 соответственно).
Корреляционный анализ, оценивающий взаимосвязь Т1/2 тест-препарата и степени антигипертензивного эффекта терапии у больных первой группы, установил достоверное влияние исследуемого параметра на Δ%САД и Δ%ДАД (r = 0,59, p < 0,001; r = 0,58, p < 0,001 соответственно). Аналогичная взаимосвязь имела место как во второй (r = 0,83, p < 0,001; r = 0,60, p < 0,001 соответственно), так и в третьей группе (r = 0,55, p < 0,001; r = 0,64, p < 0,001 соответственно).
Следующий этап исследования предполагал проведение регрессионного анализа. Его основной задачей было построение регрессионных уравнений, позволяющих со значительной долей вероятности прогнозировать выраженность гипотензивного эффекта при использовании в качестве стартовой второй ступени терапии, основанной на свободной или фиксированной комбинации амлодипина с лизиноприлом или рамиприлом. При этом зависимым параметром служила степень снижения САД и ДАД, независимыми – период полувыведения тест-препарата и исходные значения АД. Выбор параметров для регрессионного анализа был обусловлен достоверной корреляционной зависимостью между фармакокинетическими и гемодинамическими показателями. Кроме указанных корреляционных связей Т1/2 и Δ%АД последний параметр был детерминирован исходным уровнем. При оценке четырехнедельной терапии пациентов первой группы значение Δ%САД достоверно коррелировало с исходным уровнем САД (r = 0,32, p < 0,05), Δ%ДАД – с исходным уровнем ДАД (r = 0,63, p < 0,001). Во второй группе исходные уровни САД и ДАД также были значимо связаны с величиной их снижения в процессе лечения (r = 0,41, p < 0,01; r = 0,54, p < 0,001 соответственно). Исходный уровень САД у больных третьей группы не имел значимой связи с Δ%САД (r = 0,055, p > 0,05), в то время как исходные значения ДАД достоверно коррелировали с величиной их снижения (r = 0,45, p < 0,01) при фармакотерапии.
Показатели регрессионного анализа, проведенного в первой группе пациентов, характеризующие выраженность линейной связи между зависимыми (Δ%САД, Δ%ДАД) и независимыми (Т1/2, исходные уровни САД и ДАД) переменными, свидетельствовали о ее достоверности (табл. 2).
Уравнения регрессии, позволяющие рассчитать прогнозируемый гипотензивный эффект четырехнедельной терапии амлодипином и рамиприлом, имели следующий вид:
Δ%САД = -57,9 + 0,995 × Т1/2 + 0,318 × САДисх;
Δ%ДАД = -64,5 + 0,758 × Т1/2 + 0,611 × ДАДисх.
Все бета-коэффициенты уравнений были высоко значимыми (p < 0,001). Коэффициент детерминации объяснял более 60% вариаций зависимой переменной.
Параметры регрессионного анализа, проведенного в третьей группе пациентов, были статистически значимы (табл. 3).
Расчетные уравнения регрессии для пациентов второй группы:
Δ%САД = -62,9 + 1,032 × Т1/2 + 0,352 × САДисх;
Δ%ДАД = -83,8 + 0,967 × Т1/2 + 0,775 × ДАДисх.
Коэффициент детерминации объяснял вариации зависимой переменной не менее чем у 3/4 пациентов второй группы. Все бета-коэффициенты уравнений были статистически достоверны (p < 0,001).
Показатели регрессионного анализа, проведенного в третьей группе, оценивающие связь между исследуемыми зависимыми и независимыми переменными, были статистически значимы (табл. 4).
Для расчета прогнозируемого гипотензивного эффекта (для САД) от четырехнедельной терапии Экватором использовалось следующее уравнение регрессии:
Δ%САД= -37,4 + 1,149 × Т1/2 + 0,247 × САДисх.
Свободный член уравнения и бета-коэффициент САДисх были статистически незначимы. Однако исключение исходных значений САД из параметров регрессионного уравнения приводило к ухудшению последних, в связи с чем данный показатель был оставлен в перечне независимых параметров регрессионного уравнения. Построенное уравнение не характеризовалось высокой степенью охвата вариации Δ%САД, но при этом было достоверным.
Уравнение регрессии для оценки степени снижения ДАД:
Δ%ДАД= -78,7 + 1,398 × Т1/2 + 0,741 × ДАДисх.
Коэффициент детерминации данного уравнения объяснял вариации зависимой переменной более чем у половины пациентов третьей группы. Все бета-коэффициенты уравнений являлись высоко значимыми (p < 0,001).
Обсуждение результатов
В настоящее время индивидуализация фармакотерапии заболеваний системы кровообращения строится в основном на фармакодинамических и фармакогенетических подходах [2, 3, 15, 16]. Фармакогенетические наиболее перспективные, но технически более сложные. Оценка полиморфизма окислительного метаболизма на основе изучения фармакокинетики препарата-маркера с практической точки зрения является одним из оптимальных путей персонализации фармакотерапии [4, 17, 18]. Использование данного метода в представленной работе позволило выявить в исследуемых группах тримодальное распределение пациентов по скорости биотрансформации тест-препарата. Частотное распределение фенотипических вариантов окислительного метаболизма в исследуемых группах несколько отличалось от такового в европеоидной популяции [4, 8, 19]. В группах доминировали пациенты с медленным фенотипом окислительного метаболизма, что скорее всего было обусловлено небольшим числом включенных в каждую группу больных. Последний факт не препятствовал проведению сопоставительного анализа «фенотип окислительного метаболизма – гипотензивный эффект».
Фармакокинетика использованных препаратов позволяла предположить зависимость степени снижения АД от скорости окислительной биотрансформации лекарственного средства – амлодипина. Метаболизм ИАПФ не зависел от указанного процесса [13, 14].
Проведенные расчеты подтвердили наличие прямо пропорциональной зависимости степени снижения АД от фенотипа окислительного метаболизма. Последний как факторная детерминанта достоверно влиял на выраженность гипотензивного эффекта каждого из трех вариантов второй ступени терапии больных АГ. При этом у пациентов с медленным фенотипом окислительного метаболизма фиксированная комбинация амлодипина и лизиноприла (Экватор) оказывала достоверно более выраженный антигипертензивный эффект по сравнению со свободным сочетанием использованных препаратов.
Полученные результаты по рассматриваемой проблеме концептуально совпадают с данными литературы. Так, post-hoc-анализ, выполненный у 38 462 участников исследования ALLHAT, показал различие фармакодинамических эффектов амлодипина и хлорталидона, ассоциированных с определенными аллельными вариантами гена NPPA T2238C [20].
Особенности фармакокинетики гипотензивных средств – не единственные факторы, обусловливающие величину антигипертензивного эффекта. Именно поэтому построение моделей прогнозирования степени снижения АД должно учитывать множественность детерминант. Среди них определенное место занимают исходные значения гемодинамических параметров. Проведенный в работе корреляционный анализ позволил определить начальные уровни АД наряду с Т1/2 препарата-маркера как факторы, которые могут использоваться в регрессионных уравнениях, с целью определения гипотетической степени снижения АД под влиянием той или иной схемы стартовой терапии больных АГ. Приведение показателя точности прогноза (по вариативной составляющей) степени снижения АД к среднему значению по всем трем вариантам стартовой фармакотерапии характеризует достаточно высокий процент – 61,7% – выборки пациентов с АГ высокого и очень высокого риска, у которых будут совпадать теоретические и фактические значения Δ%АД.
Таким образом, проведенный анализ продемонстрировал зависимость степени снижения АД от фенотипического варианта окислительного метаболизма у больных АГ на фоне применения схем второй ступени гипотензивной терапии с включением амлодипина и лизиноприла или рамиприла. Данный факт позволяет проводить индивидуализированный выбор стартового варианта фармакотерапии. Использование регрессионных уравнений может служить основой для повышения степени персонализации антигипертензивной терапии, основанной на комбинации амлодипина и ИАПФ.
S.A. Gridina, T.M. Grigoryeva, S.V. Povetkin, N.G. Filippenko
Kursk State Medical University
Contact person: Sergey Vladimirovich Povetkin, psv46@kursknet.ru
The current study was aimed at assessing an impact of oxidative phenotype on intensity of pharmacodynamics effect after applying a combination anti-hypertensive therapy in patients with high- and very high-risk arterial hypertension. It was confirmed that the level of decrease arterial pressure directly correlated with oxidative phenotype. Upon that, patients with slow oxidative phenotype administered with a fixed- vs. free-combination of amlodipine and lisinopril (Equator) exhibited significantly more pronounced anti-hypertensive effect.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.