К вопросу о вакцинопрофилактике COVID-19 у пациентов с иммуновоспалительными ревматическими заболеваниями
- Аннотация
- Статья
- Ссылки
- English
Оценивали безопасность различных вакцин против COVID-19 у 372 пациентов с ИВРЗ и 170 лиц без ИВРЗ. Все участники опрошены врачом-исследователем с заполнением унифицированной анкеты. Дополнительную информацию получали из медицинской документации.
После иммунизации первым компонентом вакцин нежелательные явления (НЯ) отсутствовали как у пациентов с ИВРЗ, так и у здоровых лиц (49,5 и 32,4% соответственно; p < 0,001).
После введения второго компонента вакцин часть пациентов с ИВРЗ, у которых не было отмечено ни одного НЯ, также оказалась значимо больше при сопоставлении со здоровой популяцией
(59,0 и 46,3%; p = 0,009). Серьезных НЯ после введения второго компонента не зарегистрировано.
После полной иммунизации у больных ИВРЗ значимо чаще отсутствовали какие-либо НЯ по сравнению со здоровым контролем (40,3 и 21,0%; p < 0,001). Обострения ИВРЗ и возникновения новых аутоиммунных феноменов после вакцинации двумя компонентами вакцин не отмечено.
Согласно полученным данным, применение вакцин против COVID-19 при ИВРЗ представляется в достаточной степени безопасным.
Оценивали безопасность различных вакцин против COVID-19 у 372 пациентов с ИВРЗ и 170 лиц без ИВРЗ. Все участники опрошены врачом-исследователем с заполнением унифицированной анкеты. Дополнительную информацию получали из медицинской документации.
После иммунизации первым компонентом вакцин нежелательные явления (НЯ) отсутствовали как у пациентов с ИВРЗ, так и у здоровых лиц (49,5 и 32,4% соответственно; p < 0,001).
После введения второго компонента вакцин часть пациентов с ИВРЗ, у которых не было отмечено ни одного НЯ, также оказалась значимо больше при сопоставлении со здоровой популяцией
(59,0 и 46,3%; p = 0,009). Серьезных НЯ после введения второго компонента не зарегистрировано.
После полной иммунизации у больных ИВРЗ значимо чаще отсутствовали какие-либо НЯ по сравнению со здоровым контролем (40,3 и 21,0%; p < 0,001). Обострения ИВРЗ и возникновения новых аутоиммунных феноменов после вакцинации двумя компонентами вакцин не отмечено.
Согласно полученным данным, применение вакцин против COVID-19 при ИВРЗ представляется в достаточной степени безопасным.

Введение
В настоящее время проблема COVID-19 не теряет своей актуальности. На начало ноября 2022 г. в мире насчитывалось более 630 млн подтвержденных случаев заболевания и более чем 6,5 млн летальных исходов, из них в России – более 21,4 млн и 390 тыс. соответственно [1].
У лиц с иммуновоспалительными ревматическими заболеваниями (ИВРЗ) частота развития любых инфекций повышена из-за отрицательного воздействия на иммунную систему как самой болезни, так и иммуносупрессивных препаратов, поэтому COVID-19 может представлять серьезную опасность для этой когорты [2]. Согласно результатам двух метаанализов, при ИВРЗ более высокая частота инфицирования SARS-CoV-2, а также нарастающий риск госпитализации и летального исхода в результате развития COVID-19 [3, 4].
Наиболее эффективным методом профилактики и предотвращения тяжелого течения инфекционных заболеваний является вакцинация. Так, в рекомендациях Европейского альянса ревматологических ассоциаций подчеркивается необходимость вакцинации против гриппа и пневмококковой инфекции практически всех пациентов с ИВРЗ [5], что также актуально в условиях текущей пандемии.
В настоящее время эксперты Всемирной организации здравоохранения одобрили к использованию 11 вакцин против COVID-19 [6]. Однако данные об их безопасности, эффективности и иммуногенности у лиц с ИВРЗ нередко противоречивы. Эти пациенты не были включены в протоколы клинических исследований, что существенно затрудняет интерпретацию разрозненных данных о вышеперечисленных проблемах в отношении применяемых вакцин и отчасти препятствует широкому их внедрению в реальную клиническую практику. Например, факт приема глюкокортикоидов (ГК) в течение 30 дней или какой-либо иной иммуносупрессивной терапии в течение трех месяцев до предполагаемой вакцинации был критерием невключения в фазу III испытаний эффективности и безопасности вакцины Гам-КОВИД-Вак (Спутник V) [7], которая в настоящее время наиболее широко применяется в Российской Федерации.
Безопасность применения вакцин против COVID-19 у пациентов с ИВРЗ заключается в минимальном риске развития или полном отсутствии обострения заболевания или формирования новых аутоиммунных феноменов. Немаловажным также представляется изучение и выявление факторов риска развития иных нежелательных явлений (НЯ). С учетом недостаточного количества данных по этой проблеме применительно к вакцинам, зарегистрированным на территории России, изучение их безопасности у пациентов с ИВРЗ является актуальным.
Цель исследования
Целью настоящей работы стала оценка безопасности применения вакцин против COVID-19 у пациентов с ИВРЗ.
Материал и методы
Выборка была сформирована путем последовательного сплошного включения пациентов, поступивших на стационарное лечение (n = 304, 81,7%) или обратившихся в консультативно-диагностический центр (n = 68, 18,3%) ФГБНУ «НИИР им. В.А. Насоновой». В контрольную группу вошли 170 лиц без каких-либо ИВРЗ.
Работа одобрена локальным этическим комитетом ФГБНУ «НИИР им. В.А. Насоновой».
После подписания добровольного информированного согласия все участники были опрошены врачом-исследователем с заполнением унифицированной анкеты. Дополнительную информацию получали из медицинской документации.
Статистическая обработка данных проведена с использованием прикладного пакета программ Statistica 11.0 (StatSoft, США) и SPSS Statistics 27 (IBM, США).
Различия считали значимыми при p < 0,05.
Результаты
В исследование включены 372 пациента, среди них 290 женщин и 82 мужчины. Средний возраст участников – 49,6 ± 15,2 года. Они страдали различными ИВРЗ, в том числе ревматоидным артритом (РА) (n = 209), анкилозирующим спондилитом (n = 47), псориатическим артритом (n = 22), болезнью Шегрена (n = 21), недифференцированным спондилоартритом (n = 19), системной красной волчанкой (n = 17), системными васкулитами (n = 8), подагрой (n = 7), системной склеродермией (n = 6), болезнью Стилла взрослых (n = 5), IgG4-ассоциированным заболеванием (n = 3), а также ревматической полимиалгией, системным заболеванием соединительной ткани (СЗСТ), болезнью депонирования пирофосфатом кальция и overlap-синдромом (n = 2 на каждую патологию). Средняя длительность заболевания – 10,8 ± 9,3 года.
Большинство пациентов принимали базисные противовоспалительные препараты (БПВП): 127 – метотрексат (МТ), 46 – лефлуномид, 41 – гидроксихлорохин, 27 – сульфасалазин, 10 – микофенолата мофетил, 4 – азатиоприн, 1 – циклофосфамид. 127 пациентов получали генно-инженерные биологические препараты (ГИБП): 91 – ритуксимаб (РТМ), 22 – ингибиторы фактора некроза опухоли α (иФНО-α), 5 – абатацепт, по 3 – ингибиторы интерлейкина 17А и тоцилизумаб, 2 – тофацитиниб, 1 – белимумаб. Системная терапия ГК осуществлялась у 143 пациентов. 30 больных находились на монотерапии нестероидными противовоспалительными препаратами (НПВП). Лечение не проводилось у 45 пациентов.
Контрольную группу составили 170 испытуемых без каких-либо ИВРЗ, из них 121 женщина и 49 мужчин. Средний возраст – 38,0 ± 14,6 года.
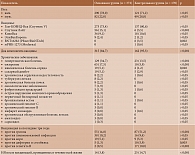
Все участники исследования получили как минимум одну дозу вакцины против COVID-19, две дозы вакцины – 315 пациентов в основной группе, 162 в контрольной группе (табл. 1).
Как видно из таблицы 1, среди коморбидной патологии у лиц с ИВРЗ по сравнению с лицами без ИВРЗ значимо чаще встречались гипертоническая болезнь, ожирение и ишемическая болезнь сердца, что можно объяснить более молодым возрастом вторых, повышенным риском развития сердечно-сосудистых заболеваний на фоне ИВРЗ, а также влиянием проводимой иммуносупрессивной терапии. Испытуемые контрольной группы были значимо чаще вакцинированы против гриппа, дифтерии и столбняка, гепатита В, чем испытуемые основной группы. Охват вакцинацией против пневмококковой инфекции и кори в обеих группах достоверно не различался. Согласно данным анамнеза, развитие каких-либо НЯ после иммунизации указанными вакцинами значимо реже наблюдалось у пациентов с ИВРЗ.
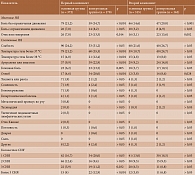
После введения первого компонента вакцин местные и системные НЯ встречались в обеих группах, однако боль в месте инъекции без ограничения движения конечности, отек или гиперемия, слабость, лихорадка (в том числе выше 38 °С), артралгии или миалгии и озноб реже регистрировались у пациентов с ИВРЗ (табл. 2). Доля пациентов с тремя и более системными НЯ (СНЯ) в основной группе была значимо меньше, чем в контрольной группе. Только местные НЯ зарегистрированы у 11,6 и 14,1% соответственно, системные – у 20,4 и 18,8% соответственно. Однако эти различия были статистически незначимыми. Количество пациентов с ИВРЗ, у которых зарегистрировано развитие местных и системных НЯ, был значимо меньше, чем количество лиц без ИВРЗ, – 18,5 и 34,7% (p < 0,001). Какие-либо НЯ отсутствовали у 49,5% пациентов с ИВРЗ и у 32,4% лиц без ИВРЗ после вакцинации первым компонентом (p < 0,001).
У двух пациенток 44 и 52 лет c РА после вакцинации Спутником Лайт развился отек Квинке, который разрешился без последствий в результате применения эпинефрина внутримышечно и преднизолона внутривенно.
У пациента 43 лет с болезнью Стилла взрослых в стойкой безмедикаментозной ремиссии в течение 20 лет через 12 дней после вакцинации Спутником Лайт отмечены лихорадка до 40 °С, боль в горле, артралгии, миалгии, артрит левого локтевого сустава, снижение массы тела на 10 кг за один месяц. При обследовании по месту жительства выявлены лейкоцитоз – до 21 × 109/л, скорость оседания эритроцитов (СОЭ) – 95 мм/ч, уровень С-реактивного белка (СРБ) – 200 мг/л, ферритина – 3500 мкг/л. На фоне приема НПВП, преднизолона в дозе 90 мг внутривенно произошел частичный регресс указанных проявлений с рецидивом на следующий день. Через два месяца после вакцинации госпитализирован в ФГБНУ «НИИР им. В.А. Насоновой». При обследовании обнаружены субфебрилитет, артриты локтевых суставов, лейкоцитоз – до 15 × 109/л, тромбоцитоз – до 440 × 109/л, гипохромная нормоцитарная анемия легкой степени, СОЭ – 140 мм/ч, уровень СРБ – 103 мг/л, ферритина – 2760 мкг/л. Констатировано также обострение болезни Стилла взрослых. На фоне терапии дексаметазоном в дозе 12 мг внутривенно капельно, метилпреднизолоном в дозе 36 мг/сут наблюдались нормализация температуры, купирование боли в горле, артритов, снижение лабораторных признаков активности заболевания, инициирована терапия МТ в дозе 10 мг подкожно с постепенным повышением до 20 мг/нед на амбулаторном этапе. Через шесть месяцев после выписки из стационара зафиксирована клинико-лабораторная медикаментозная ремиссия заболевания. В настоящее время пациент получает метилпреднизолон в дозе 4 мг/сут и МТ в дозе 15 мг/нед.
Один (2,9%) пациент, иммунизированный первым компонентом КовиВака, и 6 (10,7%) больных, иммунизированных Спутником Лайт, сообщили о предполагаемом обострении ИВРЗ в виде появления или нарастания артралгий или слабости. С учетом отсутствия длительной утренней скованности, припухлости суставов, увеличения уровня маркеров системного воспаления, а также с учетом регресса симптоматики без дополнительных лечебных мероприятий предположение об истинном обострении ИВРЗ было отвергнуто во всех случаях, клиническая картина расценена как поствакцинальная реакция.
После введения второго компонента вакцин в основной группе значимо реже встречались такие местные НЯ, как боль без ограничения движения конечности и отек или гиперемия. Для СНЯ различия получены только в отношении частоты развития озноба. Между основной и контрольной группами не отмечено достоверной разницы в отношении количества пациентов с тремя и более СНЯ. Возникновение только местных НЯ зафиксировано у 8,3% пациентов с ИВРЗ и 12,3% лиц без ИВРЗ, системных НЯ – у 21,0 и 14,2% соответственно. При этом различия были статистически незначимыми. При сравнении основной и контрольной групп в отношении количества пациентов, у которых после иммунизации вторым компонентом вакцин зафиксированы как местные, так и системные НЯ, было отмечено преимущество первой – 11,7 и 27,2% (p < 0,001). Кроме того, число пациентов с ИВРЗ, у которых не было отмечено ни одного НЯ, было больше – 59,0 и 46,3% соответственно (p = 0,009). Серьезных НЯ после введения второго компонента не зарегистрировано.
После полной иммунизации какие-либо НЯ отсутствовали у 40,3% пациентов с ИВРЗ и у 21,0% лиц без ИВРЗ (p < 0,001).
Сочетание местных и системных НЯ зарегистрировано в обеих группах, однако достоверно реже оно наблюдалось в основной группе – 9,2 и 19,1% соответственно (p = 0,002).
Развития новых аутоиммунных феноменов после иммунизации двумя компонентами вакцин не отмечено.
У пациентки 55 лет с РА при длительной отмене МТ в связи с вакцинацией повысилась активность основного заболевания (боли в мелких суставах кистей, утренняя скованность продолжительностью до одного часа) через две недели после введения первого компонента КовиВака. После введения второго компонента появилась припухлость мелких суставов кистей, увеличилась до двух часов утренняя скованность. При обследовании обнаружено повышение маркеров системного воспаления: СОЭ – до 60 мм/ч, уровень СРБ – до 10 мг/л. Указанные проявления расценены как обострение заболевания вследствие неадекватно длительной отмены МТ до и после иммунизации (суммарно шесть недель), что является совершенно неприемлемым. Купирование обострения отмечено после возобновления иммуносупрессивной терапии.
В то же время 20 (7,3%) пациентов, получивших два компонента Спутника V, сообщили об ухудшении состояния после вакцинации в виде развития артралгий и слабости, однако длительной утренней скованности, припухлости суставов и увеличения маркеров системного воспаления не обнаружено, в связи с чем предположение об истинном обострении ИВРЗ отвергнуто во всех случаях, клиническая картина расценена как поствакцинальная реакция.
У пациентов с ИВРЗ, которые были вакцинированы Спутником V (n = 222), установлены факторы риска развития одного или более местного и системного НЯ (табл. 3).
Оказалось, что единственным фактором риска развития указанного сочетания НЯ после введения первого и второго компонентов, а также после полной иммунизации является женский пол. Прием МТ значимо сопряжен с возникновением местных и системных нежелательных явлений после вакцинации первым компонентом, однако такой связи не зафиксировано после иммунизации вторым компонентом и полной вакцинации. Аналогичные данные получены в отношении РТМ, применение которого увеличивало риск развития НЯ после второго, но не после первого компонента вакцины, а также после полной вакцинации.
У пациентов с длительностью ИВРЗ более десяти лет отмечен значимо более низкий риск развития местных и системных НЯ после иммунизации первым компонентом вакцины и полной вакцинации. Данная клиническая характеристика не оказывала значимого влияния на частоту развития указанных НЯ после введения второй дозы вакцины. Кроме того, у пациентов с воспалительными заболеваниями суставов (ВЗС) риск возникновения упомянутой выше комбинации НЯ был значимо меньше после введения первой дозы вакцины. После вакцинации вторым или двумя компонентами наличие указанной нозологии не ассоциировалось с меньшей частотой развития этих НЯ. Безусловно, полученные данные требуют подтверждения на более крупных выборках пациентов с ИВРЗ.
Обсуждение результатов
Результаты исследования свидетельствуют об удовлетворительной переносимости вакцин против COVID-19 и относительно низкой частоте развития НЯ, что также демонстрируется в некоторых зарубежных работах. Так, согласно данным реестра Глобального ревматологического альянса, в который было включено 2860 пациентов с ИВРЗ, у 1371 (47,9%) после вакцинации зарегистрировано как минимум одно НЯ длительностью не менее двух дней. При этом наиболее частыми были слабость или сонливость – 33,4%, головная боль – 27,7%, артралгии или миалгии – 22,8%, озноб – 19,9%. Значимых различий по частоте НЯ в зависимости от применяемых вакцин не получено [8]. В исследовании S. Cherian и соавт., в котором сравнивалась безопасность вакцин у пациентов с ИВРЗ (n = 513) и лиц контрольной группы (n = 211), наиболее распространенными НЯ были локальная боль (25 и 24,2% соответственно), лихорадка (18,3 и 19,9%), утомляемость (17,9 и 17,0%), головная боль (13,8 и 11,4%), миалгии (9,6 и 12,3%), озноб (2,7 и 1,9% соответственно) [9]. Статистически значимых различий между двумя группами, а также по частоте НЯ в зависимости от вакцины не выявлено. Опубликованы единичные работы по оценке безопасности вакцин у пациентов с ИВРЗ, зарегистрированных в России. Согласно данным аргентинского национального мультицентрового регистра, в который были включены вакцинированные против COVID-19 пациенты с ИВРЗ, после иммунизации первым компонентом Спутника V (n = 631) местные НЯ зарегистрированы у 8%, гриппоподобный синдром – у 11%, а после второго компонента (n = 193) – у 3 и 5% соответственно [10]. В другое исследование, проведенное Н.М. Булановым и соавт., было включено 157 пациентов с ИВРЗ и 168 испытуемых без каких-либо ревматических заболеваний [11]. Установлено, что в основной группе НЯ значимо реже встречались после введения первого компонента (72,0 и 82,7% соответственно; p = 0,024) и после полной вакцинации (78,3 и 89,3% соответственно; p = 0,01). За исключением боли в месте инъекции после иммунизации первым компонентом (p = 0,023) значимых различий в отношении частоты развития НЯ в двух группах не выявлено.
Согласно полученным данным, факторами риска развития НЯ являются женский пол, а также, возможно, терапия МТ или РТМ. Наличие ВЗС, длительность ИВРЗ более десяти лет или возраст старше 60 лет ассоциировались со снижением риска развития НЯ. Подобные результаты были продемонстрированы в работе L. Boekel и соавт. Так, женский пол и возраст менее 55 лет были независимым образом связаны с увеличенным риском развития НЯ в целом, в том числе системных, а также НЯ средней и тяжелой степени [12]. Согласно данным, представленным С. Rotondo и соавт., риск развития НЯ у пожилых пациентов был значимо ниже после введения как первого (отношение шансов (ОШ) 0,95 при 95%-ном доверительном интервале (ДИ) 0,92–0,97; p = 0,001), так и второго компонента вакцины (ОШ 0,95 (95% ДИ 0,92–0,99); p = 0,012) [13]. В то же время исследователи выявили статистически значимо меньшую частоту НЯ у пациентов с неактивной фазой болезни (29%) по сравнению с лицами с низкой (57%) или умеренной/высокой (63%) фазой активности заболевания (p = 0,002 и p = 0,006 соответственно). В другом исследовании было показано, что конституциональные симптомы достоверно чаще выявлялись у пациентов с РА (p = 0,029), которые получали иФНО-α (p = 0,01) или МТ (p = 0,033) [14].
В нашем исследовании ассоциированное с вакцинацией обострение ИВРЗ зарегистрировано у 1 (0,27%) пациента, что согласуется с данными литературы. Так, сообщается о низкой частоте ухудшения течения ИВРЗ [9, 15]. В то же время в уже упомянутой выше работе по изучению безопасности Гам-КОВИД-Вак указано, что 16,5% пациентов сообщили об обострении ИВРЗ после вакцинации [11]. Согласно данным санкт-петербургского регистра, из 2134 ревматологических пациентов, которые были вакцинированы против COVID-19, об обострении основного заболевания сообщили 12%. Однако при осмотре врачом-ревматологом появившаяся симптоматика расценена как обострение только в 1,57% случаев, остальные случаи классифицированы как поствакцинальные реакции, которые разрешались в течение одной-двух недель [16].
Согласно обзору отечественной литературы, частота обострений ИВРЗ после вакцинации против COVID-19, по-видимому, является достаточно низкой (5–7%) и не имеет достоверных связей с проводимой иммуносупрессивной терапией или определенной вакциной [17].
Установить достоверную связь между вакцинацией и обострением ИВРЗ достаточно непросто, поскольку проявления поствакцинальных реакций и активности заболевания схожи (артралгии, миалгии, слабость, лихорадка). Решение об обострении или возрастании активности ИВРЗ может и должен принимать только врач-ревматолог с учетом данных анамнеза, объективного осмотра и лабораторных исследований (воспалительные и иммунологические маркеры).
Истинное ухудшение течения ИВРЗ следует заподозрить только в случае длительного (более четырех – шести недель) персистирования симптомов, отсутствия эффекта от симптоматического лечения (НПВП, антигистаминные препараты) и особенно в случае оправданного усиления иммуносупрессивной терапии, что в свою очередь требует комплексного обследования пациентов с использованием мультисистемного подхода и длительного поствакцинального периода наблюдения.
Даже с учетом минимальной вероятности обострения ИВРЗ на фоне иммунизации подавляющее большинство таких пациентов необходимо вакцинировать против COVID-19, поскольку снижение риска инфицирования SARS-CoV-2 и тяжелого течения инфекции существенно превосходит потенциальный риск развития серьезных НЯ и обострения болезни. В настоящее время эта позиция полностью соответствует мнению ведущих экспертов международных и национальных ревматологических сообществ, включая Ассоциацию ревматологов России, что отражено в действующих рекомендациях [18].
Следует подчеркнуть, что, согласно указанным выше рекомендациям, возможна временная отмена некоторых иммуносупрессивных препаратов во время вакцинации против COVID-19 с целью повышения уровней постиммунизационного ответа. Однако указанные положения, основанные на мнении экспертов, большей частью экстраполированы из работ по оценке других вакцин (в частности, пневмококковой) и окончательно пока не подтверждены в сравнительных исследованиях. Необходимо также иметь в виду, что эти положения носят рекомендательный характер, поэтому не требуют строгого соблюдения во всех без исключения случаях. Безусловно, разнообразие клинических вариантов течения ИВРЗ (равно как и других заболеваний) невозможно полностью уложить в жесткие рамки какой-либо схемы. Решение о временном прекращении приема БПВП или ГИБП следует принимать в каждой ситуации индивидуально с учетом состояния больного и активности заболевания, поскольку неоправданная отмена препарата во время вакцинации чревата обострением ИВРЗ, как было показано выше. Данное обстоятельство также может способствовать низкой приверженности пациентов вакцинации в дальнейшем.
Заключение
Согласно полученным данным, вакцинация пациентов с ИВРЗ против COVID-19 является достаточно безопасной. Возникновения новых аутоиммунных феноменов не отмечено ни у одного больного. Обострение заболевания зарегистрировано только в одном случае. В соответствии с предварительными данными, фактором риска более частого развития местных и системных НЯ является женский пол. Не исключена в этом и роль терапии МТ или РТМ, что, безусловно, требует уточнения на более крупной выборке пациентов. Необходимо проведение дальнейших исследований для оценки эффективности и иммуногенности применяемых вакцин против COVID-19 у пациентов с ИВРЗ.
Конфликт интересов
Исследование выполнено в рамках темы ФГБНУ «Научно-исследовательский институт ревматологии им. В.А. Насоновой», № государственного задания 1021051503137-7. Конфликт интересов отсутствует.
Финансирование
Исследование не имело спонсорской поддержки.
A.N. Kulikov, N.V. Muravyeva, PhD, B.S. Belov, MD, PhD, S.I. Glukhova, PhD
V.A. Nasonova Research Institute of Rheumatology
Contact person: Boris S. Belov, belovbor@yandex.ru
Patients with immunoinflammatory rheumatic diseases (IRD) are at high risk of SARS-CoV-2 infection and severe COVID-19, for which vaccination may be an effective method of prevention, but its use may theoretically be associated with an exacerbation of IRD or the development of new autoimmune disorders.
The safety of various vaccines against COVID-19 was assessed in 372 patients with IRD and 170 healthy controls. All participants were interviewed by the research physician using a unified questionnaire. Additional information was obtained from medical records.
There were no adverse events (AEs) after immunization with the first component of the vaccines in both groups (49,5 and 32,4%, respectively; p < 0.001).
After the introduction of the second component, the proportion of patients with IRD who did not have any AE was also significantly greater when compared with the control (59.0 and 46,3%; p = 0.009). Serious AEs after the introduction of the second component were not registered.
After full immunization, patients with IRD were significantly more likely to have no AEs compared to control (40.3 vs. 21.0%; p < 0.001). Exacerbation of IRD and the emergence of new autoimmune phenomena after vaccination with two components of the vaccine were not noted.
According to the data obtained, the use of vaccines against COVID-19 in IRD appears to be quite safe.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.