Многопараметрический анализ биомаркеров для оценки эффективности инфликсимаба при ревматоидном артрите
- Аннотация
- Статья
- Ссылки
- English
Цель исследования: выявить лабораторные биомаркеры эффективности терапии РА ингибиторами TNF-α.
Материал и методы. Обследовано 27 пациентов с подтвержденным диагнозом РА (АСR, 1987), из них 25 женщин. Средний возраст больных – 46,5 (41,5–61,5) года, длительность заболевания – 7 (4–11) месяцев, DAS 28 – 6 (5–6). ИНФ вводили внутривенно капельно из расчета 3 мг/кг массы тела. Первые две инфузии – с интервалом две недели, следующие – через шесть недель, далее – каждые восемь недель.
Концентрации 21 биомаркера измеряли с использованием иммунонефелометрического метода, иммуноферментного анализа и технологии xMAP.
Результаты. Многофакторный анализ позволил выявить факторы, наиболее связанные с ответом на терапию ИНФ: интерлейкины 12, 17 и 9, а также С-реактивный белок, создать прогностическую модель эффективности данного препарата при РА.
Заключение. Многопараметрический анализ базальных уровней лабораторных биомаркеров может стать новым этапом в оценке эффективности терапии ингибиторами TNF-α у пациентов с РА.
Цель исследования: выявить лабораторные биомаркеры эффективности терапии РА ингибиторами TNF-α.
Материал и методы. Обследовано 27 пациентов с подтвержденным диагнозом РА (АСR, 1987), из них 25 женщин. Средний возраст больных – 46,5 (41,5–61,5) года, длительность заболевания – 7 (4–11) месяцев, DAS 28 – 6 (5–6). ИНФ вводили внутривенно капельно из расчета 3 мг/кг массы тела. Первые две инфузии – с интервалом две недели, следующие – через шесть недель, далее – каждые восемь недель.
Концентрации 21 биомаркера измеряли с использованием иммунонефелометрического метода, иммуноферментного анализа и технологии xMAP.
Результаты. Многофакторный анализ позволил выявить факторы, наиболее связанные с ответом на терапию ИНФ: интерлейкины 12, 17 и 9, а также С-реактивный белок, создать прогностическую модель эффективности данного препарата при РА.
Заключение. Многопараметрический анализ базальных уровней лабораторных биомаркеров может стать новым этапом в оценке эффективности терапии ингибиторами TNF-α у пациентов с РА.

Введение
Ревматоидный артрит (РА) – аутоиммунное ревматическое заболевание неизвестной этиологии, характеризующееся хроническим эрозивным артритом (синовитом) и системным поражением внутренних органов [1].
В основе патогенеза РА лежит генетически детерминированная и индуцированная факторами внешней среды (курение, инфекции и др.) персистирующая активация приобретенного и врожденного иммунитета в ответ на разнообразные патогены, что ведет к потере иммунологической толерантности к собственным антигенам [2, 3]. Особенностями иммунопатологического процесса при РА являются дефект В-клеточной толерантности, сопровождающийся продукцией аутоантител, и антиген-специфическая активация CD4+-T-лимфоцитов по Th1-типу с преобладанием синтеза провоспалительных (фактора некроза опухоли α (TNF-α), интерлейкинов (IL) 12, 1β, 6, 7, 15, 17, 18, интерферона γ (IFN-γ)) над синтезом противовоспалительных цитокинов (IL-4, -5, -10, -13, трансформирующего фактора роста β (TGF-β)) [4, 5].
Разработка и быстрое внедрение в клиническую практику генно-инженерных биологических препаратов (ГИБП), включая моноклональные антитела против провоспалительных цитокинов, представителями которых являются химерные моноклональные антитела к TNF-α – инфликсимаб (ИНФ), обусловливают необходимость совершенствования иммунологических методов определения предикторов эффективного ответа на проводимую терапию [5, 6].
Данные об использовании иммунологических маркеров для прогнозирования ответа на терапию ГИБП у пациентов с РА противоречивы. Последние годы для поиска таких биомаркеров все шире применяется основанный на протеомных технологиях мультиплексный анализ [7].
Целью данного исследования стала оценка результатов многопараметрического анализа лабораторных биомаркеров для прогнозирования эффективности терапии ИНФ при РА.
Материал и методы
Обследовано 27 пациентов с подтвержденным диагнозом РА (согласно классификации Американской коллегии ревматологов 1987 г.), из них 25 женщин. Средний возраст больных – 46,5 (41,5–61,5) года. Длительность заболевания – семь (4–11) месяцев. Патологический процесс по шкале активности заболевания (DAS 28) – шесть (пять-шесть) баллов.
ИНФ вводили внутривенно капельно из расчета 3 мг/кг массы тела, первые две инфузии – с интервалом две недели, следующую – через шесть недель, далее – каждые восемь недель.
Терапевтический эффект ГИБП оценивали по критериям Европейской антиревматической лиги [8].
Концентрацию иммуноглобулина M (IgM) ревматоидного фактора (РФ) и С-реактивного белка (СРБ) в сыворотке крови измеряли иммунонефелометрическим методом на анализаторе BN-ProSpec (Германия), антител к циклическому цитруллинированному пептиду (АЦЦП) – методом иммуноферментного анализа с использованием коммерческого набора реагентов Axis-Shield Anti-CCP (Великобритания). Количественное определение цитокинов в сыворотке крови проводилось методом мультиплексного анализа по технологии xMAP на анализаторе Bio-Rad Bio-Plex 200 (США). Речь, в частности, идет о таких цитокинах, как IL-1β, -1ra, -2, -4, -6, -10, -12, -13, -15, -17, фактор роста фибробластов (FGF), эотаксин, гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF), IFN-γ, индуцибельный белок 10 (IP-10), макрофагальный белок воспаления 1 (MCP-1), макрофагальный белок воспаления 1α (MIP-1α), TNF-α. Статистический анализ результатов проводили с помощью программного комплекса EpiInfo 7.0, рекомендованного для использования в медико-биологических приложениях. Для обработки результатов использовали общепринятые методы параметрического и непараметрического анализа. Результаты представлены в виде медианы (Ме) с интерквартильным размахом (25-й и 75-й перцентили). Корреляционный анализ проводился по методу Спирмена. Различия считались достоверными при p < 0,05. Прогноз значений одной переменной по другим проводили с помощью многофакторного анализа. Показатель h1...hn рассчитывали по формуле:
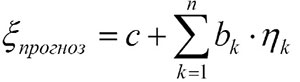
Для сравнительного анализа вклада факторов в прогностическую модель применяли нестандартизованный и стандартизованный коэффициенты (bk и βk). Последний рассчитывали по формуле:
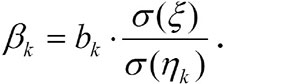
Кроме того, оценивали p.
Клиническую значимость полученной прогностической модели определяли с помощью построения ROC-кривой.
Результаты
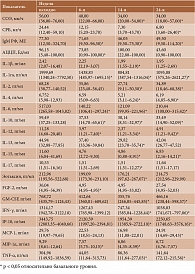
Через шесть недель терапии ИНФ у пациентов снизились уровни IgM РФ, АЦЦП, IL-1rа, -7, -10, -12, FGF-2, MIP-1α, через 14 недель – скорость оседания эритроцитов (СОЭ), уровни IgM РФ, IL-1β, -1rа, -2, -4, -6, -10, -12, -13, -15, -17, эотаксина, GM-CSF, IFN-γ, IP-10, MIP-1α, TNF-α, через 24 недели – СОЭ, уровни СРБ, IgM РФ, основных провоспалительных цитокинов TNF-α, IL-6, -12, -15 и противовоспалительных цитокинов IL-1ra, -10, а также Th1-цитокинов IL-2, IFN-γ, GM-CSF и хемокинов IP-10, MCP-1 (табл. 1).
На 24-й неделе у 14% пациентов, положительных в отношении IgM РФ, и 4,5% – в отношении АЦЦП зафиксирована сероконверсия в отрицательный результат. У 8% больных, отрицательных в отношении IgM РФ, и 33% пациентов, отрицательных в отношении АЦЦП, – в положительный результат.
С целью выбора оптимальной панели биомаркеров проведен пошаговый линейный регрессионный анализ их базальных концентраций. В качестве возможных предикторов клинического ответа тестировали:
- аутоантитела IgM РФ и АЦЦП;
- лабораторные маркеры воспаления СОЭ и СРБ;
- цитокины IL-1β, -1ra, -2, -4, -5, -6, -7, -8, -9, -10, -12, -13, -15, -17, FGF-2, эотаксин, G-CSF, GM-CSF, IFN-γ, IP-10, MCP-1, MIP-1α, MIP-1β, фактор роста тромбоцитов ВВ (PDGF-ВВ), RANTES, TNF-α, фактор роста эндотелия сосудов (VEGF).
Исходя из полученных данных, наиболее значимыми для прогнозирования эффективности ИНФ являются IL-12 (площадь под характеристической кривой 0,85), IL-17 (0,8), IL-9 (0,8) и СРБ (0,8) (табл. 2).
Вероятность эффективности рассчитывали по формуле: 1,6 - 0,013 × [IL-12] - 0,026 × [IL-17] - 0,18 × [IL-9] - 0,02 × [СРБ]. Полученную величину выражали в условных единицах. При < 0,45 применение данного ГИБП считалось неэффективным, от 0,45 до 0,74 вероятность клинического ответа составляла 67%, > 0,74 – 100%. При проверке точности прогноза с помощью построения ROC-кривой площадь под ней составила 0,96 (доверительный интервал 0,0–0,1).
Обсуждение
В большинстве исследований на фоне применения ингибиторов TNF-α в сыворотках больных РА отмечалось значительное (30–60%) снижение концентрации IgМ РФ [8–12]. Эти данные сопоставимы с результатами нашего исследования. Кроме того, на фоне терапии ИНФ нами выявлена отрицательная (14%) и положительная (8%) IgM РФ-сероконверсия. В отличие от IgМ РФ сывороточный уровень АЦЦП под воздействием ингибиторов TNF-α, как правило, не меняется [9–11, 13–19]. Существенное снижение данного показателя описано в единичных случаях, например при терапии адалимумабом. Отрицательная АЦЦП-сероконверсия также обнаруживается у незначительной части пациентов (4,5%) [20]. По нашим данным, к 24-й неделе терапии ИНФ уровень АЦЦП не изменялся, при этом у 4,5% пациентов отмечена отрицательная, а у 33% – положительная сероконверсия.
Практически все ингибиторы TNF-α индуцируют быстрое (в течение месяца) снижение уровня маркеров острой фазы воспаления: СОЭ и СРБ [21–25]. Нами установлено, что СОЭ достоверно снижалась через три с половиной месяца применения ИНФ, уровень СРБ – через шесть.
I. Sekigawa и соавт. впервые с помощью масс-спектрометрии изучили влияние ИНФ на белково-пептидный профиль сыворотки/плазмы крови у десяти больных РА [26]. Установлено, что уже через 24 часа после введения препарата возможно идентифицировать белки, участвующие в TNF-α-зависимых механизмах активации NF-kB (FAM62A/MBC2) и регенерации суставного хряща (CTGF). Аналогичные результаты получены R.C. Dwivedi и соавт. [27]. Через 12 недель от начала терапии у трех пациентов с хорошим ответом на препарат отмечено 20%-ное изменение концентрации 39 белков, регулируемых TNF-α или NF-kB. В целом на фоне ингибиторов TNF-α наблюдались снижение уровней IL-6, VEGF, сывороточного уровня хрящевого гликопротеина 39 (YKL-40, HC gp-39) и миграция ингибирующего фактора (MIF) [28, 29].
Согласно полученным нами данным, на 24-й неделе терапии ИНФ происходит снижение основных провоспалительных цитокинов TNF-α, IL-6, -12, -15, цитокинов, обладающих противовоспалительной функцией, IL-1ra, -10, Th1-цитокинов IL-2, IFN-γ, GM-CSF и хемокинов IP-10, MCP-1.
На большом клиническом материале показано, что до начала лечения положительные результаты в отношении IgM РФ и АЦЦП ассоциируются с неудовлетворительным клиническим ответом на ингибиторы TNF-α [30–32]. G. Wolbink и соавт. установили, что высокий исходный уровень СРБ у больных РА коррелирует с более низким ответом на ИНФ через 14 недель применения [33].
При многоступенчатом исследовании сывороточных белков идентифицирован профиль аутоантител и цитокинов, позволяющих прогнозировать ответ на терапию этанерцептом у больных РА [28]. Согласно нашим результатам, наиболее значимыми с точки зрения клинического ответа на ИНФ являются базальные уровни IL-12, -17, -9 и СРБ, Th17- и Th2-цитокинов, а также белка острой фазы воспаления, что в целом согласуется с результатами более ранних исследований. Эти данные сделали возможным создание многопараметрического диагностического индекса для прогнозирования ответа на ИНФ.
Заключение
Многопараметрический анализ базальных уровней лабораторных биомаркеров может стать новым этапом в прогнозировании эффективности терапии ингибиторами TNF-α при РА.
A.A. Novikov, E.N. Aleksandrova, D.E. Karateev, E.L. Luchihina, G.V. Lukina, A.N. Gerasimov
A.S. Loginov Moscow Clinic Scientific Center
Moscow Regional Research and Clinical Institute
V.A. Nasonova Research Institute of Rheumatology
I.M. Sechenov First Moscow State Medical University
Contact person: Aleksandr Aleksandrovich Novikov, irramnlab@yandex.ru
Rheumatoid arthritis (RA) is an autoimmune rheumatic disease of unknown etiology, characterized by chronic erosive arthritis (synovitis) and systemic lesions of internal organs. The introduction of genetic engineering biologics into clinical practice, including chimeric monoclonal antibodies against tumor necrosis factor alpha – infliximab (INF), obliges to develop the immunological predictors of therapy efficiency.
Objective: to identify a multi-biomarker score of response to infliximab.
Material and methods. Twenty-seven patients with RA (ACR, 1987) were examined, 25 women, median of age: 46.5 (41.5–61.5) years; disease duration 7 (4–11) months; DAS 28: 6 (5–6). The INF was administered intravenously, drip at the rate of 3 mg/kg body weight, the first 2 infusions with an interval of 2 weeks, the next infusion at 6 weeks and then every 8 weeks. 21 biomarkers concentrations were measured by: nephelometry, enzyme-linked immunosorbent assay and xMAP technology.
Results. Carrying out multifactor analysis made it possible to identify the factors most "associated" with the "response" to INF: IL-12, -17 -9, CRP and create a multi-biomarker score for INF.
Conclusion. Thus, a multi-parameter analysis of basal levels of laboratory biomarkers can become a new step in prediction of response to infliximab in RA.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.