Инновационный подход к комплексной терапии вирусных энцефалитов у детей раннего возраста
- Аннотация
- Статья
- Ссылки
- English


Введение
Одна из самых тяжелых инфекционных патологий детского возраста – вирусные энцефалиты (ВЭ), которые отличаются частотой и выраженностью последствий в виде летальных исходов и неврологических дефицитов, приводящих к инвалидизации и социальной дезадаптации реконвалесцентов [1–11]. По данным Всемирной организации здравоохранения, заболеваемость ВЭ составляет 7–9 случаев на 100 тыс. населения, а на детский возраст приходится до 76% всех случаев заболевания.
Наибольшая частота и тяжесть остаточных неврологических дефицитов при ВЭ отмечаются в раннем возрасте. Неблагоприятные исходы у детей первых месяцев – лет жизни обусловлены как морфологическими особенностями головного мозга (гидрофильностью и склонностью к быстрому развитию некрозов), так и незрелостью иммунной системы, определяющей высокий риск генерализации инфекции в структурах головного мозга, других органах и системах [12]. Еще одна причина тяжести и высокой частоты резидуального неврологического дефицита и хронического течения при ВЭ – развитие энцефалитов в результате внутриутробного инфицирования с последующей манифестацией в постнатальном периоде [13–15].
Значимое место в течении и исходах ВЭ занимает этиотропная терапия, расширение спектра которой при энцефалитах связано с использованием различных противовирусных препаратов: ациклических нуклеозидов (ацикловира, фамцикловира, ганцикловира, рибавирина), блокаторов ДНК-полимеразы и обратной транскриптазы (фоскарнета) и ионного канала белка М2 (римантадина), ингибитора нейраминидаз (осельтамивира) и пенетрации вируса в клетки (плеконарила) и др. [16–20]. Однако назначение современных противовирусных препаратов не гарантирует успех терапии, что, вероятно, связано с участием в поражении нервной системы в ряде случаев резистентных, высоковирулентных и мутантных штаммов вирусов [21, 22]. Большинство противовирусных препаратов воздействуют только на один механизм патогенеза, в основном подавляя репликацию инфекционного агента. Это также может быть причиной недостаточной эффективности, поскольку при хронических инфекциях клиническая картина обусловлена не только репликацией, но и внутриклеточной персистенцией вирусов [23].
Кроме того, определенную сложность у детей раннего возраста представляет применение некоторых противовирусных препаратов ввиду вероятности развития побочных эффектов и токсического действия, особенно при длительной терапии в течение трех-четырех и более недель [24, 25].
Известно, что для потенцирования противовирусного эффекта при многих острых и хронических инфекциях могут одновременно назначаться два и более препаратов, обладающих различными механизмами воздействия. Так, широко известны алгоритмы лечения вирусного гепатита С препаратами рибавирина и рекомбинантного интерферона (ИФН) альфа. Комбинация инъекционных форм ИФН-альфа с ациклическими нуклеозидами показала эффективность в терапии ВЭ, в том числе клещевого энцефалита и лейкоэнцефалитов различной этиологии, у детей старшей возрастной группы [26–28]. Сочетание нескольких противовирусных препаратов с различными механизмами действия используется и в лечении инфекции, вызванной вирусом иммунодефицита человека [29]. Сказанное позволяет предположить, что комбинированная терапия двумя препаратами, оказывающими разнонаправленное противовирусное действие, будет эффективной в лечении ВЭ у детей раннего возраста.
Препарат ВИФЕРОН® суппозитории содержит человеческий рекомбинантный ИФН-альфа-2b, витамин Е (альфа-токоферола ацетат) и витамин С (аскорбиновую кислоту). ИФН-альфа обладает как иммуномодулирующим, так и прямым противовирусным эффектом, участвуя в подавлении репликации различных вирусов путем блокирования вирусных синтетаз, протеаз. Иммуномодулирующая активность ИФН-альфа-2b реализуется путем усиления активности естественных киллеров (NK-клеток), Т-хелперов, цитотоксических Т-лимфоцитов, нормализации уровня иммуноглобулина E. Повреждение клеточных мембран, наблюдаемое в ходе развития инфекционного процесса, приводит к снижению противовирусной активности ИФН, гибели нейрональных, глиальных, иммунокомпетентных и других клеток, следствием чего становится некроз ткани мозга и вторичный иммунодефицит. Токоферола ацетат и аскорбиновая кислота, входящие в состав препарата ВИФЕРОН®, оказывают стабилизирующее действие на клеточные мембраны. Это позволяет увеличить противовирусную активность рекомбинантного ИФН-альфа-2b в 10–14 раз, а также воспрепятствовать массовой гибели клеток центральной нервной (ЦНС) и иммунной систем. Имеются данные литературы, подтверждающие эффективность препарата ВИФЕРОН® при гепатитах, гриппе, урогенитальных и респираторных инфекциях, дисбиозе кишечника, ювенильном ревматоидном артрите и других заболеваниях, в том числе развивающихся в перинатальном периоде [30–37]. Таким образом, есть все основания для того, чтобы оценить эффективность включения препарата ВИФЕРОН® в комплексное лечение ВЭ у детей раннего возраста.
Цель исследования
Определить клинико-лабораторную эффективность препарата ВИФЕРОН® в комплексной терапии ВЭ у детей раннего возраста.
Материал и методы
В исследование включено 103 ребенка с ВЭ, получавших лечение в клинике Детского научно-клинического центра инфекционных болезней Федерального медико-биологического агентства (Санкт-Петербург). Возраст пациентов составил от одного месяца до трех лет: 26 (25,2%) детей до года, 44 (42,7%) – от года до двух и 33 (32,1%) – от двух до трех лет.
Клинико-неврологическое обследование проводилось во время пребывания в стационаре. Далее в течение года осуществлялось амбулаторное наблюдение в поликлинике института с осмотром через один, шесть и 12 месяцев после выписки.
Вирусологическое обследование цереброспинальной жидкости (ЦСЖ) выполняли до лечения и на 15-е сутки от начала терапии, а также по показаниям (при отсутствии санации и/или сохранении положительных результатов молекулярно-генетической диагностики при предыдущем исследовании) на 21-е и 28–30-е сутки. Вирусологическое исследование крови осуществляли при поступлении, на 15, 21, 45–46 и 105–106-е сутки. Исследование включало выявление методом ПЦР в режиме реального времени ДНК вирусов простого герпеса (ВПГ) 1-го и 2-го типа, герпеса человека 6-го типа (ВГЧ-6), Эпштейна – Барр, варицелла-зостер (ВВЗ), клещевого энцефалита, краснухи, цитомегаловируса (ЦМВ) и энтеровирусов. Кроме того, методом иммуноферментного анализа обнаруживались титры специфических антител иммуноглобулинов M и G с определением авидности и количественной оценкой титра. Продукция антител оценивалась с целью уточнения динамики иммунного ответа на инфекции и выявления лабораторных показателей ее реактивации.
Для проведения иммуноферментного анализа использовались тест-системы производства ЗАО «Вектор-Бест» (Новосибирск), ПЦР – AmpliSens (ООО «ИнтерЛабСервис», Москва). Интерфероновый статус включал определение ИФН-альфа и ИФН-гамма в сыворотке крови методом иммуноферментного анализа (производители тест-систем ООО «Протеиновый контур» и ООО «Цитокин», Санкт-Петербург). До лечения, на 15-е и 45–46-е сутки от начала терапии определялась спонтанная и индуцированная продукция ИФН-альфа и ИФН-гамма в культуре клеток in vitro. В качестве индуктора ИФН применялся вирус болезни Ньюкасла.
Для определения локализации и площади поражения головного мозга в течение двух суток от момента госпитализации больным выполнялась магнитно-резонансная томография (МРТ) головного мозга на сверхпроводящем магнитном томографе Signa 1,5 Tесла (General Electric). Программа лучевого обследования включала импульсные последовательности (ИП): SE (Т1- и Т2-взвешенные изображения), FLAIR. Повторная МРТ проводилась через три и 12 месяцев.
В основной группе (n = 53) с момента установления диагноза ВЭ назначался препарат ВИФЕРОН® суппозитории: 150 000 МЕ – детям в возрасте до шести месяцев и 500 000 МЕ – детям с шести месяцев до трех лет. Схема применения при остром течении заболевания – два раза в сутки ректально ежедневно в течение 14 дней. При затяжном течении после 14-дневной терапии лечение пролонгировалось до трех раз в неделю в течение месяца, при хроническом – в том же режиме в течение трех месяцев.
В группу сравнения вошли 50 детей с ВЭ, получавшие противовирусную терапию без препарата ВИФЕРОН®. Группы наблюдения формировались методом случайной выборки по мере поступления в стационар и постановки диагноза ВЭ и были сопоставимы по полу, возрасту, течению и этиологии заболевания.
Все больные получали противовирусные препараты в зависимости от этиологии заболевания. Для лечения ВЭ, вызванных ДНК-содержащими вирусами герпетической группы (ВПГ, ВВЗ, Эпштейна – Барр, ЦМВ, ВГЧ-6), использовали ацикловир внутривенно 30–45 мг/кг/сут в три введения, ганцикловир внутривенно 10 мг/кг/сут в два введения, фамцикловир внутрь 8–10 мг/кг/cут один-два раза в день, вирусами клещевого энцефалита и краснухи, энтеровирусами – рибавирин внутрь 10 мг/кг/сут. Продолжительность лечения составила 14 суток. Параллельно назначалась стандартная патогенетическая и симптоматическая терапия разнонаправленного действия (жаропонижающие и дегидратационные средства, антиконвульсанты и осмодиуретики).
Статистическая обработка полученных данных проводилась на персональном компьютере с использованием пакета прикладных программ Microsoft Excel 2007, Stat Soft Statistica 6.0.
Результаты и их обсуждение
В ходе проведенного исследования установлено, что в этиологии ВЭ у пациентов основной группы и группы сравнения (n = 103) преобладали вирусы семейства Herpesviridae (1, 2, 3, 4, 5, 6-го типов) (n = 74, 71,8%), реже определялись энтеровирусы (n = 23, 22,3%), вирус краснухи (n = 4, 3,9%) и вирус клещевого энцефалита (n = 2, 1,9%). Отличительная особенность вирусов герпеса – одновременное выявление двух или трех вирусных агентов в половине случаев, при этом один из вирусов по результатам исследования ЦСЖ доминировал, а другие вирусы, реактивированные на фоне основной инфекции, рассматривались как сопутствующие. Среди ВЭ герпесвирусной этиологии чаще всего диагностировались энцефалиты, вызванные ВВЗ (n = 30, 41,5%), реже – ВЭ, вызванные ЦМВ и ВПГ 1-го или 2-го типа.
В зависимости от длительности неврологической симптоматики на момент госпитализации определялся характер течения заболевания: острый, затяжной или хронический. Острое течение (63%) устанавливалось при длительности заболевания не более десяти суток (в среднем 3,0 ± 1,2 суток) до начала терапии. Затяжное течение (в среднем 13 ± 2,9 суток) характеризовалось постепенным нарастанием неврологической, общемозговой симптоматики, что стало причиной поздней постановки диагноза. При хроническом течении длительность очаговой симптоматики в виде симптоматической эпилепсии, задержки психомоторного развития до госпитализации составила в среднем 3,5 ± 1,3 месяца. Во всех случаях к хроническому течению ВЭ привела врожденная инфекция с поражением ЦНС. Ввиду постепенности развития симптомов, отсутствия общеинфекционных проявлений больные с хроническим течением ВЭ до госпитализации наблюдались с неинфекционными диагнозами. Всем пациентам с хроническим течением ВЭ проводилась дифференциальная диагностика с наследственными нейродегенеративными, в том числе метаболическими, заболеваниями.
Клиническая картина ВЭ определялась этиологией, характером течения, а также локализацией очаговых изменений в веществе головного мозга. Так, при энцефалитах, вызванных ВВЗ, энтеровирусами, ВПГ, в 67–70% случаев наблюдалось острое течение, тогда как при энцефалитах, обусловленных ЦМВ, ВГЧ-6, в 2/3 случаев – затяжное и хроническое, а ВЭ, вызванные вирусом краснухи, во всех случаях были врожденными.
При остром течении в 90,7% случаев имел место выраженный общеинфекционный синдром с фебрильной лихорадкой и симптомами интоксикации. Кроме того, отмечались общемозговой и менингеальный синдромы, а в 46,1% случаев развился отек головного мозга с нарушением сознания до уровня сопора-комы. Судороги встречались в 43% случаев, пирамидные и мозжечковые расстройства – в 52,3%, нарушения функции краниальных нервов (парезы взора, паретическое косоглазие, бульбарные симптомы) – в 16,9% случаев.
Глазодвигательная симптоматика и парезы преобладали при энтеровирусной этиологии ВЭ, мозжечковые симптомы – при ВВЗ, нарушения сознания – при ВПГ и энтеровирусах, а судорожный синдром выявлялся с одинаковой частотой. У 95,4% больных с острым течением определялись воспалительные изменения ЦСЖ в виде увеличения плеоцитоза (107 ± 22 × 106/л), тогда как содержание общего белка находилось в пределах нормальных значений.
При затяжном течении (в отличие от острого) общеинфекционная симптоматика в первое время отсутствовала или имела субфебрильный характер, наблюдались парезы, мозжечковые или глазодвигательные нарушения. В 50% случаев возникли явления отека головного мозга, эпилептического статуса (чаще на седьмой – десятый день заболевания). Синдром менингита и повышение плеоцитоза в ЦСЖ регистрировались в 78,9% случаев. Умеренно повышалось содержание общего белка в ликворе – в среднем до 0,85 ± 0,13 г/л.
Во всех случаях при хроническом течении неврологические симптомы развивались постепенно с доминированием сонливости, отставания формирования навыков психомоторного развития, угнетения физиологических рефлексов, нарушений мышечного тонуса. В 50% случаев выявлялись эпилептические пароксизмы в виде сложных или простых парциальных приступов. В 83,3% случаев содержание клеток и белка в ЦСЖ оставалось в пределах нормальных значений.
Внецеребральная симптоматика определялась и при остром, и при затяжном, и при хроническом течении – в целом у 73,7% детей. Однако для острого и затяжного течения были типичны катаральные симптомы в виде фарингита (84,6 и 73,7% соответственно) и экзантемы (везикулезной, пятнисто-папулезной, а в отдельных случаях и геморрагической), нередко в сочетании с энантемами (46,1 и 52,6% соответственно). Реже встречались симптомы поражения желудочно-кишечного тракта (энтерит) и лимфадениты. В то время как при хроническом течении в 50% случаев обнаруживалось поражение внутренних органов (печени, легких) с развитием хронических пневмоний, гепатитов, в 15% – нарушения зрительного и/или слухового анализаторов в виде нейросенсорной тугоухости, атрофии зрительных нервов, катаракты, в 15,7% случаев – пороки развития мозга (структур задней черепной ямки, мозолистого тела и др.).
Только у 11,7% детей с ВЭ отсутствовали очаговые изменения на МРТ. У остальных при госпитализации выявлялись очаговые изменения, характеризующиеся гиперинтенсивным сигналом на Т2-взвешенных изображениях и FLAIR-ИП, а в 87% случаев – участки гипоинтенсивного сигнала на Т1-взвешенных изображениях. Зоны некроза уже при первом обследовании отмечались у 13,9% пациентов с затяжным и хроническим течением заболевания. Накопление контрастного вещества наблюдалось в 63% случаев.
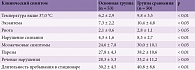
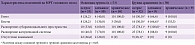
Анализ эффективности терапии показал, что продолжительность клинической симптоматики зависела как от характера течения ВЭ, так и от проводимого лечения. Установлено, что включение в комплексную терапию ВЭ препарата ВИФЕРОН® сокращало период нарастания неврологической и общеинфекционной симптоматики, а также продолжительность большинства симптомов. У пациентов, получавших ВИФЕРОН®, достоверно снизилась длительность лихорадки с 9,8 ± 3,5 до 6,2 ± 2,9 суток (табл. 1). У детей с экзантемами в основной группе высыпания проходили быстрее в среднем на трое-четверо суток.
В основной группе у детей с острым и затяжным течением ВЭ на четыре – шесть суток уменьшался период нарастания неврологической симптоматики. Кроме того, у них определялся более быстрый регресс мозжечковых нарушений и парезов по сравнению с группой сравнения. Продолжительность нарушения сознания в группе больных, получавших ВИФЕРОН®, сокращалась с 8,3 ± 2,7 до 4,3 ± 1,6 суток. Сокращение сроков нарастания и сохранения большинства симптомов позволило уменьшить длительность пребывания в стационаре больных основной группы на семь – десять дней.
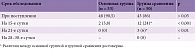
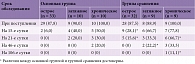
Нормализация клеточного состава ЦСЖ происходила достоверно быстрее у больных, получавших ВИФЕРОН®, по сравнению с пациентами группы сравнения – 96 и 50% на 15-е сутки соответственно. К 21-м суткам санация клеточного состава ЦСЖ отмечена в 100% случаев в основной группе и 88% случаев в группе сравнения. У оставшихся 12% пациентов с ВЭ, не получавших ВИФЕРОН®, нормализация клеточного состава затянулась до 28–30-х суток от начала терапии (табл. 2 и 3). Дольше всего положительные результаты ПЦР на вирусы в ЦСЖ сохранялись у детей с хроническим течением по сравнению с затяжным и особенно острым течением заболевания. Включение в терапию препарата ВИФЕРОН® позволило осуществить достоверно более быструю санацию ЦСЖ (по данным ПЦР) по сравнению с противовирусной терапией без препарата ВИФЕРОН®. Так, при первом обследовании ЦСЖ пациентов, госпитализированных в стационар, частота положительных результатов в основной группе и группе сравнения не имела достоверных различий и составила 90,5 и 86% соответственно. На 15-е сутки выявлены достоверные различия – положительные результаты ПЦР обнаруживались в 3,8 и 24% случаев соответственно. При этом у всех пациентов с положительными результатами из основной группы была врожденная хроническая инфекция ЦНС. Повторное исследование на 21-е сутки в основной группе выявило санацию в 100% случаев. В группе сравнения на 21-е сутки терапии положительные результаты исследования ЦСЖ сохранялись у 6% больных.
Исследование крови показало, что при остром течении достаточно 14-дневного курса противовирусной терапии с включением препарата ВИФЕРОН® (отрицательные результаты в 94% случаев). Тогда как при затяжном течении ВЭ среди пациентов основной группы к 15-м суткам отрицательные результаты имели только 60% больных, а при хроническом течении – 50%. К 46-м суткам у 3,7% пациентов основной группы сохранялся положительный результат исследования крови, несмотря на проводимую терапию. В группе сравнения и при остром, и при затяжном, и при хроническом течении положительные результаты ПЦР-диагностики крови на вирусы регистрировались достоверно дольше. Так, даже при остром течении на 21-е сутки в 15,6% случаев результаты исследования вирусов методом ПЦР были положительными. При затяжном и хроническом течении в 22,2 и 33,3% случаев соответственно длительность санации затягивалась до полутора месяцев, а в 11,1% – до трех месяцев. Дольше всего определялись в крови и ЦСЖ нуклеиновые кислоты вируса краснухи, ЦМВ, ВГЧ-6. А ВПГ, ВВЗ, энтеровирусы отличались более быстрой элиминацией. Полученные результаты свидетельствуют о том, что включение препарата ВИФЕРОН® в комплексное лечение ВЭ достоверно сокращало продолжительность выявления нуклеиновых кислот вирусов в ЦСЖ и крови, ускоряя процессы эрадикации вирусов, а также способствовало улучшению как ранних, так и отдаленных исходов ВЭ (табл. 4). Так, летальный исход наблюдался только в группе сравнения (n = 2, 4%). В одном случае причиной стал герпетический энцефалит, протекающий с быстрым прогрессированием отека головного мозга и развитием дислокационного синдрома. Во втором случае – врожденная инфекция ЦМВ-этиологии с развитием энцефалита в сочетании с пороками глаз и ЦНС (катарактой, гипоплазией мозжечка и мозолистого тела), статусным течением эпилепсии и развитием вторичной генерализованной бактериальной инфекции.
Тенденция к нарастанию остаточного неврологического дефицита обнаруживалась при увеличении длительности заболевания и чаще при хроническом течении ВЭ в обеих группах, чем при остром и затяжном течении. Однако включение препарата ВИФЕРОН® в комплексную терапию сокращало частоту неврологических нарушений. Так, в основной группе выздоровление без неврологического дефицита наблюдалось в 50,9% случаев, тогда как в группе сравнения – только в 22% случаев. При этом положительные результаты были достигнуты как при остром, так и затяжном течении.
У детей с хронической инфекцией ЦНС назначение препарата ВИФЕРОН® также позволило избежать и клинических, и лабораторных обострений. В группе сравнения обострения отмечались в 8% случаев (у трети больных с хроническим течением ВЭ) и отсутствовали у детей в основной группе, что свидетельствовало о предотвращении реактивации инфекции при пролонгированном использовании рекомбинантного ИФН-альфа-2b препарата ВИФЕРОН®. Частота развития остаточного двигательного дефицита достоверно сократилась при остром и затяжном течении ВЭ в группе детей, получавших ВИФЕРОН®, по сравнению с детьми, лечение которых проводилось стандартными противовирусными средствами без препарата ВИФЕРОН®, с 50 до 30,3% и с 90 до 60% соответственно. Доля пациентов с тяжелым дефицитом после лечения в основной группе была в два – четыре раза меньше (в зависимости от характера течения), чем в группе сравнения. Достоверно уменьшалась частота развития симптоматической эпилепсии и когнитивного дефицита в основной группе с острым течением по сравнению с группой сравнения. Частота вегетативного состояния сократилась с 8 до 1,8%.
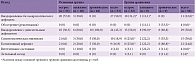
Включение препарата ВИФЕРОН® в терапию ВЭ позволило улучшить не только клинические исходы, но и морфологические, что подтверждалось с помощью лучевой диагностики. Частота резидуальных кистозно-глиозных изменений в ЦНС при остром течении ВЭ была достоверно ниже в основной группе – 24,2% (50% в группе сравнения) (табл. 5). Среди пациентов основной группы с острым течением реже наблюдались остаточные атрофические изменения структур головного мозга в виде расширения субарахноидальных пространств и/или желудочковой системы. У пациентов с хроническим течением в основной группе реже формировались кистозные изменения. Включение препарата ВИФЕРОН® в комплексное противовирусное лечение ВЭ у детей раннего возраста с острым течением заболевания увеличило частоту восстановления «нормальной» структуры головного мозга с 28,1 до 66,6%.
Оценка состояния интерферонового статуса у детей с ВЭ при поступлении в стационар не выявила достоверных различий в основной группе и группе сравнения (табл. 6). Однако на 15-е сутки в сыворотке крови у детей основной группы определялись достоверно более высокое содержание ИФН-альфа и более низкое содержание ИФН-гамма, чем у детей группы сравнения. Это можно объяснить как включением рекомбинантного ИФН-альфа в терапевтический комплекс, так и купированием инфекционного процесса. Кроме того, достоверными были различия по спонтанной и индуцированной продукции ИФН-альфа. При этом у пациентов основной группы показатели были выше, что, вероятно, связано с протективным действием препарата в отношении резервных возможностей клеток к синтезу ИФН-альфа. У больных, не получавших рекомбинантный ИФН-альфа, отмечалось истощение собственного резерва клеток к продукции данного цитокина. Схожая картина наблюдалась и на 45–46-е сутки от начала лечения. Индуцированная и спонтанная продукция ИФН-гамма как на 15-е, так и на 45–46-е сутки также имела достоверно более низкие значение, чем в группе сравнения (табл. 7). При этом содержание ИФН-гамма в крови у пациентов группы сравнения оставалось выше, чем в основной группе, что можно объяснить более продолжительным течением инфекционного процесса в некоторых случаях.
Сравнение продукции ИФН-альфа и ИФН-гамма у детей с ВЭ, получавших ВИФЕРОН®, позволило выявить более существенные отклонения и по содержанию ИФН в сыворотке крови, и по продукции ИФН in vitro при хроническом течении. Так, у детей с хроническим течением как при первом, так и при повторных исследованиях крови показатели содержания и продукции ИФН обоих типов были достоверно ниже, чем у детей с острым и затяжным течением. Это может объясняться не только длительным течением заболевания, но и индивидуальными особенностями интерфероногенеза у пациентов данной подгруппы. Установленные различия доказывают необходимость проведения более длительной противовирусной терапии с включением препаратов, содержащих рекомбинантный ИФН-альфа, у детей с хроническим течением инфекции ЦНС.
Следует отметить, что использование препарата ВИФЕРОН® в комплексной терапии ВЭ было безопасным, побочные эффекты не наблюдались.
Заключение
В настоящее время в арсенале врачей появилось достаточно большое количество различных препаратов рекомбинантного ИФН, отличающихся дозировками и способом введения (парентеральные, ректальные, для приема внутрь и наружного использования). Недостаток инъекционных форм рекомбинантных ИФН-альфа – болезненность, что имеет большое значение при необходимости длительного применения у детей. Кроме того, нередко инъекции сопровождаются лихорадкой, а в отдельных случаях и другими побочными симптомами: болевым синдромом различной локализации (миалгией, артралгией), тошнотой и рвотой, что негативно влияет на общее состояние пациентов, а также затрудняет оценку течения основного инфекционного процесса. В отличие от инъекционных форм рекомбинантного ИФН-альфа-2b препарат ВИФЕРОН® прост в применении и безболезнен. ВИФЕРОН® на протяжении ряда лет широко используется в педиатрической практике при многих инфекциях, но данные о его эффективности при нейроинфекциях, в том числе при ВЭ, в литературе ограниченны. В данном исследовании препарат ВИФЕРОН® назначался детям до трех лет, поскольку именно в этой возрастной группе в 100% случаев развиваются различные побочные реакции на парентеральные формы рекомбинантного ИФН-альфа-2b, что нередко требует отмены препарата. В отличие от парентеральных форм ИФН-альфа-2b ВИФЕРОН® хорошо переносился и не вызывал нежелательных явлений.
Терапия вирусных поражений любой локализации чаще, чем лечение бактериальных процессов, вызывает трудности ввиду нескольких причин. Во-первых, меньший арсенал этиотропной терапии и отсутствие специфических для многих вирусных агентов препаратов. Во-вторых, действие многих из них ограничено фазой репликации вирусов. В-третьих, высокий риск токсичности, особенно при длительном применении. Преимущество препарата ВИФЕРОН® заключается в комплексном действии: противовирусном, антиоксидантном и иммуномодулирующем. Отсутствие побочных эффектов и хорошая переносимость препарата детьми раннего возраста, широкий диапазон противовирусного действия позволяют не только обеспечить эффект при ВЭ различной этиологии, но и продлить лечение при затяжном и хроническом течении заболевания. Как показали проведенные нами исследования, использование препарата ВИФЕРОН® ускоряет эрадикацию вирусов, что помогает добиваться лучших результатов. Большая длительность виремии, особенно при хроническом течении ВЭ, вероятно, была обусловлена недостаточной активацией клеточного звена иммунного ответа, что проявлялось достоверно более низкой продукцией ИФН-альфа и ИФН-гамма, а также меньшим количественным содержанием ИФН-альфа в сыворотке крови. Можно предположить, что к этому предрасполагают и особенности некоторых возбудителей, часть из которых способна поражать иммунокомпетентные клетки и вызывать вторичные иммунодефициты (ЦМВ, ВГЧ-6).
Однако назначение препарата ВИФЕРОН® позволило корригировать изменения иммунного статуса у пациентов с ВЭ. Так, достоверно более низкие показатели индуцированной продукции ИФН-альфа у пациентов группы сравнения после курса противовирусной терапии в отличие от основной группы свидетельствовали об истощении резервных возможностей организма пациентов, не получавших рекомбинантные ИФН-альфа. Тогда как выявленные клинические и лабораторные результаты терапии подтверждают необходимость коррекции данных нарушений, поскольку это обеспечивает лучшие исходы. Если при остром течении достаточно короткого (14 дней) курса лечения, то при затяжном течении требуется длительная (в течение одного – трех месяцев) терапия ИФН-альфа-2b, что связано с более медленной санацией крови и ликвора, а также с достоверно более низкими показателями интерфероногенеза уже при первом обследовании. Низкие показатели индуцированной продукции ИФН-альфа у больных с хроническим течением ВЭ свидетельствуют о том, что целесообразнее использовать препараты, содержащие эндогенный ИФН, а не индукторы ИФН, поскольку внутренние резервы исчерпаны и медикаментозная индукция может не вызвать необходимого терапевтического эффекта.
На основании проведенного исследования можно заключить, что применение препарата ВИФЕРОН® суппозитории в комплексной терапии ВЭ у детей раннего возраста безопасно и эффективно, поскольку сокращает длительность нарастания и сохранения большинства внецеребральных (лихорадки и экзантемы) и церебральных очаговых симптомов. Кроме того, использование препарата ВИФЕРОН® суппозитории улучшало исходы заболевания: предотвращало летальные исходы, сокращало частоту развития вегетативного состояния с 8 до 1,8% (р < 0,01), повышало частоту полного клинического выздоровления без неврологического дефицита с 22 до 51% преимущественно за счет случаев острого и затяжного течения, а при хроническом течении предупреждало развитие обострений. Достоверно более благоприятные клинические исходы ВЭ в группе детей, получавших ВИФЕРОН®, соответствовали менее тяжелому развитию морфологических изменений в ЦНС по результатам МРТ. Это проявлялось сокращением частоты формирования кистозно-глиозных изменений в 2,1 раза, а также увеличением числа больных с отсутствием изменений на МРТ головного мозга после терапии с 18 до 45,2%. Включение препарата ВИФЕРОН® в схему противовирусной терапии приводило к достоверно более быстрой элиминации возбудителей как в крови, так и в ЦСЖ, санации ликвора, что коррелировало с нормализацией показателей интерферонового статуса и обеспечивало протекцию резервных возможностей организма пациентов. Применение препарата ВИФЕРОН® в комплексном лечении ВЭ у детей раннего возраста безопасно, побочные эффекты отсутствуют. Опыт Детского научно-клинического центра инфекционных болезней ФМБА России позволяет рекомендовать ВИФЕРОН® к включению в состав комплексной противовирусной терапии ВЭ у детей раннего возраста, при этом схемы назначения препарата ВИФЕРОН® должны определяться характером течения заболевания.
N.V. Skripchenko, G.P. Ivanova, Ye.Yu. Skripchenko, G.F. Zheleznikova, V.V. Malinovskaya, M.V. Ivanova, A.A. Vilnits, V.Ye. Karev, Ye.Yu. Gorelik, N.F. Pulman, A.V. Surovtseva, Ye.M. Vishnevetskaya, O.N. Puntusova, T.A. Kozlova
Pediatric Research and Clinical Center for Infectious Diseases under the Federal Medical Biological Agency, Saint Petersburg
Saint Petersburg State Pediatric Medical University
National Research Center of Epidemiology and Microbiology named after N.F. Gamaleya, Moscow
Contact person: Natalya Viktorovna Skripchenko, snv@niidi.ru
The article presents the clinical and etiological characteristics of viral encephalitis (VE) in 103 children aged 1 month to 3 years and an innovative approach to complex therapy of viral encephalitis, involving recombinant interferon-alpha2b (VIFERON®) in the form of rectal suppository. The scheme and duration of administration of the preparation VIFERON® in the study was determined by the nature of the current of the VE. In the acute course of VE, the drug was prescribed 14 days daily 2 times a day, with prolonged and chronic 14 days daily 2 times a day, then 3 times a week for 1 or 3 months, respectively. It was found that the appointment of the drug VIFERON® with VE makes it possible to accelerate the processes of sanogenesis and shorten the duration of growth and preservation of the main outside cerebral and cerebral symptoms, the duration of sanitation of the cerebrospinal fluid and viremia. The results of a comparative analysis of the efficacy have shown that the use of the preparation VIFERON® leads to an improvement in the outcome of VE, prevents the development of lethal outcomes, reduces the vegetative state from 8% to 1.8%, increases the rate of recovery without deficiencies from 22% to 51% and reduces the frequency of formation of cystic-gliotic changes in the brain by 2.1 times. Established a slower sanitation of cerebrospinal fluid and a greater duration of viremia in chronic and prolonged flow of VE in children, which determines the need for a longer application of the drug VIFERON®. The inclusion of recombinant interferon-alpha2b in early childhood therapy with VE provides a significantly higher content of interferon-alpha in the serum of these patients and helps maintain reserve capacities for its products, thereby facilitating accelerated recovery. The proven efficacy and safety of the inclusion of the drug VIFERON® in VE in young children makes it possible to recommend it for use in a wide clinical practice.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.