Пожилые пациенты с сахарным диабетом 2 типа, проживающие в доме престарелых: опыт одного центра
- Аннотация
- Статья
- Ссылки
- English
Целью данного пилотного одномоментного поперечного исследования было дать комплексную эндокринологическую и гериатрическую характеристику пациентам с ранее выявленным СД, находящимся на обеспечении в ГБУ «Дом ветеранов сцены им. А.А. Яблочкиной» Департамента труда и социальной защиты населения г. Москвы (ДВС).
Исследование было проведено в апреле 2021 г. В рамках исследования были выполнены анализ медицинской документации, интервьюирование и комплексное гериатрическое обследование.
На момент проведения исследования в ДВС проживал 21 человек с ранее диагностированным СД 2 типа (25,3% из всех резидентов). Средний возраст участников исследования составил 83 (73–87) года. 66,7% из них были женщины.
При оценке гериатрического статуса функциональная зависимость была выявлена у 2/3 пациентов, тяжелые когнитивные нарушения – у каждого четвертого.
Исследованная когорта характеризовалась высокой коморбидностью (в среднем 11 (7–12) нозологий) и полипрагмазией (7 (8–10) принимаемых лекарственных средств).
Фактический уровень гликированного гемоглобина был значимо ниже индивидуального целевого (в среднем 6,4 (5,5–7,2) %) на фоне приема одного-двух сахароснижающих препаратов. Тремя наиболее распространенными классами препаратов были метформин (52,0%), производные сульфонилмочевины (43,0%) и базальный инсулин (28,6%). Об эпизодах гипогликемии сообщал каждый третий пациент.
С диабетологической точки зрения в данной группе наиболее актуальной клинической задачей представляется выполнение контролируемого депрескрайбинга сахароснижающей терапии.
В связи с небольшим размером выборки необходимо проведение дальнейших работ по комбинированной эндогериатрической оценке у пожилых в домах престарелых. Полученные данные могут быть использованы при разработке соответствующих клинических рекомендаций.
Целью данного пилотного одномоментного поперечного исследования было дать комплексную эндокринологическую и гериатрическую характеристику пациентам с ранее выявленным СД, находящимся на обеспечении в ГБУ «Дом ветеранов сцены им. А.А. Яблочкиной» Департамента труда и социальной защиты населения г. Москвы (ДВС).
Исследование было проведено в апреле 2021 г. В рамках исследования были выполнены анализ медицинской документации, интервьюирование и комплексное гериатрическое обследование.
На момент проведения исследования в ДВС проживал 21 человек с ранее диагностированным СД 2 типа (25,3% из всех резидентов). Средний возраст участников исследования составил 83 (73–87) года. 66,7% из них были женщины.
При оценке гериатрического статуса функциональная зависимость была выявлена у 2/3 пациентов, тяжелые когнитивные нарушения – у каждого четвертого.
Исследованная когорта характеризовалась высокой коморбидностью (в среднем 11 (7–12) нозологий) и полипрагмазией (7 (8–10) принимаемых лекарственных средств).
Фактический уровень гликированного гемоглобина был значимо ниже индивидуального целевого (в среднем 6,4 (5,5–7,2) %) на фоне приема одного-двух сахароснижающих препаратов. Тремя наиболее распространенными классами препаратов были метформин (52,0%), производные сульфонилмочевины (43,0%) и базальный инсулин (28,6%). Об эпизодах гипогликемии сообщал каждый третий пациент.
С диабетологической точки зрения в данной группе наиболее актуальной клинической задачей представляется выполнение контролируемого депрескрайбинга сахароснижающей терапии.
В связи с небольшим размером выборки необходимо проведение дальнейших работ по комбинированной эндогериатрической оценке у пожилых в домах престарелых. Полученные данные могут быть использованы при разработке соответствующих клинических рекомендаций.


Введение
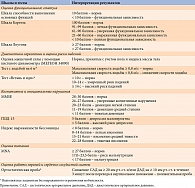
С возрастом не только повышается риск развития сахарного диабета (СД) 2 типа, но и изменяется характер течения болезни. Как следствие, требуется коррекция целей лечения и способов их достижения. В отношении оптимальных значений углеводного обмена у пожилых пациентов с СД международные эксперты высказывают различные точки зрения. Однако они едины в том, что для выбора целей лечения необходимо проведение гериатрической оценки, поскольку функциональный и когнитивный статус имеет большее значение, чем паспортный возраст [1]. Рекомендации экспертов Российской ассоциации эндокринологов в отношении целевых показателей терапии представлены в табл. 1 [2].
Лица с СД 2 типа, проживающие в домах престарелых, пансионатах и иных учреждениях с оказанием услуг жизнеобеспечения, гораздо менее изучены, чем пациенты того же возраста, живущие у себя дома.
Более глубокое понимание особенностей данной популяции позволит сформулировать оптимальные подходы к ее ведению.
Цель исследования
В настоящем исследовании изучали диабетологический и гериатрический фенотип пациентов с СД 2 типа, проживающих в домах престарелых.
Материал и методы
Проведено пилотное одномоментное поперечное исследование пациентов с ранее выявленным СД, проживающих в ГБУ «Дом ветеранов сцены им. А.А. Яблочкиной» Департамента труда и социальной защиты населения г. Москвы (ДВС).
Исследование было одобрено локальным этическим комитетом Первого Московского государственного медицинского университета им. И.М. Сеченова (ПМГМУ им. И.М. Сеченова).
Дом ветеранов сцены расположен в Перовском районе рядом с Измайловским парком. В ДВС обеспечивается стационарное социальное и медицинское обслуживание граждан пожилого возраста и инвалидов.
Жилые и медицинские корпуса представляют собой двухэтажные здания, соединенные между собой. Четыре двухэтажных корпуса соединены общим холлом, в котором располагается зимний сад длиной около 180 м. Он также оборудован диванами, спортивными тренажерами, столом для пинг-понга. В каждом корпусе предусмотрены открытые балконы для прогулок. В ДВС также есть библиотека и актовый зал.
ДВС рассчитан на 90 мест. Все пациенты проживают в отдельных комнатах. В каждой комнате есть прихожая, санузел, ванная и собственно жилое помещение. Жилая площадь на одного пациента составляет от 11 до 16 м2.
Проживающим разрешается заводить питомцев.
В ДВС организовано шестиразовое питание с диетическим заказным меню. Один-два раза в день проживающие получают молочные продукты, два раза в день – блюда с высоким содержанием белка (рыба, птица, мясо). Маломобильным лицам питание доставляется в комнаты в специальной посуде.
В медицинском корпусе есть две палаты для нуждающихся в непрерывном медицинском наблюдении. В штат сотрудников ДВС входят терапевт, медицинские сестры, психолог. Организуются внешние консультации профильных специалистов. Например, при необходимости коррекции сахароснижающей терапии пациент направляется к эндокринологу в государственную поликлинику.
На каждого проживающего при поступлении заводятся медицинская карта и лист назначений, которые заполняются штатным терапевтом. В них вносятся все лабораторно-инструментальные исследования, консультации внешних специалистов, информация о коррекции терапии.
В начале каждого календарного года проводится консилиум, по результатам которого составляется заключение о динамике состояния пациента за прошедший год. Листы назначения обновляются по мере коррекции терапии.
Исследование предполагало интервьюирование, комплексное гериатрическое обследование и анализ карт динамического наблюдения за последний год.
Все пациенты дали информированное добровольное согласие на участие в исследовании.
Интервьюирование. В режиме индивидуальной беседы обсуждались социальный статус, диабетологический анамнез (порядок и регулярность самоконтроля гликемии, наличие гипогликемий), функционирование органов таза, компенсация сенсорных нарушений, выраженность хронической боли при ее наличии, необходимость использования вспомогательных средств, анамнез падений, степень физической активности, некоторые аспекты лекарственного анамнеза.
Комплексное гериатрическое обследование выполнялось по стандартной форме с использованием шкал и тестов, представленных в табл. 2 [1].
После выполнения тестирования общее состояние пациента оценивалось по Клинической шкале старческой астении (Clinical Frailty Scale – CFS), представленной в приложении [1].
Анализ медицинской документации и сбор недостающей информации. Из медицинских карт брали информацию о длительности СД, наличии осложнений, сопутствующих заболеваниях и проводимой постоянной и курсовой медикаментозной терапии, росте и весе пациентов, результатах биохимического (гликированный гемоглобин (HbA1c), креатинин, общий холестерин и холестерин липопротеинов низкой плотности (ЛПНП)) и общего анализа крови, а также общего анализа мочи, выполненных не ранее чем за три месяца до включения в исследование, последнем заключении офтальмолога. Оценка альбуминурии не представлялась возможной по техническим причинам.
Важно отметить, что с учетом эпидемиологической обстановки допуск внешних лиц к проживающим осуществлялся только после завершения полного курса вакцинации от COVID-19 обеих сторон.
Полученные данные обрабатывали в программе IBM SPSS Statistics 26. Количественные переменные представлены в виде Me (Q1–Q3). Для сравнения непараметрических значений применялся критерий Манна – Уитни. Анализ номинальных переменных осуществляли с помощью хи-квадрата Пирсона и точного критерия Фишера.
Результаты
Исследование было запланировано в декабре 2020 г. и выполнено после завершения вакцинации пациентов в период с марта по апрель 2021 г. На момент исследования в ДВС проживали 83 человека, у 21 из них ранее был диагностирован СД 2 типа. Однако у одного пациента, исходя из клинических данных – отсутствие избыточной массы тела и раннее начало базис-болюсной инсулинотерапии, нельзя было исключить наличия латентного аутоиммунного диабета взрослых (LADA). Одна пациентка находилась в палате медицинского корпуса под постоянным наблюдением.
Социально-демографическая характеристика группы представлена в табл. 3. В сфере искусства работали менее половины пациентов.
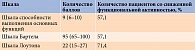
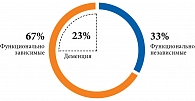
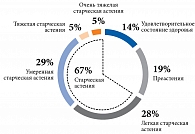
Гериатрический статус. Оценка функционального статуса по основным гериатрическим шкалам представлена в табл. 4. Так, 67,0% резидентов оказались функционально зависимыми (рис. 1). Самостоятельно выходили из помещения 57,0% пациентов, гуляли регулярно пять – семь раз в неделю – 28,6%. Использовали для перемещения вспомогательные средства, такие как трость, костыли, ходунки, 38% лиц. Только 23,8% участников исследования самостоятельно выполняли упражнения для поддержания физической формы.
Тест с ходьбой на 6 м смогли выполнить 76,2% пациентов. Максимальная скорость ходьбы свыше 0,8 м/с зафиксирована у 43,0%. Вставали без опоры на руки 23,8%. Высокий риск падений по результатам теста «Встань и иди» выявлен у 52,0%. Шаткость походки отмечена у 47,6%. Снижение мышечной силы по данным динамометрии выявлено у 81% обследованных.
Таким образом, у 52,4% пациентов имели место оба клинических проявления саркопении, а именно снижение скорости ходьбы и снижение мышечной силы, у 28,6% – хотя бы одно из них.
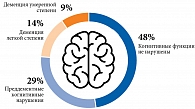
О когнитивных нарушениях в медицинских картах упоминалось в 43,0% случаев. При проведении тестирования по Краткой шкале оценки психического статуса (Мini Mental State Examination – MMSE) когнитивные нарушения различной степени тяжести выявлены у 52,0% (рис. 2). Деменция легкой или умеренной степени обнаружена у 23,0% пациентов. Специфическую терапию антагонистом глутаматных NMDA-рецепторов мемантином получали 10,5%.
Согласно данным, полученным при использовании Гериатрической шкалы депрессии (краткая версия) (ГШД-15), высокая вероятность депрессии зафиксирована у 33,0%. Нейролептики принимали 14,3%. Четверть пациентов на постоянной основе получали снотворные препараты. При этом у 38% были выявлены нарушения сна легкой и средней тяжести в равном соотношении.
В зависимости от гериатрического статуса группа оказалась разнородной. Распределение пациентов по категориям CFS представлено на рис. 3. Для дальнейшего анализа участники исследования были распределены на группу без старческой астении (третья-четвертая категории по CFS) и группу со старческой астенией различной степени тяжести (пятая – восьмая категории по CFS). Первую составили 33,3% пациентов, вторую – 66,7%.
При оценке статуса питания средний балл по Краткой шкале оценки питания (Mini Nutritional Assessment – MNA) составил 22,0 (18,8–24,3). У 14,3% пациентов результаты соответствовали развившейся мальнутриции, у 57,1% – группе риска таковой. Вместе с тем у 66,7% пациентов индекс массы тела соответствовал ожирению первой – третьей степени. Несмотря на то что у большей половины участников были съемные зубные протезы, 57% испытывали трудности с пережевыванием пищи.
Из обследованных 81,0% использовали очки, при этом 43,0% указывали на недостаточность компенсации снижения зрения. У 61,9% ранее была диагностирована катаракта, у 33,0% – проведена факоэмульсификация.
Нейросенсорная тугоухость или пресбиакузис фигурировали в 33,0% карт. Слуховым аппаратом пользовалась одна (4,8%) пациентка. О недостаточности компенсации снижения слуха сообщали 19,0%, то есть каждый пятый пациент.
Эпизоды недержания мочи отмечались у трети пациентов, постоянное недержание – у такого же количества больных. Потребность в абсорбирующем белье испытывали 57,0% обследованных.
На хроническую боль жаловались 76,2% пациентов, при этом 24,0% из них отмечали ее персистирующий характер. Регулярный прием (один раз в неделю и чаще) обезболивающих требовался 38,0%. Преимущественно пациенты принимали нестероидные противовоспалительные препараты, один пациент получал наркотические обезболивающие с помощью помпы.
О наличии головокружения сообщали 66,7% пациентов. За предшествующий год хотя бы одно падение имело место у 23,3%. Многократно падали 14,3%. Страх падений испытывали 81,0% пожилых.
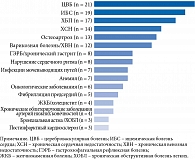
У каждого пациента в среднем было 11 (7–12) нозологий. Среди сопутствующих заболеваний наиболее распространены атеросклеротические сердечно-сосудистые заболевания (АССЗ), хроническая болезнь почек (ХБП), дегенеративные заболевания опорно-двигательного аппарата, венозная недостаточность нижних конечностей, нарушение сердечного ритма, патология верхних отделов желудочно-кишечного тракта, инфекция мочевыводящих путей и анемия (рис. 4).
В структуре цереброваскулярных заболеваний доминировали хронические формы. Диагноз «цереброваскулярная болезнь» был установлен в 100% случаев. Острое нарушение мозгового кровообращения в анамнезе зафиксировано в 4,8% случаев.
У 9,5% больных имели место трофические язвы, обусловленные венозной недостаточностью или лимфостазом и не связанные с СД.
Заболевания щитовидной железы обнаружены у 28,6% пациентов. Так, у 14,3% ранее был выявлен гипотиреоз, у такого же количества больных – узловые образования щитовидной железы.
Достоверно судить о распространенности остеопороза в данной популяции не представлялось возможным. Денситометрия проводилась только одной пациентке после компрессионного перелома поясничных позвонков, хотя как минимум еще одна пациентка нуждалась в подобном исследовании по результатам анализа абсолютного риска переломов в ближайшие десять лет (Fracture Risk Assessment Tool – FRAX). У большинства пациентов была низкая десятилетняя вероятность переломов.
Необходимо подчеркнуть, что FRAX позволяет оценить риск переломов только у пациентов до 90 лет. В нашем исследовании 19,0% участников относились к группе долгожителей.
Витамин D на регулярной основе принимали менее 10,0% пациентов.
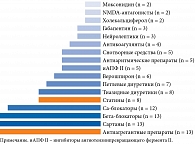
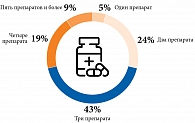
Согласно листу назначений, одномоментно пациенты принимали 7 (8–10) препаратов. Кроме того, 86,0% получали препараты по требованию, в частности при болевом синдроме, повышении артериального давления, диспепсии. Каждый третий пациент применял растительные/гомеопатические препараты без согласования с медицинскими работниками. Наиболее часто применяемые для постоянной сопутствующей терапии препараты представлены на рис. 5.
Самостоятельный прием рекомендованных препаратов осуществляли 43,0% пациентов. Столько же больных принимали препараты, подготовленные медицинским персоналом. В контроле приема лекарственных средств нуждались 14,0% пациентов. Хотя бы однажды прекращали прием препарата, назначенного врачом, 38,0%.
Антиагрегантную терапию получали 62,0% обследованных, в то время как только у 19,0% в анамнезе было острое сердечно-сосудистое событие, являющееся показанием к этой терапии. У трех пациентов – острый инфаркт миокарда, у одного – острое нарушение мозгового кровообращения.
Диабетологический статус. Средняя длительность СД у обследованных составила 11 (5–17) лет. При этом у большинства пациентов дебют заболевания приходился на достаточно поздний возраст – 71 (60–75) год.
Уровень HbA1c в среднем составлял 6,4 (5,5–7,2) %.
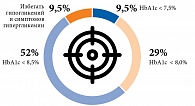
После учета гериатрического статуса и сопутствующих заболеваний (ХБП, АССЗ) для каждого пациента была определена индивидуальная цель лечения (рис. 6). Значения HbA1c были ниже индивидуальных целевых у 85,7%. У пациентов с целевым уровнем HbA1c < 8,0% его фактическое значение составляло 7,2 (5,5–9,4) %. У пациентов с целевым HbA1c < 8,5% и на завершающем этапе жизни он оказался еще ниже – 6,5 (5,8–6,6) %.
Регулярный самоконтроль гликемии осуществляли два (9,5%) пациента. У остальных измерения гликемии проводили медсестры. Ввиду удовлетворительных значений гликемии у большинства пациентов контроль проводился в режиме «по требованию», то есть при появлении симптомов гипо- или гипергликемии.
Практически треть обследованных сообщали об эпизодах гипогликемии. Чаще всего при возникновении ее симптомов пациенты эмпирически принимали легкоусвояемые углеводы без контроля гликемии. Тяжелых гипогликемий, требовавших вмешательства медперсонала, зарегистрировано не было.
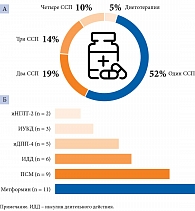
Только одна пациентка находилась на диетотерапии. Остальные получали различные сахароснижающие препараты (ССП), преимущественно в виде монотерапии (рис. 7). Двумя наиболее широко представленными классами ССП были бигуаниды (метформин) и производные сульфонилмочевины (ПСМ) (гликлазид МВ и глимепирид). Их получали 52,0 и 43,0% пациентов соответственно. Фиксированную комбинацию пероральных ССП получал один (4,8%) пациент. Инсулинотерапию проводили в 28,6% случаев.
У 90,5% достигших индивидуального целевого уровня HbA1c в составе терапии был 1 (1–2) препарат, чаще всего метформин (47,4%) или ПСМ (42,1%). Инсулинотерапию получали 21,1% обследованных.
О гипогликемии сообщали 33,3%.
Связь между гипогликемией и терапией ПСМ или иснулинотерапией не прослеживалась (р = 0,68 и р = 0,12 соответственно).
У двух (9,5%) пациентов с уровнем HbA1c выше целевого терапия была более агрессивная. Они получали три-четыре лекарственных средства (метформин + базальный инсулин + ПСМ/ингибитор дипептидилпептидазы 4 (иДПП-4)/инсулин ультракороткого действия (ИУКД)). У обоих пациентов были зафиксированы эпизоды гипогликемии.
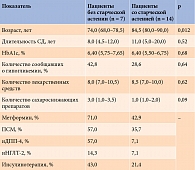
Пациенты со старческой астенией были старше (p = 0,012). Других статистически значимых различий в диабетологических характеристиках не установлено (табл. 5).
Данные в отношении поздних осложнений СД у пациентов были ограниченны.
Непролиферативная диабетическая ретинопатия описана у 4,8%. Лазерная коагуляция не проводилась.
У 81,0% пациентов диагностирована нефропатия смешанного генеза, в частности ХБП С3а и С3б у 42,9 и 23,8% соответственно. У 14,3% – ХБП С4. Пациентов на диализе среди обследованных не было. У одного (4,8%) пациента по результатам общего анализа мочи определялась протеинурия.
Диабетическая периферическая полинейропатия была установлена 23,8% лиц.
У всех обследованных имела место гипертоническая болезнь. У 81,0% – артериальная гипертензия третьей степени. Все пациенты получали антигипертензивную терапию, структура которой представлена на рис. 5 и 8. На фоне проводимой терапии значения артериального давления не превышали рекомендованных 140/90 мм рт. ст. у 90,5%. В то же время у 38,1% пациентов была положительная ортостатическая проба.
Все пациенты относились к группе очень высокого сердечно-сосудистого риска, при этом гиполипидемическую терапию (ингибиторы ГМГ-КоА-редуктазы) получали только 38,0%. Целевые значения холестерина ЛПНП были достигнуты у двух (9,5%) обследованных: у одной пациентки на медикаментозной терапии и пациента с подозрением на LADA на фоне соблюдения рекомендаций по питанию и физической активности. Утверждать об отсутствии необходимости назначения гиполипидемической терапии можно было лишь у двух пациентов, так как ожидалась низкая продолжительность жизни.
Смертность в течение полугода (на октябрь 2021 г.) составила 14,3%. Один пациент умер от полиорганной недостаточности в исходе онкологического заболевания. Причина смерти пациентки, госпитализированной с подозрением на COVID-19-пневмонию, окончательно не установлена. Наиболее вероятной причиной смерти еще одной пациентки указан тромбоз после падения.
Обсуждение
Согласно данным зарубежных авторов, каждый четвертый старше 65 лет имеет диагноз СД. Распространенность СД среди проживающих в домах престарелых варьируется от 25 до 34% [3, 4]. Полученные нами результаты согласуются с приведенными данными.
В зарубежной литературе нам удалось найти единичные работы, описывающие пациентов с СД в домах престарелых [3, 5, 6]. Аналогичных отечественных исследований пока не проводилось.
Основные гериатрические и диабетологические характеристики обследованной группы представлены на рис. 9.
Исходя из полученных результатов можно предложить несколько направлений, которые могли бы улучшить ведение пожилых пациентов с СД 2 типа в домах престарелых. В первую очередь следует обратить внимание на сахароснижающую терапию и возможность ее деинтенсификации.
Существует ряд физиологических и поведенческих факторов, обусловливающих высокий риск развития гипогликемии в пожилом возрасте, таких как нарушение и замедление контринсулярной регуляции, снижение функции почек, замедление абсорбции углеводов в кишечнике, вариабельность аппетита, когнитивные нарушения, которые могут приводить к пропуску приема пищи и повторному приему ССП. В свою очередь гипогликемии ассоциируются с ухудшением когнитивного статуса, риском падений и, как следствие, переломов. Именно поэтому в старшей возрастной группе ключевым требованием к сахароснижающей терапии является ее безопасность с точки зрения риска гипогликемии [7].
В реальной клинической практике безопасность сахароснижающей терапии по-прежнему остается нерешенным вопросом. Так, согласно результатам американского исследования, в ответ даже на тяжелую гипогликемию у пожилых с СД, получающих ПСМ и/или инсулин, деинтенсификация терапии в течение трех месяцев осуществлялась менее чем у половины [8].
У большинства пациентов с СД, проживавших в ДВС, уровень HbA1c был значимо ниже индивидуального целевого, при этом компенсация достигалась применением одного-двух препаратов. При анализе структуры сахароснижающей терапии установлено, что 43,0% пациентов получали ПСМ. Однако препараты данного класса нежелательно использовать у пожилых. Новые классы ССП в структуре сахароснижающей терапии были представлены незначительно. Так, иДПП-4 получали 23,8%, ингибиторы натрий-глюкозного котранспортера 2 (иНГЛТ-2) – менее 10,0%. Агонисты рецепторов глюкагоноподобного пептида 1 (арГПП-1) не принимал ни один пациент. Важно отметить, что лица со старческой астенией были перелечены, как и более сохранные пациенты. Уровень HbA1c и количество ССП не различались между группами.
Сопоставимые результаты были получены в достаточно крупном турецком исследовании в отношении 159 пациентов с СД, проживающих в частном доме престарелых в Стамбуле. Так, средний уровень HbA1c у них составил 6,4 ± 1,5%. Наиболее часто применяемыми ССП были ПСМ, метформин и инсулин (41,0, 42,0 и 42,0% соответственно) [3].
Согласно данным аналогичного итальянского исследования, проведенного на базе двух домов престарелых, из 46 пациентов 20,0% находились на диетотерапии, 40,0% получали пероральные ССП (преимущественно монотерапия метформином), еще у 40,0% в составе терапии был инсулин, менее 10,0% пациентов применяли ПСМ. При этом у 75,0% обследованных HbA1c был менее 7,0%, у 25,0% – от 7,0 до 8,3% [5].
В норвежском исследовании с участием 116 пациентов из 19 домов престарелых 25,0% находились на диетотерапии. Наиболее часто применяемыми ССП были метформин (27,0%) и глимепирид (18,0%). Половина пациентов получали инсулинотерапию в виде монотерапии или в комбинации с пероральными ССП [6].
Представленные результаты, особенно с учетом вынужденной полипрагмазии и наличия у половины обследованных когнитивных нарушений, свидетельствуют о необходимости разумного депрескрайбинга и деинтенсификации терапии. Речь, в частности, идет об отмене пациентам с целевыми значениями HbA1c препаратов из группы ПСМ или замене их на более безопасные препараты других групп, а также замене инсулина на пероральные ССП. Особенно обоснованным такой подход представляется в учреждении, в котором есть условия для своевременного динамического наблюдения за показателями углеводного обмена. При назначении ССП других групп следует помнить об их потенциальных побочных действиях. Так, иНГЛТ-2, несмотря на их кардио- и нефропротективные эффекты, могут потенцировать гипотензию, что повышает риск падений, и развитие инфекций мочевыводящих путей, особенно у пациентов с недержанием мочи. Назначение арГПП-1 зачастую сопровождается снижением аппетита и диспепсией, что может быть нежелательно при риске развития мальнутриции. Снижение массы тела, которое обычно рассматривается как положительный эффект препаратов этой группы, у пожилых пациентов может быть нежелательным ввиду риска потери мышечной массы и ухудшения функционального статуса. Наиболее перспективными в этой популяции представляются иДПП-4, единственным недостатком которых является умеренный сахароснижающий эффект, которого тем не менее может быть достаточно у исходно перелеченных пациентов [7].
Физическая активность обследованных представляется крайне низкой. Лишь треть из них регулярно совершали прогулки. Зарядку делали меньше четверти пациентов. Отчасти это может быть связано с последствиями эпидемии COVID-19. С марта 2020 г. по март 2021 г. ДВС работал в закрытом режиме (до завершения вакцинации от COVID-19). Групповые занятия лечебной физкультурой не проводились.
Повышение физической активности пациентов может рассматриваться как один из компонентов успешного депрескрайбинга сахароснижающей терапии.
Обсуждения также заслуживает сопутствующая терапия, в первую очередь антиагрегантная и гиполипидемическая. Антиагрегантная терапия представляется избыточной и может рассматриваться как поле для депрескрайбинга. Гиполипидемическая терапия, наоборот, реализована в недостаточном объеме. Так, статины получали 8 из 18 пациентов вне терминальных состояний с нецелевым уровнем ЛПНП. Необходимо отметить, что применение статинов уменьшается по мере увеличения возраста пациентов и в общемировой практике, что связано как с более редким назначением этого класса препаратов врачами, так и со снижением приверженности пациентов терапии. Тем не менее пожилым пациентам с АССЗ статины рекомендуются в том же формате, что и более молодым, несмотря на меньшую доказательную базу в отношении их влияния на долгосрочные исходы у лиц старше 75 лет [9].
Наше исследование было одноцентровым, проведенным на небольшой выборке и в учреждении с нетипичной для домов престарелых организацией жизни. ДВС в большей степени соответствовал уровню пансионата с возможностью получения постоянной медицинской помощи. Выбор учреждения был продиктован готовностью и желанием администрации постоянно улучшать качество оказания медицинской помощи.
Очевидным ограничением исследования являются как маленький размер выборки, что значимо влияет на статистическую обработку данных, так и невозможность экстраполировать полученные результаты на учреждения с иной организацией медицинской помощи и иным контингентом пациентов, в связи с чем необходимы дальнейшие исследования в более крупных центрах.
В то же время наше исследование способствовало внесению некоторых изменений в работу учреждения. Так, после проведения исследования врачам и пациентам были предложены варианты коррекции сахароснижающей терапии. В частности, одной пациентке, получавшей инсулин, успешно осуществлен депрескрайбинг. Всем участникам было рекомендовано применение холекальциферола в профилактических дозах, а у пациентки с остеопорозом возобновлена антиостеопоротическая терапия.
Заключение
Лица с СД, проживающие в ДВС, представляют собой гетерогенную группу как с гериатрической, так и с диабетологической точек зрения. Ведение таких пациентов требует тесного взаимодействия терапевтов, гериатров и эндокринологов, так как при определении целей лечения СД и выборе методов их достижения следует учитывать как особенности пациентов, так и профиль безопасности сахароснижающих препаратов.
Для разработки последующих клинических рекомендаций необходимо продолжать работу по комбинированной эндогериатрической оценке проживающих в домах престарелых.
A.V. Balashova, I.V. Glinkina, PhD, V.V. Fadeev, MD, PhD, Corresponding member of the RASci., A.V. Oderiy, A.S. Shyman, A.V. Suchkov, PhD, N.N. Gromova
I.M. Sechenov First Moscow State Medical University
Moscow State Budgetary Institution Honored Theatre Workers Nursing Home named of A.A. Yablochkina, Moscow
Contact person: Anastasia V. Balashova, nasta6koklina@mail.ru
Elderly patients with type 2 diabetes mellitus (DM) living in long-term care facilities are an unexplored group. In this pilot cross-sectional study all patients with previously diagnosed type 2 DM living in the A.A. Yablochkina House of Veteran Stage were included. The study was completed in april 2021. Medical records analysis, comprehensive geriatric assessment, and patients interviewing were performed. The data were processed in the IBM SPSS Statistics 26 program. Twenty one patients had previously diagnosed DM (25.3% of all residents). The mean age was 83 (73–87) years, 66.7% were women. Functional dependence was found in two-thirds of participants, severe cognitive impairment was in every fourth. The group were highly comorbid (11 (7–12) diagnosis) with average 7 (8–10) drugs taken.
Actual HbA1c level was significantly below the individual target value with average level 6.4 (5.5–7.2) % that was achieved on 1–2 antidiabetic drugs (52.0% received metformin, 43.0% sulfonylureas, 28.6% basal insulin). Hypoglycemia episodes were reported by one-third respondents.
The most urgent diabetic clinical task in this group is the implementation of controlled deprescribing of hypoglycemic therapy.
Due to the small sample size, further work on combined endocrinological and generiatric evaluation in the elderly in nursing homes is needed. The data obtained may be useful in the development of appropriate clinical guidelines.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.