К вопросу лечения интоксикации и диарейного синдрома при коронавирусной инфекции
- Аннотация
- Статья
- Ссылки
- English

Возбудителем новой коронавирусной инфекции COVID-19 является одноцепочечный РНК-вирус SARS-CoV-2, который таксономически относится к роду Betacoronavirus. На начальном этапе заражения SARS-CoV-2 проникает в клетки, экспрессирующие рецепторы ангиотензинпревращающего фермента 2-го типа (ACE-2). Основной мишенью являются альвеолярные клетки 2-го типа легких. Однако рецепторы ACE-2 представлены также на клетках дыхательного тракта, почек, пищевода, мочевого пузыря, подвздошной кишки, сердца, центральной нервной системы [1, 2]. К типичным клиническим проявлениям COVID-19 относятся лихорадка, респираторные симптомы, двусторонняя пневмония, в 3–4% случаев развивается острый респираторный дистресс-синдром. В то же время у ряда пациентов наблюдаются желудочно-кишечные проявления с диареей, рвотой и болью в животе [3].
Клетки кишечного эпителия человека также восприимчивы к вирусу и могут поддерживать устойчивую вирусную репликацию [4]. Так, у пациента 34 лет с острым респираторным дистресс-синдромом коронавирусного генеза электронная микроскопия биоптатов и аутопсийных образцов показала активную вирусную репликацию как в тонкой, так и в толстой кишке [5].
В одном случае выявленного в Соединенных Штатах COVID-19 35-летний мужчина поступил в стационар с тошнотой и рвотой, на второй день госпитализации появились дискомфорт в животе и диарея. На седьмой день болезни в стуле пациента была обнаружена РНК SARS-CoV-2 [6].
В других исследованиях РНК SARS-CoV-2 выявлена в анальном канале или на ректальных тампонах [7, 8] и образцах стула [6, 9, 10] даже после прекращения определения вируса в верхних дыхательных путях [7, 8]. Эти факты позволяют предположить, что при COVID-19 коронавирус SARS-CoV-2 способен проникать в организм человека, поражая эпителиоциты желудочно-кишечного тракта (ЖКТ). Подобная тропность к ЖКТ может объяснить частое возникновение диареи при коронавирусной инфекции. Это имеет значение для эпидемиологического контроля, диагностики и тактики лечения.
Исходя из известных патогенетических механизмов COVID-19, общих и для других заболеваний, сопровождающихся синдромом диареи, целесообразно в схему лечения включать современные кишечные адсорбенты [11].
На конкретных примерах рассмотрим важные желудочно-кишечные аспекты коронавирусной инфекции COVID-19, влияющие на подходы к тактике лечения и предупреждения распространения инфекции.
Желудочно-кишечные симптомы на фоне COVID-19
В крупном исследовании, учитывавшем данные о 1099 пациентах из 552 больниц Китая, сообщалось о тошноте или рвоте у 55 (5,0%) и диарее у 42 (3,8%) пациентов [12].
Результаты исследования других групп пациентов показали частоту диареи, тошноты и/или рвоты в пределах 10% [13–17]. В когорте из 140 COVID-19-положительных пациентов в Ухане желудочно-кишечные симптомы отмечались у 39,6% [18], в том числе тошнота у 24 (17,3%), диарея у 18 (12,9%) и рвота у 7 (5,0%) пациентов.
Аналогичные данные получили F. Xiao и соавт. (2020 г.): частота диареи достигла 35,6% в группе из 73 пациентов [1]. Эти показатели были выше, чем в некоторых других когортах, и указывали на вариабельность клинической картины. В то же время боль в животе или дискомфорт встречались редко [6] – 2,2–5,8% случаев [17, 18].
L. Yang и L. Tu (2020 г.), проанализировав данные литературы и собственные данные, установили, что до 10% пациентов с коронавирусом имеют лишь желудочно-кишечные симптомы [19]. Это затрудняет диагностику и затягивает срок установления диагноза, что негативно сказывается как на самих пациентах, так и на их окружении.
Диарея может быть одним из первых симптомов, иногда возникает раньше, чем фебрилитет или респираторные симптомы [15, 17]. Гастроинтестинальные симптомы у некоторых пациентов могут наблюдаться на протяжении всего периода заболевания, в ряде случаев из респираторного тракта вирус уже не выделяется, но его обнаруживают в фекалиях.
Подобно взрослым желудочно-кишечные симптомы зарегистрированы у 171 ребенка с COVID-19, диарея и рвота у 15 (8,8%) и 11 (6,4%) детей соответственно [16].
В исследовании Y. Xu и соавт. диарея наблюдалась у трех из десяти инфицированных детей [8]. Хотя у детей с COVID-19 описано более мягкое течение заболевания [16] и менее выраженные респираторные проявления [8], желудочно-кишечные симптомы, по-видимому, такие же, как у взрослых. Но, чтобы сделать окончательные выводы, необходимы дальнейшие наблюдения.
По нашим данным, в группе из 87 пациентов с COVID-19, получавших лечение в условиях вновь созданного подразделения для ведения больных COVID-19 на базе ФГБУ «3-й Центральный военный клинический госпиталь (ЦВКГ) им. А.А. Вишневского» Минобороны России, диарейный синдром наблюдался у 28,7% пациентов. Все они были госпитализированы с клиническими симптомами внебольничной пневмонии средней и тяжелой степени. У 9,3% пациентов имели место диспепсические жалобы (тошнота, извращение вкуса, аносмия, горечь во рту). Причиной возникновения диспепсии и диарейного синдрома, вероятно, может быть не только непосредственное влияние коронавируса SARS-CoV-2 на эпителиоциты ЖКТ, но и побочные эффекты проводимой терапии.
Клинический случай 1
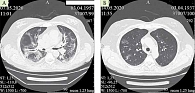
Пациент Б., 1957 г.р., поступил в отделение подразделения для ведения больных COVID-19 2 мая 2020 г. Анамнез заболевания: 29 апреля 2020 г. отметил повышение температуры тела до 38 °С, выраженную слабость. Анализ крови на ПЦР COVID-19 положительный, компьютерная томография (КТ) органов грудной клетки (ОГК) от 29 апреля 2020 г. – картина вирусной пневмонии. Объем поражения легочной паренхимы – 5%. КТ-1. Принимал азитромицин, лечился амбулаторно. 1 мая 2020 г. отмечалось ухудшение самочувствия – нарастание интоксикационного синдрома, перебои в работе сердца. Госпитализирован в отделение реанимации и интенсивной терапии вновь созданного подразделения для лечения коронавирусной инфекции COVID-19 ФГБУ «3-й ЦВКГ им. А.А. Вишневского» Минобороны России. На электрокардиограмме (ЭКГ) – частая наджелудочковая экстрасистолия, преходящая СА-блокада 2-й степени. 7 мая 2020 г. выполнена КТ – отрицательная динамика – картина умеренно выраженных типичных проявлений двусторонней вирусной пневмонии – КТ-2 (10 баллов, 40%) (рис. 1).
Данные лабораторного обследования: лейкопения – 3,45 тыс. в мкл, лимфоциты – 0,57 тыс. в мкл, фибриноген – 5,9 г/л, D-димер – 172 нг/мл, С-реактивный белок (СРБ) – 172 мг/л. Назначены Плаквенил, комбинированная антибактериальная терапия: левофлоксацин, Меронем. После стабилизации общего состояния 2 мая 2020 г. для дальнейшего лечения переведен в отделение для лечения больных новой коронавирусной инфекцией COVID-19. При переводе ЭКГ показала синусовый ритм, отсутствие нарушений ритма. 5 мая 2020 г. появилась диарея – жидкий малообъемный стул до десяти раз в день без патологических примесей. Состояние расценивалось как антибиотик-ассоциированная диарея, но из-за пневмонической инфильтрации антибактериальная терапия была продолжена. Назначена диета 4, Энтеросгель три дозы в сутки, Линекс, инфузионная регидратационная терапия. Через восемь дней лечения состояние улучшилось (нормализация температуры тела, урежение стула до двух-трех раз в день, уплотнение его консистенции).
Клинический случай 2
Пациент И., 1972 г.р., заболел 17 апреля 2020 г. после контакта с больным COVID-19. Отмечались лихорадка до 38,5 °С, общая слабость, сухой и редкий кашель, чувство нехватки воздуха при минимальной нагрузке. ПЦР: РНК COVID-19 положительная, КТ ОГК от 21 апреля 2020 г. – КТ-1. Госпитализирован в отделение для ведения больных COVID-19. Анализ крови: лейкоциты – 4,44 тыс. в мкл, лимфоциты – 1,88 тыс. в мкл, СРБ – 24 мг/л. Назначены Плаквенил, азитромицин, отхаркивающие и жаропонижающие средства. На контрольной КТ ОГК от 30 мая 2020 г. зафиксирована отрицательная динамика. Тяжесть КТ-2. Усилена проводимая терапия, назначен препарат Калетра. Отмечалось появление диареи (учащение стула до трех-четырех раз в день). Состояние расценивалось как побочный эффект Калетры. К терапии добавили сорбенты (Энтеросгель), пробиотики (Энтерол) в стандартной дозе. На фоне проводимого лечения стул нормализовался, наблюдалась тенденция к запору.
Поражение печени у пациентов с COVID-19
Помимо желудочно-кишечных симптомов у пациентов с COVID-19 может отмечаться поражение печени, на что указывает повышение уровня ферментов в анализах крови. Хотя механизм поражения печени до конца не изучен, можно предположить, что это вызвано как прямым повреждением печени с поражением гепатоцитов SARS-CoV-2, так и развитием патологических иммунных механизмов или гепатотоксичностью препаратов [20]. Предполагается также, что вирус способен связываться с холангиоцитами через рецептор ACE-2, вследствие чего нарушается регуляция функции печени [21]. При этом каких-либо вирусных включений в печени не обнаруживается. Остается открытым вопрос, способна ли собственно атипичная пневмония (COVID-19) неблагоприятно воздействовать на печень и какие еще механизмы задействованы в ее повреждении.
По данным литературы, почти у 50% больных COVID-19 в период заболевания наблюдали аномальные уровни аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) с незначительным повышением в сыворотке крови билирубина [12–14, 17, 22]. В комментарии, описывающем 56 пациентов с COVID-19, повышенный уровень гамма-глутамилтранспептидазы отмечался у 54% из 28 пациентов. В большинстве случаев поражения печени носят легкий и преходящий характер, но не исключены и серьезные осложнения. Доля повреждений печени выше у пациентов с тяжелой формой COVID-19 [12, 14].
В группе из 99 пациентов в Ухане 43 пациента имели повышенный уровень АЛТ или АСТ. У одного из них с критическим COVID-19 зарегистрирован тяжелый гепатит С с повышением уровня АЛТ в сыворотке до 7590 ЕД/л [13].
Согласно собственным данным, повышение уровня трансаминаз не более двух-трех норм зафиксировано у 4,6% больных COVID-19, получавших лечение по поводу пневмонии среднетяжелого и тяжелого течения в нашем стационаре. Уровень билирубина во всех случаях оставался нормальным.
В частности, мы наблюдали успешный исход лечения у пациентки с симптомами поражения печени на фоне COVID-19.
Клинический случай 3
Больная Б., 43 лет. В середине марта 2020 г. появились катаральные изменения в глотке, субфебрильная температура, лечилась амбулаторно. Ухудшение состояния отмечалось 21 апреля 2020 г. – появились чувство нехватки воздуха, выраженная общая слабость, редкий сухой кашель, послабление стула, урчание в животе. 24 апреля 2020 г. у мужа больной выявлен положительный анализ ПЦР на COVID-19. В тот же день пациентке выполнена КТ ОГК: картина вирусной двусторонней нижнедолевой пневмонии, КТ-2. Госпитализирована в инфекционное отделение ФГБУ «3-й ЦВКГ им. А.А. Вишневского» Минобороны России. Мазок из зева ПЦР на COVID-19 положительный. Известно, что пациентка без отягощенного преморбидного фона, имеет нормальный индекс массы тела, постоянной медикаментозной терапии не получает. Употребление алкоголя отрицает. Маркеры гепатитов B и C отрицательные. При поступлении в стационар в биохимическом анализе крови – уровень трансаминаз, в 2,5 раза превышающий норму, концентрация билирубина в норме. Ультразвуковое исследование (УЗИ) органов брюшной полости – патологии печени не выявлено.
Проведена терапия, согласно Временным методическим рекомендациям Минздрава России по лечению коронавирусной инфекции COVID-19 (версия 6.0), – Плаквенил, азитромицин, а также патогенетическая терапия (Флуимуцил, Энтеросгель, Энтерол, парацетамол при повышении температуры тела).
В результате проводимого лечения, по данным КТ ОГК, пневмония разрешилась, повторный мазок из зева – дважды отрицательный. При динамическом лабораторном наблюдении – нормализация уровня трансаминаз на шестые сутки лечения. Стул нормализовался на седьмые сутки лечения.
Клинический случай 4
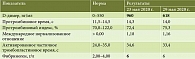
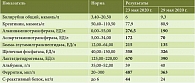
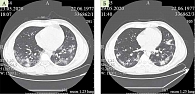
Пациент С., 41 год. При госпитализации жалобы на непродуктивный кашель, повышение температуры тела в вечерние часы до фебрильных цифр с ознобом, снижение обоняния, вкуса, головную боль. Заболел за четыре дня до госпитализации. Амбулаторное лечение – без эффекта. В 2017 г. диагностирован хронический гепатит C – РНК HCV положительный (3а генотип), в 2018 г. – безынтерфероновая противовирусная терапия (софосбувир 400 мг + даклатасвир 60 мг) – 12 недель, с достижением устойчивого вирусологического ответа. Пациент госпитализирован. КТ ОГК – картина двусторонней полисегментарной вирусной пневмонии. Объем поражения – КТ-2. Анализ крови: лимфопения, повышение D-димера и фибриногена. Умеренное повышение уровня сывороточных трансаминаз (до пяти норм) и маркеров холестаза. Повышение СРБ и ферритина (табл. 1–3). Методом ПЦР вирус гепатита C не выявлен. Aнти-HCV обнаружен 23 мая 2020 г. Таким образом, у пациента наблюдалась картина гепатита умеренной степени активности с синдромом холестаза, без нарушения функции печени. На вторые сутки госпитализации появились дискомфорт в правом подреберье, тошнота, неоформленный стул до трех-четырех раз в день. УЗИ брюшной полости: эхографические признаки диффузных изменений паренхимы печени и поджелудочной железы. Плотность печени (эластография сдвиговой волны): 7,8 кПа (F2). 23 мая 2020 г. КТ ОГК в динамике через шесть дней: в обоих легких полисегментарно, по периферии, преимущественно в нижних долях, сливные участки уплотнения легочной ткани по типу матового стекла в сочетании с ретикулярным компонентом и консолидацией. Поражение легочной ткани до 50%. Заключение: КТ-картина двусторонней полисегментарной вирусной пневмонии (в том числе COVID-19). КТ-2. Отрицательная динамика. То есть у пациента с патологическими изменениями печеночных ферментов имело место затяжное течение вирусной пневмонии. Анализ крови показал разрешение лимфопении, тенденцию к снижению D-димера. Умеренное уменьшение сывороточных трансаминаз (до двух-трех норм) и положительная динамика маркеров холестаза. Хорошая динамика снижения СРБ (с 44 до 24 мг/л) и ферритина (с 487 до 363 мкг/л). Электролиты в норме. Таким образом, степень активности гепатита с умеренной уменьшилась до незначительной без нарушения функции печени. Полностью разрешились явления кишечной диспепсии. К ранее назначенной терапии (Плаквенил, азитромицин, Фрагмин, Флуимуцил, левофлоксацин) были добавлены Энтеросгель, омепразол, Энтерол. В связи с отрицательной КТ-динамикой на шестой день терапии назначили Калетру. На фоне терапии полностью разрешились явления диспепсии: прекратилась тошнота, вздутие и болезненность в животе, нормализовалась кратность стула (один-два раза в сутки), консистенция – между кашицеобразным и оформленным без патологических примесей. КТ ОГК от 29 мая 2020 г.: положительная динамика течения вирусной пневмонии. КТ-стадия стабилизации/рассасывания (рис. 2).
Подходы к терапии гастроэнтерологических симптомов COVID-19
Согласно Временным методическим рекомендациям Минздрава России, на сегодня нет доказательств эффективности применения при COVID-19 каких-либо лекарственных препаратов этиотропного действия [23]. Кроме того, некоторые назначаемые антимикробные и противовирусные средства обладают гепато- и энтеротоксическими эффектами, которые сами по себе требуют коррекции.
Патогенетическая терапия предполагает использование достаточного количества жидкости (2,5–3,5 л в сутки и более, если нет противопоказаний по соматической патологии). При выраженной интоксикации, а также дискомфорте в животе, тошноте и/или рвоте, отечном синдроме, препятствующих употреблению жидкости, показаны энтеросорбенты (диоксид кремния коллоидный, полиметилсилоксана полигидрат и др.).
Среди известных лекарственных средств патогенетической терапии преимущество имеют современные кишечные сорбенты, поскольку они воздействуют одновременно на различные механизмы коронавирусной инфекции. Речь, в частности, идет о восстановлении энтерогематического барьера за счет регенерации слизистой оболочки, снижении повышенного уровня эндотоксина в крови, нормализации дисбиоза кишечника. Энтеросорбенты – препараты несистемного действия, не всасываются из кишечника в кровь, поэтому в отличие от антимикробных средств не обладают гепато- и нефротоксическим эффектом. Более того, они сорбируют избыток эндотоксина и демонстрируют эффективность в купировании проявлений лекарственного гепатита на фоне использования антимикробных средств.
К преимуществам современного энтеросорбента полиметилсилоксана полигидрата (Энтеросгель) по сравнению с классическими, на основе угля и глины, следует отнести гидрофобность, что проявляется в значительно меньшей степени обезвоживания (эксикоза) при их применении [24]. Кроме того, в отличие от диоксида кремния мелкодисперсного полиметилсилоксана полигидрат, по меньшей мере в исследованиях in vitro, не вызывал лизиса нормофлоры, например Escherichia coli [25], и при этом способствовал подавлению роста Staphylococcus aureus и продукции энтеротоксина [26].
В поддержку использования современных энтеросорбентов говорят результаты многочисленных клинических исследований, проведенных в России и за рубежом, которые были приведены в наших обзорах [27, 28]. Так, у 46 пациентов, получавших антиретровирусную терапию по поводу ВИЧ-инфекции, достоверно сокращались сроки нормализации стула (прекращения диареи) в результате терапии с использованием полиметилсилоксана полигидрата [29]. У 61 пациента с острым вирусным гепатитом B и сопутствующим дисбактериозом кишечника на фоне применения Энтеросгеля удалось быстрее купировать симптомы интоксикации и нормализовать дисбиоз [30].
Кроме того, в Великобритании завершилось исследование, которое продемонстрировало эффективность и безопасность полиметилсилоксана полигидрата в амбулаторном лечении острой диареи у взрослых, прежде всего в виде сокращения продолжительности сроков нормализации стула [31]. Опубликованы промежуточные результаты исследования, которые также показали эффективность подобной терапии. Терапия с использованием полиметилсилоксана полигидрата при синдроме раздраженного кишечника с диареей сопровождалась купированием симптомов боли и нормализацией стула [32].
Заключение
В комплексной терапии коронавирусной инфекции, вызванной COVID-19, при возникновении гастроинтестинальных симптомов и повышении уровня печеночных трансаминаз представляется целесообразным применение современных энтеросорбентов, например полиметилсилоксана полигидрата в стандартной дозе 22,5 г (один пакет, или 1,5 столовой ложки) три раза в сутки. С учетом механизма действия препарата его использование может способствовать более быстрому купированию диареи, уменьшению интоксикационного синдрома и нормализации уровня трансаминаз.
A.I. Pavlov, PhD, A.V. Khovanov, PhD, V.E. Bakirova, PhD, Zh.V. Fadina, A.K. Khavanshanov, N.M. Olshanskaya
A.A. Vishnevsky 3rd Central Military Clinical Hospital
Moscow State University of Food Production
TNK SILMA, LLC
Contact person: Aleksandr I. Pavlov, doctor-pavlov@mail.ru
With coronavirus infection, gastrointestinal manifestations with diarrhea, vomiting and abdominal pain are often noted. This is due to the susceptibility of the intestinal epithelium to the virus due to the expression of ACE2 receptors. In addition, elevated liver enzymes may occur in patients with COVID-19. Presumably, this can be caused both by direct damage to the liver with damage to SARS-CoV-2 hepatocytes, and by the development of pathological immune mechanisms or hepatotoxicity of drugs. In the event of gastrointestinal symptoms and an increase in hepatic transaminases, it seems appropriate to use modern enterosorbents in the complex therapy of coronavirus infection caused by COVID-19, such as polymethylsiloxane polyhydrate. Given the mechanisms of action of this drug, its use can contribute to a more rapid relief of diarrhea, a decrease in intoxication syndrome and normalization of transaminases.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.