Оценка корреляции выраженности портальной гипертензии и концентрации кишечного эндотоксина у пациентов с алкогольной болезнью печени
- Аннотация
- Статья
- Ссылки
- English
Цель – оценить корреляцию выраженности портальной гипертензии при АБП и концентрации кишечного эндотоксина сыворотки крови, а также потенциальное влияние полиметилсилоксана полигидрата на уровень эндотоксина в комплексной терапии АБП.
Результаты. Повышение уровня кишечного эндотоксина можно рассматривать как важное патогенетическое звено в развитии портальной гипертензии и ее осложнений у больных алкогольным гепатитом, которое требует обязательной коррекции. Назначение сорбентов, в том числе полиметилсилоксана полигидрата, является перспективным и патофизиологически ориентированным методом лечения.
Цель – оценить корреляцию выраженности портальной гипертензии при АБП и концентрации кишечного эндотоксина сыворотки крови, а также потенциальное влияние полиметилсилоксана полигидрата на уровень эндотоксина в комплексной терапии АБП.
Результаты. Повышение уровня кишечного эндотоксина можно рассматривать как важное патогенетическое звено в развитии портальной гипертензии и ее осложнений у больных алкогольным гепатитом, которое требует обязательной коррекции. Назначение сорбентов, в том числе полиметилсилоксана полигидрата, является перспективным и патофизиологически ориентированным методом лечения.
Алкогольная болезнь печени (АБП) является ведущим этиологическим фактором цирроза печени и основной причиной смерти от заболеваний печени в мире. Помимо этого АБП может способствовать прогрессированию фиброза при хроническом вирусном гепатите, неалкогольной жировой болезни и других заболеваниях печени [1].
Клинические формы АБП включают алкогольный стеатоз, алкогольный гепатит различной степени тяжести, алкогольный цирроз печени и алкогольный цирроз печени, осложненный гепатоцеллюлярной карциномой. Выделяют также острый алкогольный гепатит на фоне хронической патологии печени. Прогрессирование заболевания зависит от количества и длительности употребления алкоголя и других факторов риска (женский пол, генетическая предрасположенность, стиль приема алкоголя, этническая принадлежность, наличие сопутствующих заболеваний печени и т.п.) [2–4].
Безусловно, основа лечения АБП – отказ от употребления алкоголя. При тяжелом алкогольном гепатите терапия направлена на предотвращение осложнений, таких как энцефалопатия, сепсис, трофологическая недостаточность и портальная гипертензия. Несмотря на успехи в изучении патогенеза, единственным терапевтическим средством, влияющим на выживаемость больных тяжелым алкогольным гепатитом, остаются глюкокортикостероиды [5]. Но и на терапию этими препаратами, к сожалению, отвечают не все пациенты. Это обусловливает необходимость разработки новых патофизиологически ориентированных методов лечения [6].
Одним из патогенетических звеньев АБП является повышенная проницаемость кишечной стенки, а также эндотоксемия. Как известно, нормальная микробиота кишечника способна стимулировать иммунную систему желудочно-кишечного тракта и уменьшать количество патогенных микроорганизмов, конкурируя за питательные вещества и пространство [7, 8]. На состав микробиоты влияют также экзогенные факторы – диета, алкоголь и лекарственные препараты [9, 10]. Хроническая этаноловая интоксикация приводит к изменению состава кишечной микрофлоры. Кроме того, этанол и ацетальдегид непосредственно воздействуют на кишечные эпителиальные плотные соединения, увеличивают проницаемость кишечного эпителиального барьера и способствуют транслокации бактерий и эндотоксемии [11–13]. Заболевания печени, в частности АБП, также ассоциированы с изменениями в микробиоте кишечника, что в свою очередь влияет на прогрессирование стеатоза печени, воспаления и фиброза [14–17]. Важную роль в патогенезе изменений микробиоты кишечника при АБП играют сниженная секреция желчных кислот и нарушение моторики кишечника [18, 19]. Портальная гипертензия, развивающаяся при АБП, может усугублять отек кишечной стенки, нарушение целостности эпителия и эндотоксемию [20]. Чтобы подчеркнуть тесную анатомическую и функциональную взаимосвязь между обоими органами, введен термин «ось „кишечник – печень“» [7].
Изменение состава микробиоты кишечника, повышенная проницаемость кишечной стенки, а также печеночно-ассоциированный иммунодефицит приводят к эндотоксемии и бактериальной транслокации у больных АБП [21, 22]. Как следствие – гиперстимуляция клеток Купфера – резидентных печеночных макрофагов, высвобождение провоспалительных цитокинов и прогрессирование воспаления в печени [22].
Наиболее изученным патоген-ассоциированным молекулярным паттерном кишечника считается бактериальный эндотоксин – липополисахарид, находящийся во внешней мембране грамотрицательных бактерий. Не случайно выраженность эндотоксемии обычно оценивают по его сывороточному уровню. Помимо внутрипеченочных эффектов повышенный уровень циркулирующего эндотоксина может играть роль в системном воспалительном ответе и осложнениях цирроза печени и алкогольного гепатита, таких как асцит, портальная гипертензия с кровотечением из варикозно расширенных вен пищевода и желудка и печеночная энцефалопатия [6, 23–25].
Целью исследования стала оценка корреляции выраженности портальной гипертензии при АБП (алкогольный гепатит и алкогольный цирроз) и концентрации кишечного эндотоксина сыворотки крови, а также потенциального влияния полиметилсилоксана полигидрата (ПМСПГ) на уровень эндотоксина в комплексной терапии АБП.
Материал и методы
В исследование было включено 118 пациентов – 54 (45,8%) с алкогольным гепатитом и 64 (54,2%) – с алкогольным циррозом. Из них 98 мужчин (46 с гепатитом, 52 с циррозом печени), 20 женщин (восемь с гепатитом, 12 с циррозом печени). Медиана возраста составила 59,7 года (медиана возраста пациентов с гепатитом – 52,7 года, циррозом печени – 62,1 года). Оценивались осложнения АБП: печеночная энцефалопатия различной стадии (от латентной до печеночной комы) – 93 (78,8%), асцит – 73 (61,8%), спленомегалия – 82 (69,5%), варикозное расширение вен пищевода – 64 (54,2%), гиперспленизм – 57 (48,3%), спонтанный бактериальный перитонит – 9 (7,6%), гепаторенальный синдром – 19 (16,1%) пациентов.
Диагностику гепатита и цирроза печени проводили на основании клинико-лабораторных и инструментальных данных, согласно стандартам оказания медицинской помощи гастроэнтерологическим больным (у 27 пациентов цирротическая трансформация верифицирована при гистологическом исследовании). Алкогольный генез заболевания подтвержден анамнестическими данными, беседами с родственниками пациентов, а также результатами анкетирования современными опросниками (AUDIT, анкета ПАС). Асцит и спленомегалия диагностированы при ультразвуковом исследовании, компьютерной и магнитно-резонансной томографии органов брюшной полости, варикозное расширение вен пищевода и желудка – при эзофагофиброгастродуоденоскопии.
Спонтанный бактериальный перитонит диагностирован в девяти случаях на основании клинической симптоматики и результатов исследования асцитической жидкости (количество нейтрофилов в 1 мм3 более 250, положительный/отрицательный результат посева).
Гепаторенальный синдром выявлен у 19 больных, согласно стандартным диагностическим критериям [26].
Случайным образом пациенты с АБП двух групп (алкогольный гепатит и алкогольный цирроз) были разделены на две подгруппы. Пациенты основной подгруппы в комплексной терапии получали ПМСПГ (Энтеросгель) в стандартной дозе 15 г три раза в день между приемами пищи, пациенты контрольной – только стандартную комплексную терапию.
Таким образом, пациенты с алкогольным гепатитом были разделены на две равные подгруппы (n = 27), а пациенты с циррозом печени – на подгруппу ПМСПГ (основную) (n = 34) и контрольную (n = 30).
Изучалась концентрация эндотоксина сыворотки крови с применением ЛАЛ-теста, основанного на способности белкового лизата циркулирующих амебоцитов краба Lumulus polyphemus (Limulus Amebocyte Lysate – LAL) сворачиваться (превращаться в гель) при инкубации с эндотоксином. В результате реакции эндотоксина и продуктов расщепления клеток крови мечехвостов-амебоцитов (лизата) мутнеет прозрачная реакционная смесь или образуется плотный гель, что и служит индикатором наличия эндотоксина. Реакция проста, и для ее реализации не требуется много времени, ответ может быть получен через 30–60 минут. Положительным результатом реакции для каждой повторности является наименьшая концентрация сывороточного эндотоксина с образованием фракталов. На основании этих результатов рассчитывается среднее геометрическое значение чувствительности ЛАЛ-реактива. Исследования выполнялись при поступлении пациента в стационар и через две недели лечения. В случае ухудшения состояния пациента проводились промежуточные исследования уровня эндотоксина.
Результаты и обсуждение
У пациентов с алкогольным гепатитом уровень эндотоксина при поступлении в стационар был достоверно выше, чем у пациентов с алкогольным циррозом, что, вероятно, обусловлено, во-первых, большей выраженностью системного воспаления у больных данной группы, во-вторых, недавним злоупотреблением алкоголем и, как следствие, воздействием этанола и ацетальдегида на кишечные эпителиальные плотные контакты, усиливающее эндотоксемию.
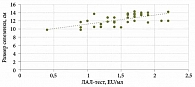
Выявлена прямая положительная корреляция между уровнем кишечного эндотоксина и увеличением размера селезенки в группе больных алкогольным гепатитом (рис. 1).
Такая корреляция была расценена нами как формирование у категории больных с более высоким уровнем эндотоксина транзиторной портальной гипертензии, при которой изменение кровотока в воротной вене приводило к отеку кишечной стенки, нарушению целостности эпителия и нарастанию эндотоксемии.
В ряде ранних исследований было показано, что высокий уровень эндотоксина в сыворотке крови при поступлении в стационар коррелирует с тяжестью алкогольного гепатита, служит прогностическим фактором развития внутрибольничной инфекции, а также ответа на терапию глюкокортикостероидами [6, 23–25]. На животных моделях было показано, что внутрибрюшинное введение эндотоксина повышает портальное давление, вследствие чего увеличивается проницаемость кишечной стенки [27–29].
Согласно результатам других исследований, бактериемия и эндотоксемия могут быть кофакторами нарастания портальной гипертензии и рецидивов кровотечения из варикозно расширенных вен пищевода и желудка [30].
То обстоятельство, что повышенный уровень эндотоксина в крови является следствием повышенной проницаемости кишечной стенки и избыточного роста патогенной микрофлоры, которые ведут к транслокации бактерий и эндотоксина, положило начало попыткам применения при АБП антибиотиков и пробиотиков. У больных алкогольным циррозом при использовании пробиотика VSL № 3, содержащего три штамма Bifidobacterium spp., четыре штамма Lactobacillus spp. и штамм S. salvarius thermophiles, уменьшалась тяжесть течения болезни и сокращались сроки госпитализации [5, 6, 31]. Назначение при АБП рифаксимина в течение 28 дней снижало системную и портальную эндотоксемию, что ассоциировалось с уменьшением портальной гипертензии. В качестве перспективного метода рассматривается также трансплантация донорского кала [5, 32]. Взаимосвязь между патогенезом цирротического процесса, транслокацией кишечных бактерий и портальным давлением делает ось «кишечник – печень» привлекательной мишенью и для применения бета-блокаторов. Так, показано, что неселективные бета-адреноблокаторы, широко используемые при циррозе печени, способны уменьшать риск транслокации бактерий [7, 33, 34].
Еще один подход заключается в использовании плохо всасываемого из кишечника адсорбирующего материала для связывания токсинов и бактериальных продуктов, что ограничивает их поступление в печень и системное кровообращение. Подтверждением концепции адсорбции в качестве терапевтической стратегии является эффективность холестирамина, связывающего желчные кислоты в просвете кишечника, при лечении зуда. Невсасывающийся дисахарид лактулоза эффективно снижает абсорбцию аммиака в кишечнике и является эффективным средством для лечения пациентов с печеночной недостаточностью. Последние достижения в технологии производства активированного угля привели к разработке синтетических адсорбционных нанопористых углеродов. Показано, что пероральный прием синтетического активированного угля Yaq-001 (Yaqrit Ltd. UK) с заданной пористостью как в микропористом, так и в макропористом диапазоне может снижать транскишечную миграцию бактериальных эндотоксинов. В исследованиях in vitro Yaq-001 удалял преимущественно гидрофобные вещества и вещества с молекулярной массой примерно до 70 кДа. Следовательно, Yaq-001 способен адсорбировать в кишечнике токсины, такие как аммиак, диметиларгинин, ацетальдегид, гидрофобные желчные кислоты, цитокины, например фактор некроза опухоли альфа и интерлейкин 6, а также кишечный бактериальный эндотоксин. Эти наблюдения указывают на потенциал данной неантибиотической адсорбционной стратегии [35, 36].
В многочисленных исследованиях помимо возможностей сорбционного действия in vitro на различных моделях острого и хронического гепатита in vivo продемонстрировано протективное действие ПМСПГ (Энтеросгель) на слизистую оболочку кишечника и печень, направленное на нормализацию уровня эндотоксина в периферической крови [37–41]. Показана эффективность и безопасность ПМСПГ в купировании повреждающего действия как собственно алкоголя, так и его комбинаций с другими токсическими веществами [37]. В связи с этим интерес представляет дальнейшее исследование ПМСПГ в различных схемах комбинированного лечения АБП.
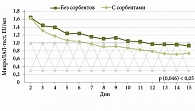
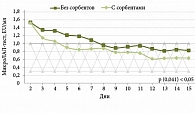
На рисунках 2 и 3 показана динамика снижения уровня эндотоксина у пациентов с АБП (алкогольный гепатит и алкогольный цирроз).
При алкогольном гепатите медиана концентрации эндотоксина при поступлении в стационар составила 1,7 EU/мл (рис. 2). Нормализация уровня эндотоксина у пациентов первой группы, получавших дополнительно ПМСПГ, нормализовалась на шестые сутки, а группе контроля – только на 11-е (p (0,046) < 0,05).
При алкогольном циррозе печени средняя концентрация эндотоксина при поступлении в стационар составила 1,5 EU/мл. Нормализация уровня эндотоксина у пациентов основной группы, получавших дополнительно ПМСПГ, нормализовалась на четвертые сутки, в группе контроля – на восьмые (p (0,041) < 0,05) (рис. 3).
Заключение
Полученные нами результаты подтверждают, что повышение уровня кишечного эндотоксина можно рассматривать как важное патогенетическое звено в развитии портальной гипертензии и ее осложнений у больных АБП, которое требует обязательной коррекции. Назначение сорбентов, в том числе полиметилсилоксана полигидрата, является перспективным и патофизиологически ориентированным методом лечения.
A.I. Pavlov, MD, PhD, V.E. Bakirova, PhD, A.V. Khovanov, PhD, A.K. Khavanshanov, Zh.V. Fadina, A.B. Shames, MD, PhD
A.A. Vishnevsky 3rd Central Military Clinical Hospital
Moscow State University of Food Production
TNK SILMA, LLC
Contact person: Aleksandr I. Pavlov, doctor-pavlov@mail.ru
Alcohol-associated liver disease is the leading etiological factor in liver cirrhosis and the leading cause of death from liver diseases in the world. Despite the success in the study of pathogenesis, to date, the only therapeutic agent that affects the survival of patients with severe alcoholic hepatitis are corticosteroids. But not all patients respond to this therapy. Therefore, there is an urgent need to develop new pathophysiologically oriented treatment methods. One of the pathogenetic links of аlcohol-associated liver disease is increased permeability of the intestinal wall and endotoxemia. A change in the composition of the intestinal microbiota, increased permeability of the intestinal wall, as well as hepato-associated immunodeficiency lead to endotoxemia and bacterial translocation in patients with аlcohol-associated liver disease. This affects the progression of liver disease, the development of a systemic inflammatory response, as well as complications of alcoholic liver disease such as ascites, portal hypertension, and hepatic encephalopathy. Portal hypertension, in turn, can aggravate edema of the intestinal wall, impaired epithelial integrity and increased endotoxemia. The interdependence between the pathogenesis of аlcohol-associated liver disease and endotoxemia makes the gut-liver axis an attractive target for therapeutic intervention. One therapeutic approach is to use absorbent material poorly absorbed from the intestine to bind toxins and bacterial products, which limits their entry into the liver and systemic circulation.
The aim of our study was to evaluate the correlation between the severity of portal hypertension in alcoholic liver disease and serum intestinal endotoxin concentration, as well as the possible effect of polymethylsiloxane polyhydrate on the level of endotoxin in the complex treatment of alcoholic liver disease.
Our results confirm that an increase in the level of intestinal endotoxin can be considered as an important pathogenetic link in the development of portal hypertension and its complications in patients with alcoholic hepatitis, which requires mandatory correction. The appointment of sorbents, including polymethylsiloxane polyhydrate, is a promising and pathophysiologically oriented treatment method.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.