Как остановить прогрессирование структурных изменений при анкилозирующем спондилите
- Аннотация
- Статья
- Ссылки
- English
Объективная оценка рентгенологического прогрессирования и его предотвращение являются важными практическими задачами. В настоящее время в отношении последнего выдвинуто предположение о существовании «окна возможностей».
В статье рассматривается влияние на рентгенологическое прогрессирование АС нестероидных противовоспалительных и биологических противоревматических препаратов, в частности ингибиторов фактора некроза опухоли альфа (ФНО-альфа) и интерлейкина 17А (ИЛ-17А).
Структурно-модифицирующее действие ингибиторов ФНО-альфа доказано в ряде рандомизированных и наблюдательных исследований с большим объемом клинического материала, включая массивные когорты больных. Аналогичный эффект продемонстрировали ингибиторы ИЛ-17А, хотя клинический материал
был менее обширен.
Объективная оценка рентгенологического прогрессирования и его предотвращение являются важными практическими задачами. В настоящее время в отношении последнего выдвинуто предположение о существовании «окна возможностей».
В статье рассматривается влияние на рентгенологическое прогрессирование АС нестероидных противовоспалительных и биологических противоревматических препаратов, в частности ингибиторов фактора некроза опухоли альфа (ФНО-альфа) и интерлейкина 17А (ИЛ-17А).
Структурно-модифицирующее действие ингибиторов ФНО-альфа доказано в ряде рандомизированных и наблюдательных исследований с большим объемом клинического материала, включая массивные когорты больных. Аналогичный эффект продемонстрировали ингибиторы ИЛ-17А, хотя клинический материал
был менее обширен.
Анкилозирующий спондилит (АС), или болезнь Бехтерева, – хроническое воспалительное заболевание неизвестной этиологии с первичным поражением осевого скелета – крестцово-подвздошных суставов (КПС) и вышележащих отделов позвоночника, начинающееся в большинстве случаев в возрасте до 45 лет и ассоциированное с антигеном класса I комплекса гистосовместимости HLA-B27 (определяется в 80–90% случаев) [1]. Проявлениями АС могут быть периферический артрит и энтезит, а также передний увеит, псориаз и воспалительное заболевание кишечника [2]. По разным оценкам, распространенность АС составляет от 0,1 до 1,4% [3]. Заболевание характеризуется активным воспалением в КПС и позвоночнике, которое сопровождается болью и скованностью, на структурном уровне – избыточным образованием новой костной ткани, что приводит к развитию синдесмофитов и анкилоза. Поздними последствиями патологического процесса являются анкилоз КПС и «бамбукообразный» позвоночник. Как следствие, значительные функциональные нарушения. Не случайно патология признана значимой социально-экономической проблемой [4, 5].
Особенности структурного прогрессирования
Для АС характерны такие ключевые патологические признаки, как развитие энтезитов, сакроилеита и спондилита с образованием новой костной ткани и, возможно, костного анкилоза [6]. Поэтому структурное повреждение при АС отличается от структурного повреждения при ревматоидном артрите (РА). В последнем случае процессы остеопролиферации отсутствуют или выражены слабо и преобладает деструкция хряща и костной ткани, сопровождающаяся потерей костной массы и развитием типичных эрозий костей [7, 8]. При этом именно на модели РА можно продемонстрировать значение структурного прогрессирования для определения тяжести состояния независимо от активности болезни [8]. Скорость прогрессирования, с одной стороны, общепризнанный фактор для оценки прогноза [9], с другой – способ верификации эффекта базисных синтетических или биологических противоревматических препаратов в отношении замедления рентгенологического прогрессирования патологии [8]. Эрозивный процесс считается отличительной чертой РА – наблюдается практически у 98% больных [10]. Для оценки прогрессирования заболевания, отражающего кумулятивный ущерб с течением времени, наиболее предпочтительным методом визуализации остается рентгенография [11]. Достоверные рентгенологические изменения рассматриваются как признак необратимого повреждения тканей сустава [10]. Структурное прогрессирование ассоциируется с ухудшением функциональных возможностей больного [12], хотя становится определяющим только на относительно поздних стадиях болезни [13, 14]. Несомненно, быстрое структурное прогрессирование сопровождается выраженной потерей функции [15], а его замедление приводит к более благоприятному функциональному исходу [16–18].
Закономерности, изученные на модели РА, в значительной степени справедливы в отношении АС, несмотря на то что основной патологический процесс при АС (остеопролиферация) в определенной степени противоположен таковому при РА (образование эрозий). Новообразование костной ткани в позвоночнике, в частности появление синдесмофитов между телами позвонков на рентгенограммах, расценивается как признак рентгенографического прогрессирования воспалительного поражения позвоночника [19]. В ряде работ показано, что рентгенологическое прогрессирование и активность заболевания являются двумя основными детерминантами нарушения подвижности позвоночника и функционального статуса при АС [5, 20], так же как при РА. Сохранение высокой воспалительной активности АС ассоциируется с выраженным рентгенологическим прогрессированием. Так, по данным 12-летнего наблюдения 184 больных АС в рамках международной когорты OASIS [21], при оценке активности болезни с помощью Ankylosing Spondylitis Disease Activity Score (ASDAS) [22] и прогрессирования рентгенологических изменений в позвоночнике с помощью модифицированного Stoke Ankylosing Spondylitis Spine Score (mSASSS) [23] установлено, что повышение ASDAS на 1 балл приводило к повышению mSASSS на 0,72 балла за два года. У пациентов с очень высокой активностью АС (ASDAS > 3,5 балла) по сравнению с пациентами с неактивным АС (ASDAS < 1,3 балла) за указанный период отмечалось более быстрое (на 2,31 балла по mSASSS) прогрессирование патологического процесса. Похожие результаты были получены в ходе двухлетнего наблюдения германской когорты спондилоартрита GESPIC [24]: персистенция высокого уровня активности болезни по ASDAS была связана с ускоренным рент- генологическим прогрессированием изменений в позвоночнике. Полученные данные имеют принципиально важное значение для оценки стратегии лечения, поскольку обосновывают применение лекарственных средств, активно подавляющих воспалительный процесс, таких как структурно-модифицирующие препараты, опять же по аналогии с базисными препаратами при РА.
Вопрос о структурно-модифицирующем действии разных групп препаратов при АС более сложен, чем при РА, в первую очередь из-за ряда объективных методических проблем. В данной статье мы фокусируем внимание на рентгенологическом прогрессировании, поскольку именно эта методика оценивает необратимые процессы в структуре костной ткани. Известно, что при АС поражение разных отделов позвоночника (КПС, поясничного, грудного и шейного) может идти разными темпами. Методики оценки рентгенологического прогрессирования в позвоночнике многочисленны и сложны в отличие от методик оценки рентгенологического прогрессирования в периферических суставах [25–27]. Пролиферативные изменения костной ткани нарастают более медленно, чем эрозивный процесс, в связи с чем прогрессирование АС целесообразно оценивать не менее чем за два или более лет наблюдения [28]. Тем не менее внедрение таких методик, как mSASSS [27, 29], и проведение исследований продолжительностью четыре-пять лет позволят сформировать обоснованное мнение в отношении способности лекарственной терапии влиять на прогрессирование АС.
Влияние нестероидных противовоспалительных препаратов
Нестероидные противовоспалительные препараты (НПВП) традиционно широко применяются в качестве первой линии терапии АС [30, 31]. Помимо симптоматического эффекта они обладают антипролиферативным. Среди механизмов последнего указывают модулирующее действие циклооксигеназы 2 (ЦОГ-2) на функцию остеобластов и остеокластов, активацию неоангиогенеза под воздействием ЦОГ-2, в связи с чем ингибирование ЦОГ-2 с помощью НПВП может компенсировать эти процессы [32–34]. Способность НПВП тормозить рентгенологическое прогрессирование при АС была доказана в нескольких исследованиях [27, 35, 36], хотя лишь одно из них было крупным рандомизированным клиническим исследованием [35]. В частности, A. Wanders и соавт. (2005) в ходе двухлетнего наблюдения 215 больных АС установили, что постоянный прием НПВП достоверно эффективнее в отношении рентгенологического прогрессирования, чем прием «по требованию», хотя по клинической эффективности оба режима терапии существенно не различались [35]. Согласно данным Кокрановского обзора, опубликованного в 2015 г. [37], постоянное применение НПВП может уменьшать рентгенологическое прогрессирование. Однако этот вывод базировался на единичных наблюдениях. Кроме того, авторы указали, что он требует подтверждения. Результаты более позднего многоцентрового рандомизированного клинического исследования ENRADAS [38] оказались противоположными. В течение двух лет пациенты получали только НПВП в постоянном режиме в достаточно высокой дозе (диклофенак 150 мг/сут) или в режиме «по требованию». В группе постоянного приема НПВП наблюдалось более выраженное прогрессирование заболевания по mSASSS, в том числе при анализе по подгруппам, в частности у пациентов с высоким С-реактивным белком или синдесмофитами на момент включения в исследование. В российском открытом исследовании [39] на небольшой когорте пациентов (68 больных) продемонстрировано, что в группе постоянного приема НПВП в отличие от группы применения НПВП «по требованию» за два года наблюдения рентгенологическая стадия сакроилеита не повысилась. Однако частота случаев обнаружения активного воспаления в КПС по данным магнитно-резонансной томографии (МРТ) не различалась.
Таким образом, данные о влиянии НПВП на рентгенологическое прогрессирование АС противоречивы. Вероятно, этот вопрос будет решен после получения финальных результатов текущих исследований, в том числе разрабатывающих ситуацию совместного применения НПВП и биологических препаратов [40].
Влияние генно-инженерных биологических препаратов
Большие надежды на улучшение контроля над структурным прогрессированием АС были связаны с генно-инженерными биологическими препаратами (ГИБП) – сначала ингибиторами фактора некроза опухоли альфа (ФНО-альфа) инфликсимабом, этанерцептом, адалимумабом, голимумабом, цертолизумаба пэголом, затем ингибиторами интерлейкина 17А (ИЛ-17А). В настоящее время среди ингибиторов ИЛ-17А активно применяется секукинумаб.
Наибольший опыт применения ГИБП при АС накоплен в отношении ингибиторов ФНО-альфа. Значительное количество клинических исследований подтвердили выраженный клинический эффект этой группы препаратов, а именно быстрое купирование боли, скованности и воспалительной активности у больных АС, резистентных к НПВП и другим синтетическим препаратам (сульфасалазину, метотрексату и др.). В большинстве клинических рекомендаций именно ингибиторы ФНО-альфа наряду с НПВП представлены как препараты выбора при поражении аксиального скелета [31, 41]. Однако результаты первых работ по оценке их структурно-модифицирующего действия были разочаровывающими. Это способствовало формированию мнения, что ингибиторы ФНО-альфа практически не влияют на рентгенологическое прогрессирование (образование новой кости) заболевания как минимум в течение первых двух – четырех лет терапии [41]. В значительной степени это было обусловлено тем, что ранние продленные открытые исследования у пациентов, закончивших участие в протоколах фазы III клинических испытаний, не показали достоверных различий с конт-ролем. Аналогичная информация была представлена в отношении инфликсимаба [42], этанерцепта [43], адалимумаба [44], голимумаба [45]. Эти результаты противоречат данным о выраженном противовоспалительном действии ингибиторов ФНО-альфа при АС (быстрое подавление симптомов и снижение острофазовых лабораторных показателей) и структурно-модифицирующем действии при РА, а также о снижении выраженности активного воспаления в КПС и других отделах позвоночника по данным МРТ [46–50]. При этом в ряде случаев на тех же самых группах пациентов.
Одной из причин может быть то, что в этих рентгенологических исследованиях использовался исторический контроль – данные продленной фазы клинического исследования сравнивали с данными отдельно набранной когорты больных (непрямое сравнение) [51], что является методологической слабостью. Существует мнение, что рентгенологическое прогрессирование не может быть универсальным критерием оценки результатов лечения АС, поскольку оно происходит медленно и может быть применимо только к подгруппе пациентов с плохими прогностическими факторами [52].
Другое объяснение базируется на представлении о воспалительном повреждении костной ткани позвоночника как факторе, стимулирующем избыточную репарацию кости. Несмотря на хроническое воспаление, которое ассоциируется с утратой трабекулярной кости у пациентов с АС, получены доказательства повышения образования кости в периостальном отделе. Это отличается от того, что происходит при РА. При АС начальная фаза резорбции кости может действовать как фактор стресса, который ведет к формированию костной ткани в глубоких эндохондральных слоях вслед за реакцией надкостницы. Данный процесс является основой для формирования остеофитов, в дальнейшем – синдесмофитов и костного анкилоза [51]. Выдвинута гипотеза, что при АС остеопролиферация с ростом остеофитов развивается на фоне воспалительного повреждения костной ткани позвонков в определенные сроки [53]. Поэтому раннее назначение высокоактивной противовоспалительной терапии может затормозить костную пролиферацию, а подавление воспаления на поздних стадиях, наоборот, усилить ее.
Таким образом, при АС существует «окно возможности» для воздействия на структурное прогрессирование [54]. Это позволяет предположить, что назначение ингибиторов ФНО-альфа на ранних стадиях, когда еще не сформировались очаги хронического воспаления, способно предотвратить структурные изменения и рост синдесмофитов [41]. Данная гипотеза подтверждена динамикой МРТ-признаков и рентгенологических изменений. В настоящее время получены убедительные данные ее правомерности [54, 55]. Так, систематический обзор 15 публикаций из девяти когорт больных АС, получавших терапию ингибиторами ФНО-альфа, опубликованный в 2016 г. [56], показал, что раннее начало такой терапии может замедлить рентгенологическое прогрессирование АС. Однако на поздней стадии болезни ингибиторы ФНО-альфа могут утратить преимущество в отношении замедления образования новой кости.
Альтернативные возможности воздействовать на рентгенологическое прогрессирование АС появились с внедрением в клиническую практику ингибиторов ИЛ-17А. Поскольку воспалительное повреждение надкостницы и костной ткани, ведущее к остеопролиферации, особенно выражено в области энтезисов, развитие энтезита рассматривается многими исследователями как чрезвычайно важный этап формирования остеофитов (доказано при сопоставлении данных ультразвукового исследования и рентгенографии) [57]. Важная роль отводится гиперпродукции ИЛ-17А. Это эффекторный цитокин, который следует рассматривать в контексте локальной микросреды. Он действует синергетически или аддитивно с другими провоспалительными цитокинами, включая ФНО [58]. Поэтому применение ингибиторов ИЛ-17А также является теоретически обоснованным методом предотвращения структурного прогрессирования при спондилоартритах [59].
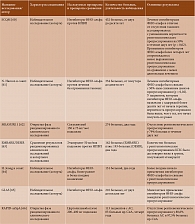
За последние несколько лет опубликованы результаты значительного количества крупных исследований, продемонстрировавших структурно-модифицирующее действие ГИБП при АС (таблица) [60–66]. В силу необходимости проведения очень длительных наблюдений (минимум два года) для оценки рентгенологического прогрессирования все эти работы основывались на результатах наблюдательных исследований либо открытых фаз продленных рандомизированных клинических исследований. Поскольку дать оценку эффективности препаратов относительно замедления рентгенологического прогрессирования в ходе прямого сравнительного плацебоконтролируемого исследования в течение срока, достаточного для достоверного выявления изменений (от двух до пяти лет), сложно по этическим причинам, проведение таковой в ближайшем будущем маловероятно.
Швейцарская когорта АС (SCQM) [60] включала 432 пациента (80,6% HLA-B27-позитивных). За ними наблюдали около десяти лет. Каждые два года больные проходили рент-генологическое обследование. В когорте было 65,7% мужчин, средний возраст исходно – 40,3 года, длительность болезни – 13,8 года. Синдесмофиты выявлены в 34,3% случаев. 83,9% больных получали НПВП, 43,1% – ингибиторы ФНО-альфа. При многопараметрическом анализе лечение ингибиторами ФНО-альфа ассоциировалось с уменьшением вероятности рентгенологического прогрессирования в течение очередного двухлетнего интервала на 50% (р = 0,02) в отличие от терапии без ингибиторов ФНО-альфа. На их действие не влияла дополнительная корректировка по активности болезни (ASDAS) перед началом лечения. Применение ингибиторов ФНО-альфа свыше четырех лет сопровождалось менее выраженным рентгенологическим прогрессированием, чем при менее продолжительном.
Канадско-американская когорта больных АС [61] включала 334 пациентов, из них 76,7% мужчин. Средний возраст – 40,7 ± 13,8 года, длительность болезни – 16,4 ± 12,8 года. HLA-B27-позитивных – 83,4%. 201 (60%) больной получал ингибиторы ФНО-альфа. Период наблюдения в среднем составил 2,87 ± 1,17 года (от полутора до девяти лет). Лечение ингибиторами ФНО-альфа ассоциировалось с 50%-ным снижением шансов прогрессирования (р = 0,02). У пациентов, которым ингибиторы ФНО-альфа назначали с задержкой более десяти лет, вероятность прогрессирования была более высокой, чем у тех, кто начал лечение ими ранее.
В продленной открытой фазе исследования MEASURE 1 [62] участвовали 274 больных АС, получавших разные дозы секукинумаба. Отсутствие рентгенологического прогрессирования (изменение индекса mSASSS относительно исходного менее двух баллов) отмечено у 79% пациентов.
Следует принять во внимание важные исходные характеристики пациентов исследования MEASURE 1: меньшая длительность заболевания (около семи лет), а также меньшая тяжесть рентгенологических изменений (mSASSS ~ 10) по сравнению с популяцией в базовых исследованиях с ингибиторами ФНО-альфа (10–11 лет и mSASSS ~ 16–20 соответственно).
Еще в одном недавно опубликованном исследовании [63] сравнивали результаты рандомизированного клинического исследования EMBARK (пациенты получали ингибитор ФНО-альфа этанерцепт) и когортного исследования DESIR (пациенты с АС преимущественно находились на терапии НПВП). Суммарно в исследование было включено 355 больных. Период наблюдения составил два года. Рентгенологическое прогрессирование в КПС оценивалось с помощью модифицированных Нью-Йоркских критериев АС (mNY). Установлено, что за два года изменения на рентгенограммах были незначительными, при этом в основной группе наблюдалось улучшение, в контрольной – ухудшение (различия достоверны, p = 0,008). Доля больных с рентгенологическим прогрессированием АС была достоверно меньше в группе этанерцепта.
В южнокорейской когорте больных АС [64] ингибитор ФНО-альфа получал 151 пациент. Средняя продолжительность болезни к моменту назначения препарата составляла 84 месяца. Позднее начало применения ингибитора ФНО-альфа было связано с рентгенологическим прогрессированием. Авторы сделали вывод, что раннее и долгосрочное применение ингибитора ФНО-альфа, по-видимому, уменьшает рентгенологическое прогрессирование у пациентов с АС.
В рамках когортного исследования GLAS 210 больных АС получали лечение ингибиторами ФНО-альфа (этанерцепт, адалимумаб, инфликсимаб). Длительность наблюдения – до восьми лет [65]. Исходно среди них было 69% мужчин, 78% HLA-B27-позитивных. Средний возраст – 41,6 ± 11,5 года, длительность болезни – 14 лет. Синдесмофиты выявлены у 54% пациентов. Темпы прогрессирования рент-генологических изменений в позвоночнике по mSASSS снизились с 2,3 балла в первые два года до 0,8 балла в период с шести до восьми лет. Полученные результаты позволили сделать вывод, что многолетнее применение ингибиторов ФНО-альфа замедляет рентгенологическое прогрессирование АС.
В открытой фазе рандомизированного клинического исследования RAPID-axSpA [66] пациенты с АС и нерентгенологическим спондилоартритом (нр-СпА) получали ингибитор ФНО-альфа цертолизумаба пэгол в разных режимах дозирования до 204 недель (четырех лет). У 80,6% больных АС и 97,5% больных нр-СпА не зафиксировано рентгенологического прогрессирования (изменение индекса mSASSS относительно исходного менее двух баллов) за четыре года.
Суммируя данные таблицы, можно заключить, что структурно-модифицирующее действие ингибиторов ФНО-альфа доказано большим объемом клинического материала, включая массивные когорты больных. Тот же вывод можно сделать в отношении ингибиторов ИЛ-17А, хотя клинический материал, который поддерживает это утверждение, менее обширен. В настоящее время биологическая терапия имеет максимальный уровень доказательности в отношении модификации течения заболевания, включая структурные изменения [67]. Тщательное наблюдение пациентов с оценкой активности болезни и стратификация больных по скорости прогрессирования структурных нарушений по результатам инструментальных исследований с более ранним назначением ГИБП могут быть целесообразными для предотвращения структурных изменений [67]. Раннее назначение ингибиторов ФНО-альфа при активном АС и нр-СпА способно замедлить и фактически остановить прогрессирование сакроилеита и развитие остеофитов в позвоночнике. Долговременное (четыре года и более) непрерывное применение ингибиторов ФНО-альфа позволяет значительно замедлить прогрессирование структурных изменений в позвоночнике, даже у больных с длительно протекающим заболеванием и синдесмофитами.
D.E. Karateev, MD, PhD, Prof.
Moscow Regional Research and Clinical Institute
Contact person: Dmitry E. Karateev, dekar@inbox.ru
Ankylosing spondylitis (AS), Bechterew’s disease, is characterized by such key pathological signs as the development of enthesitis, sacroiliitis and spondylitis with the formation of new bone tissue with the possible development of bone ankylosis. Radiographic progression of spinal lesions and disease activity are two main determinants of impaired spinal mobility and functional status in AS. The most common methodology for assessing the radiological progression of proliferative changes is the modified Stoke Ankylosing Spondylitis Spine Score (mSASSS) index, which has been used in many studies. At the same time, there are a number of methodological difficulties in assessing progression in AS, such as the need for long-term (at least 2 years) follow-up and different rates of osteoproliferation in different parts of the spine.
The objective assessment of progression and its prevention are important practical tasks. There is probably a ‘window of opportunity’ regarding our ability to stop radiological progression in AS.
The review discusses the effect of non-steroidal anti-inflammatory drugs and biological anti-rheumatic drugs from the groups of tumor necrosis factor alpha (TNFα) inhibitors and interleukin 17A (IL-17A) inhibitors on the radiological progression in AS based on the data of randomized and observational studies. A large number of clinical data, including massive cohorts of patients, has proved the structural effect of TNFα inhibitors. The same conclusion can be made with respect to IL-17A inhibitors, although the supporting clinical data are less extensive.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.