Характеристика и выявление диссеминированных опухолевых клеток в костном мозге у пациентов c меланомой кожи методом проточной цитометрии
- Аннотация
- Статья
- Ссылки
- English



Введение
Несмотря на имеющиеся знания базовой биологии рака и достижения в диагностике и лечении, которые значительно улучшили показатели безрецидивной выживаемости, уровень смертности от злокачественных новообразований за последние 40 лет существенно не изменился [1]. Возможно, это связано с тем, что предметом исследований были в основном первичные опухоли, а не метастазирование – главная причина смерти онкологических больных.
Сегодня доказано, что рак – болезнь, изначально имеющая системный характер. Следовательно, способность к метастазированию возникает на самых ранних этапах канцерогенеза [2].
Процесс гематогенного метастазирования в упрощенном виде включает инвазию, то есть выход опухолевых клеток за пределы первичной опухоли, интравазацию в кровеносные сосуды, выживание в циркуляции, остановку в определенных тканях, экстравазацию за пределы сосуда, состояние покоя и своего рода метастатическое пробуждение [3].
С биологической точки зрения метастазирование – процесс крайне неэффективный. Каждый шаг каскада является уязвимым местом для опухолевых клеток и сопровождается их клональным отбором. К концу процесса только небольшая часть из сотни тысяч клеток, ежедневно покидающих первичную опухоль, достигает анатомически отдаленных мест и способна к колонизации [4]. Диссеминированные опухолевые клетки (ДОК) являются единственным признаком болезни и считаются предвестниками метастазирования, оставаясь в течение длительного периода времени бессимптомными [5]. Но даже наличие единичных ДОК в организме таит в себе большую угрозу, поскольку, сохранив пролиферативный потенциал, они могут реализоваться в клинические метастазы спустя годы, а иногда и десятилетия после латентного периода «спячки» [2, 6].
Миелоидный костный мозг (КМ) – основной орган-мишень для колонизации ДОК. КМ имеет хорошее кровоснабжение, а также развитую сеть мелких фенестрированных кровеносных сосудов-синусоидов. Это создает повышенную проницаемость и более легкий физический барьер для экстравазации опухолевых клеток в КМ в отличие от других органов [7]. В то же время уникальные характеристики костномозговой ниши обеспечивают сигналы самонаведения, а биохимические (цитокины, хемокины, факторы роста и др.) и физические (кислотный pH, высокая концентрация внеклеточного кальция и др.) факторы создают тонко организованное микроокружение, которое является наиболее притягательным местом для опухолевых клеток [8]. Будучи изначально чужеродным, КМ подстраивает свою среду за счет сложных антигенных, иммуногенных и клеточных механизмов, формируя благоприятные условия для персистенции ДОК [9, 10].
Диагностика гематогенного распространения злокачественных новообразований на ранних стадиях – одна из главных проблем современной онкологии. Выявить ДОК с помощью рутинных патоморфологических методов крайне сложно. Диагностика ДОК требует применения высокочувствительных иммунологических методов.
В течение последнего десятилетия были созданы различные платформы для обнаружения ДОК в КМ. Одним из наиболее функциональных и информативных методов обнаружения ДОК признан метод проточной цитометрии, обладающий высокой чувствительностью и позволяющий всесторонне оценивать различные популяции клеток КМ (причем не в среднем, а каждую клетку отдельно) на основании мультипараметрического анализа поверхностных маркеров [11].
Информативность исследования КМ при различных опухолях негемопоэтической природы доказана неоднократно. В многочисленных клинических исследованиях выявлена достоверная корреляция между наличием ДОК в КМ и ухудшением выживаемости больных при раке молочной железы [12], предстательной железы [13], легкого [14], толстой кишки [15], а также при злокачественных новообразованиях других локализаций. В свою очередь проблема микрометастазирования в КМ при меланоме требует дальнейшего анализа.
Как и другие солидные опухоли, меланома способна к гематогенной диссеминации уже на ранних стадиях развития [16]. Случаи возникновения висцеральных метастазов при меланоме спустя десять [17] и даже 40 лет [18] после удаления первичной опухоли без вовлечения регионарных зон, а также частое манифестирование меланомы без выявленного первичного очага позволяют говорить о склонности меланомных клеток к распространению из индолентных очагов [19], таких как КМ.
Одним из наиболее надежных маркеров идентификации клеток меланомы является НМВ-45 (цитоплазматический премелацитарный гликопротеин gp100). Он классифицируется как антиген дифференцировки меланоцитов и отсутствует в опухолях немеланоцитарного происхождения. Обладая высокой чувствительностью (до 93%) и специфичностью (до 100%), HMB-45 служит надежным маркером идентификации клеток меланомы, что позволяет использовать его для идентификации ДОК [20].
Цель исследования – оценить возможность выявления ДОК меланомы в КМ на основании экспрессии HMB-45 методом проточной цитометрии, частоту поражения КМ у больных меланомой и определить субпопуляционный состав ДОК при меланоме в отношении экспрессии CD56, CD57, являющихся дополнительным критерием при иммуногистохимической диагностике меланомы, а также количество стволовых опухолевых клеток среди ДОК по наличию антигена CD133.
Материал и методы
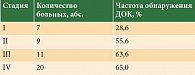
В исследование было включено 47 больных (23 мужчины и 24 женщины) в возрасте от 20 до 72 лет (медиана – 49,8 года), находившихся под наблюдением по поводу меланомы кожи в Национальном медицинском исследовательском центре (НМИЦ) онкологии им. Н.Н. Блохина в 2018–2019 гг. У всех пациентов диагноз подтвержден гистологически. В 42,6% случаев, согласно результатам комплексного обследования, установлена IV стадия заболевания. Распределение больных по стадиям представлено в табл. 1.
Образцы КМ получены при пункции гребня подвздошной кости до начала лечения, в отдельных случаях использованы одномоментные пункции грудины и гребня подвздошной кости. Оценка поражения костного мозга проведена в лаборатории иммунологии гемопоэза НМИЦ онкологии им. Н.Н. Блохина морфологическим и иммунологическим методами.
Морфологическое исследование включало подсчет миелограммы и поиск микрометастазов и выполнялось двумя морфологами параллельно на шести стеклах, окрашенных методом Романовского.
Впервые в России проведена иммунологическая оценка наличия ДОК в КМ при меланоме кожи с использованием проточной цитометрии, что позволило увеличить пороговое значение до 1 × 10-7 миелокариоцитов. С этой целью мы использовали высокоскоростной цитометр FACS Canto II (США) с революционирующей технологией фокусов клеток для многопараметрического анализа клеточной суспензии [21]. Оценивалось 20 млн миелокариоцитов (или все клетки образца), окрашенных методом прямой иммунофлюоресценции с использованием зарубежных моноклональных антител (МКА), меченных флюорохромами (табл. 2).
Результаты анализировали с помощью программы Kaluza Analysis v2.1 (Beckman Coulter, США). Статистический анализ выполнен с использованием статистического пакета IBM-SPSS Statistics v.17.
Результаты
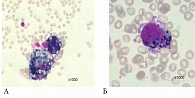
Морфологический анализ пунктатов КМ включал подсчет миелограммы и поиск микрометастазов. Морфологически ДОК выявлены только в одном из 47 случаев. На рисунке 1 представлен случай выявления клеток меланомы кожи в пунктате КМ. Как видно, пунктат КМ беден. Нормальные ростки миелопоэза угнетены. При просмотре препаратов определены комплексы клеток негемопоэтической природы, а также разрозненные, отдельно лежащие опухолевые клетки крупного размера. В цитоплазме обнаружены базофильно-окрашенные гранулы пигмента различного размера. Морфологическая картина КМ характерна для метастатического поражения при меланоме.
При иммунологической оценке наличия ДОК в КМ за пороговый уровень принималась одна опухолевая клетка (Syto41+CD45-HMB-45+) на 10 млн миелокариоцитов. Среднее значение проанализированных в каждом образце клеток составило 14 146 987 миелокариоцитов (± 957 728 клеток). С учетом заданного порогового значения ДОК выявлены в 57,4% образцов КМ (n = 27). Статистически достоверных различий по количеству ДОК в зависимости от пола, возраста и стадии заболевания не получено. Важно, что поражение КМ наблюдалось на всех стадиях заболевания (табл. 3). Даже при клинически локализованном процессе отмечалась гематогенная диссеминация опухоли.
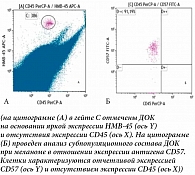
Дополнительно ДОК характеризовали с точки зрения экспрессии CD56 и CD57. Указанные молекулы служат дополнительными критериями при иммуногистохимической диагностике вариантов меланомы. В данном исследовании экспрессия CD56 и CD57 оценивалась в 23 образцах КМ. ДОК в данной группе выявлены в 54,2% случаев (n = 13), однако экспрессии CD56 на этих клетках не обнаружено. Экспрессия CD57 на ДОК зарегистрирована в шести (46,2%) случаях (рис. 2). Важно, что не все ДОК в каждом образце КМ характеризовались экспрессией CD57. В среднем 87,4 ± 5,8% ДОК были CD57-позитивны. Интересно, что 50% больных с CD57+ имели IV стадию заболевания, двое из шести пациентов – III стадию, один – стадию IIС. На рисунке 2 показано выявление диссеминированных опухолевых клеток при меланоме кожи. Клетки характеризуются отчетливой экспрессией CD57 (ось Y) и отсутствием экспрессии CD45 (ось X). Большинство ДОК (91,19%) CD57-положительны.
Особая роль в процессах метастазирования отводится минорной популяции стволовых опухолевых клеток (СОК), обладающих наибольшей устойчивостью к традиционным методам противоопухолевой терапии. По данным литературы, СОК меланомы характеризуются экспрессией антигенов, таких как CD44, CD271, CD133. Нами предпринята попытка оценить экспрессию маркеров СОК на примере CD133.
Экспрессию CD133 оценивали в 22 образцах КМ. Половина образцов КМ этой группы характеризовалась ДОК-позитивностью. Только в одном ДОК-позитивном пунктате выявлена популяция CD133-положительных ДОК, их количество составило 1,38% всех ДОК в данном случае (рис. 3).
Следует отметить, что из-за относительно небольшой частоты обнаружения клеток меланомы в КМ требуются дальнейший набор материала и расширение панели антигенов для подробной иммунологической характеристики СОК и определения их значения в прогнозе больного.
Заключение
Меланома уникальна тем, что обычно хорошо видна на поверхности тела. Несмотря на то что визуальная локализация делает ее легко доступной для диагностики, а небольшой размер предполагает кажущийся благоприятный прогноз, меланома – одно из самых коварных злокачественных новообразований с крайне высоким метастатическим потенциалом. Некоторые первичные меланомы способны гематогенно диссеминировать и приводить к летальному исходу, даже когда объем опухоли находится в пределах кубического миллиметра. Поскольку распространение опухолевых клеток считается ключевым событием в развитии опухоли, поиск новых современных прогностических факторов, позволяющих определить прогноз меланомы, и маркеров, свидетельствующих о ранней диссеминации опухолевого процесса, остается крайне актуальным при данном заболевании. Изучение ДОК позволит восполнить этот пробел.
Результаты нашего исследования демонстрируют, что метод проточной цитометрии с использованием специфического антитела HMB-45 в комбинации с CD45 может рассматриваться в качестве новой методики для выявления распространения ДОК в КМ у пациентов с меланомой. ДОК выявлены в 57,4% случаев меланомы кожи. При этом даже у больных c I стадией заболевания ДОК имели место в 28,6% случаев, что подтверждает агрессивное течение меланомы кожи даже при локализованном процессе. Наличие экспрессии CD57 и CD133 свидетельствует о гетерогенности меланомной популяции ДОК и сложных иерархических взаимосвязях между первичной опухолью и ДОК. Прогностическое значение полученных данных еще предстоит оценить.
Несмотря на то что кости не являются частым местом метастазирования, наличие ДОК в КМ может расцениваться как доказательство общей способности меланомы к диссеминации. Предположительно ДОК могут присутствовать и в других органах, например печени и легком. В то же время КМ служит основным резервуаром опухолевых клеток, из которого они рециркулируют в различные органы, как было недавно продемонстрировано на экспериментальных моделях меланомы [22]. В обоих случаях свидетельство о ДОК-положительном статусе КМ указывает на высокую злокачественность и дает возможность выявить группу пациентов с высоким риском прогрессирования, которые могут получить пользу от дополнительной терапии [23]. Исследование дополнительных фенотипических маркеров на ДОК позволит увеличить прогностическую силу этого подхода и точно определить конкретные терапевтические цели, подходящие для устранения единичных опухолевых клеток.
I.G. Markina, PhD, O.A. Chernisheva, PhD, L.V. Demidov, PhD, Prof., N.A. Kuprishina, PhD, I.N. Mihaylova, PhD, A.S. Antipova, PhD, N.N. Tupitsin, PhD, Prof.
N.N. Blokhin National Medical Research Center of Oncology
Contact person: Irina G. Markina, irina160771@yandex.ru
Diagnosis of hematogenic spread of malignant neoplasms in early stages is one of the main problems of modern oncology. Morphologically single tumor cells are not detected – highly sensitive immunological methods are required. Evidence in the literature suggests that the quantification and characterization of disseminated tumor cells (DTCs) provides important prognostic information for many non-hematopoietic tumors. The purpose of this work was to evaluate the frequency of bone marrow lesion (BM) in patients with skin melanoma and based on the expression of HMB-45 by flow cytometry and analysis of the subpopulation composition of DTCs. DTCs was found in 57.4% of skin melanoma cases. Moreover, in patients with stage I disease, DTCs is detected in 28.6% of cases, which may indicate an aggressive course of the disease even in a localized process. Our study demonstrates that the flow cytometry technique can be used as a novel technique to detect the spread of DTCs in BM in melanoma patients.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.