Мутация в гене BRAF у пациентов с меланомой: анализ результатов наблюдательного исследования и сопоставление с данными литературы
- Аннотация
- Статья
- Ссылки
- English
Цель работы – оценка частоты назначения молекулярно-генетического исследования опухоли и выявления мутации в гене BRAF в России на основании результатов наблюдательного исследования в сравнении с имеющимися данными медицинской литературы в других странах.
Материал и методы. В период с октября 2020 г. по октябрь 2022 г. в исследование FORA (FOrteca Real practice Assessment) – многоцентровое проспективное наблюдательное исследование эффективности терапии пролголимабом у больных метастатической меланомой в реальной клинической практике в России (NCT05120024) – было включено 700 пациентов с метастатической и/или неоперабельной меланомой, получавших пролголимаб в рамках реальной клинической практики в онкологических учреждениях различного уровня на территории Российской Федерации. Информация о пациентах собиралась на платформе, разработанной для данного исследования. Наряду с другими параметрами, такими как пол, возраст на момент постановки диагноза, стадия болезни, локализация первичной опухоли, метастатических очагов, уровень лактатдегидрогеназы и др., индивидуальная регистрационная карта пациента содержала в себе графу о молекулярно-генетических характеристиках опухоли, а именно: мутация в гене BRAF – есть vs нет vs не определялась с указанием типа мутации vs V600 без уточнения.
Выводы. Определение мутации в гене BRAF было назначено 561 (88,8%) из 632 пациентов с меланомой кожи и без выявленного первичного очага, получавших терапию пролголимабом. Из них у 210 (37,4%) мутация была выявлена. Частота выявления мутации в гене BRAF была выше у пациентов в возрасте до 50 лет (< 50 лет – 59,4%, ≥ 50 лет – 29,1%; р < 0,001), а также у пациентов с локализацией первичной меланомы на туловище (42,6% против 30,2% в области нижних конечностей, р = 0,031; 42,6% против 26,2% в области верхних конечностей, р = 0,021). Подтип V600E был выявлен в 67,6%, V600K – в 7,1% случаев. Низкая частота выявления мутации типа V600E обусловлена высокой частотой определения мутации в гене BRAF V600 без уточнения (23,8%), что связано с особенностями лабораторного оборудования и наборами реагентов, которые используются в лабораториях в регионах РФ.
Цель работы – оценка частоты назначения молекулярно-генетического исследования опухоли и выявления мутации в гене BRAF в России на основании результатов наблюдательного исследования в сравнении с имеющимися данными медицинской литературы в других странах.
Материал и методы. В период с октября 2020 г. по октябрь 2022 г. в исследование FORA (FOrteca Real practice Assessment) – многоцентровое проспективное наблюдательное исследование эффективности терапии пролголимабом у больных метастатической меланомой в реальной клинической практике в России (NCT05120024) – было включено 700 пациентов с метастатической и/или неоперабельной меланомой, получавших пролголимаб в рамках реальной клинической практики в онкологических учреждениях различного уровня на территории Российской Федерации. Информация о пациентах собиралась на платформе, разработанной для данного исследования. Наряду с другими параметрами, такими как пол, возраст на момент постановки диагноза, стадия болезни, локализация первичной опухоли, метастатических очагов, уровень лактатдегидрогеназы и др., индивидуальная регистрационная карта пациента содержала в себе графу о молекулярно-генетических характеристиках опухоли, а именно: мутация в гене BRAF – есть vs нет vs не определялась с указанием типа мутации vs V600 без уточнения.
Выводы. Определение мутации в гене BRAF было назначено 561 (88,8%) из 632 пациентов с меланомой кожи и без выявленного первичного очага, получавших терапию пролголимабом. Из них у 210 (37,4%) мутация была выявлена. Частота выявления мутации в гене BRAF была выше у пациентов в возрасте до 50 лет (< 50 лет – 59,4%, ≥ 50 лет – 29,1%; р < 0,001), а также у пациентов с локализацией первичной меланомы на туловище (42,6% против 30,2% в области нижних конечностей, р = 0,031; 42,6% против 26,2% в области верхних конечностей, р = 0,021). Подтип V600E был выявлен в 67,6%, V600K – в 7,1% случаев. Низкая частота выявления мутации типа V600E обусловлена высокой частотой определения мутации в гене BRAF V600 без уточнения (23,8%), что связано с особенностями лабораторного оборудования и наборами реагентов, которые используются в лабораториях в регионах РФ.


Введение
Международное агентство по изучению рака (МАИР) и Всемирная организация здравоохранения (ВОЗ) в рамках проекта GLOBOCAN (Global Cancer Observatory) опубликовали результаты эпидемиологического исследования, завершенного в мае 2022 г. Обращает на себя внимание общий тренд на увеличение числа новых случаев меланомы. В 2020 г. во всем мире зарегистрировано 325 000 новых случаев меланомы (174 000 мужчин и 151 000 женщин) и 57 000 смертей (32 000 мужчин и 25 000 женщин). По прогнозам, к 2040 г. количество новых случаев меланомы увеличится до 510 000 и смертей от нее – до 96 000 при условии сохранения темпов, наблюдавшихся в 2020 г. [1].
Последняя классификация ВОЗ признала специфические генетические факторы, приводящие к развитию меланомы, и классифицирует меланоцитарные образования на девять различных категорий в соответствии с ассоциированным кумулятивным солнечным повреждением кожи, которое коррелирует с молекулярными изменениями [2]. Самая обширная группа – меланомы, ассоциированные с низким уровнем кумулятивного солнечного повреждения, или поверхностно-распространяющиеся меланомы, характеризующиеся частым наличием мутации в гене BRAF V600 [3].
Мутация в гене BRAF является наиболее важной терапевтической мишенью и самым частым генетическим изменением при меланоме кожи, встречаясь в 40–60% случаев [4, 5]. При меланоме выявлено более 80 соматических мутаций в экзоне 15 гена BRAF, и в 95% случаев это V600 (замена одной аминокислоты на валин 600) [6]. Наиболее распространенным генотипом является V600E (замена валина на глутаминовую кислоту), которая встречается примерно в 80% случаев меланом с BRAF-мутацией; V600K встречается в 15% случаев; а мутации V600R/M/D/G – примерно в 5% случаев [7]. При этом распространенность мутаций варьирует и различна в различных странах и регионах проживания. Мутации в гене BRAF в 56,1% случаев были выявлены в Словении [8], в 44,9% – в США (штат Техас) [9], в 37,7% – в австралийской популяции [10], в 35% случаев – в датской популяции [11].
В 2014 г. были представлены результаты всероссийского молекулярно-эпидемиологического исследования меланомы. В работу включены 1035 пациентов с меланомой IIIB–IV стадий, проживающих в семи субъектах Российской Федерации. Мутации в гене BRAF были выявлены у 627 (60,6%) пациентов (V600E в 563 случаях, другие мутации – 64). Частота мутаций в гене BRAF оказалась заметно выше у относительно молодых пациентов (< 50 лет – 72,9%; ≥ 50 лет – 57,1%; p = 0,00003). При этом 710 меланом, включенных в исследование, были расположены на не подвергающихся хроническому воздействию ультрафиолетового излучения участках кожных покровов. Именно эта разновидность новообразований характеризовалась максимальной встречаемостью мутаций BRAF (63,9%) [12].
В соответствии с клиническими рекомендациями, одобренными научно-практическим советом Минздрава России, пациентам с меланомой кожи, у которых диагностированы или заподозрены регионарные и отдаленные метастазы меланомы, и при метастазах меланомы без выявленного первичного очага (ВПО) (стадии III и IV или эквивалент) рекомендуется выполнить молекулярно-генетическое исследование мутаций в гене BRAF (экзон 15), что может повлиять на выбор лекарственной терапии.
Цель работы – оценка частоты назначения анализов на молекулярно-генетические характеристики опухоли и выявления мутации в гене BRAF в России на основании результатов наблюдательного исследования в сравнении с имеющимися данными медицинской литературы для других стран.
Материал и методы
В период с октября 2020 г. по октябрь 2022 г. в исследование FORA (FOrteca Real practice Assessment) – многоцентровое проспективное наблюдательное исследование эффективности терапии пролголимабом у больных метастатической меланомой в реальной клинической практике в России (NCT05120024) – было включено 700 пациентов с метастатической и/или неоперабельной меланомой, получавших пролголимаб в рамках реальной клинической практики в онкологических учреждениях различного уровня на территории Российской Федерации. Основные критерии включения: морфологически подтвержденный диагноз меланомы; метастатическая и/или неоперабельная форма; проведение лекарственной терапии пролголимабом вне рамок клинических исследований; наличие подписанной пациентом формы информированного согласия. В наблюдательное исследование включены пациенты с любым типом меланомы (слизистых оболочек, увеальная или меланома кожи/без ВПО), которым назначен пролголимаб и пациент получил хотя бы одно введение. Цель данного исследования – оценка безопасности и эффективности терапии пролголимабом у пациентов с меланомой в рутинной практике. Информация о пациентах собиралась на платформе, разработанной для данного исследования. Наряду с другими параметрами, такими как пол, возраст на момент постановки диагноза, стадия болезни, локализация первичной опухоли, метастатических очагов, уровень лактатдегидрогеназы и др., индивидуальная регистрационная карта (ИРК) пациента содержала в себе графу о молекулярно-генетических характеристиках опухоли, а именно: мутация в гене BRAF – есть vs нет vs не определялась с указанием типа мутации vs V600 без уточнения.
Статистическая обработка данных проводилась с использованием методов описательной статистики. Для качественных и категориальных показателей (пол, тип мутации и др.) представлены абсолютные значения в формате n/N, а также доля пациентов в каждой категории (%). Нормальность распределения количественных переменных рассчитывалась с помощью критерия Шапиро – Уилка. В связи с распределением, отличным от нормального, различия между группами рассчитывались с использованием критерия Манна – Уитни. Различия между долями были рассчитаны с помощью критерия хи-квадрат по Пирсону.
Результаты
В анализ частоты определения мутации в гене BRAF у пациентов с метастатической и/или неоперабельной меланомой включены 698 пациентов из исследования FORA (два пациента исключены по причине дублирования в других центрах). Средний возраст составил 62,9 ± 12,7 года (медиана 62,00 (52,00; 69,00) года, от 18 до 94 лет), при этом более 50% – в возрасте старше 60 лет. У 632 пациентов (90,4%) – меланома кожи и меланома без ВПО, у 45 (6,4%) – увеальная меланома, у 21 (3,0%) – меланомой кожи и слизистых локализаций. Тестирование для определения мутации в гене BRAF V600 выполнено 601 пациенту (среди всех пациентов – с меланомой кожи и без ВПО, с меланомой слизистой и увеальной локализаций), из них мутация в гене BRAF подтипа V600 выявлена у 210 пациентов, что составило 34,9%, у 391 (65,1%) мутация BRAF V600 не была выявлена. У 169 (80,5%) пациентов мутация в гене BRAF была определена до начала терапии (в среднем за 11,7 месяца до начала), у 41 (19,5%) – после начала терапии (в течение трех месяцев, в среднем за 23 дня после начала терапии).
В данной статье мы остановимся на описании 632 пациентов с меланомой кожи и без ВПО, для которых определение мутации в гене BRAF является важным и обязательным в соответствии с клиническими рекомендациями для определения тактики лекарственного лечения. Определение мутации в гене BRAF назначено 561 (88,8%) из 632 пациентов с меланомой кожи и без ВПО, получавших терапию пролголимабом, из них у 210 (37,4%) мутация была выявлена (табл. 1).
При сравнении групп пациентов с мутацией в гене BRAF и ее отсутствием отмечена разница в возрасте пациентов. Пациенты с мутацией в гене BRAF моложе (60,00 (48,75; 69,00)), чем пациенты, у которых мутация не выявлена (65,00 (60,00; 73,00), р < 0,001). Частота мутаций в гене BRAF оказалась заметно выше у относительно молодых пациентов (< 50 лет – 59,4%, ≥ 50 лет – 29,1%; р < 0,001).
При сравнении частоты выявления мутации в гене BRAF в зависимости от локализации замечено, что у пациентов с локализацией первичного очага на туловище чаще встречалась мутация BRAF, чем с локализацией на нижних конечностях (42,6% против 30,2%, р = 0,031) и на верхних конечностях (42,6% против 26,2%, р = 0,021).
Дополнительно в ИРК заполнялась информация по типу мутации в гене BRAF, который выявлен. Среди 210 пациентов, у которых обнаружена мутация в гене BRAF, наиболее часто выявлялась V600E – 67,6%, без уточнения подтипа – 23,8%, V600K –
7,1% и др. Более подробно характеристика представлена в таблице 2.
Обсуждение
Отрадно отметить, что подавляющему большинству пациентов (88,8%) с метастатической и/или неоперабельной меланомой назначается определение мутации в гене BRAF. Распространенность мутации в гене BRAF среди пациентов с меланомой кожи и без ВПО, по данным исследования FORA, составила 37,4%. Этот показатель ниже при сравнении с результатами молекулярно-эпидемиологического исследования, опубликованными ранее в 2014 г. в России, тогда частота выявления мутации в гене BRAF составила 60,6%. Вероятнее всего, это связано с разными популяциями пациентов, принимавших участие в исследованиях: в исследование FORA включались пациенты более старшего возраста по сравнению с молекулярно-эпидемиологическим исследованием, а также пациенты, которым назначалась монотерапия анти-PD-1, в то время как в молекулярно-эпидемиологическое исследование направлялся материал пациентов, которым в первую очередь планировалось назначение таргетной терапии. По данным нашего исследования, пациенты с мутацией в гене BRAF моложе (60,00 года (48,75; 69,00)), чем пациенты, у которых мутация не выявлена (65,00 года (60,00; 73,00), р < 0,001). При этом частота выявления мутации в гене BRAF была выше у пациентов в возрасте до 50 лет (< 50 лет – 59,4%, ≥ 50 лет – 29,1%, р < 0,001). Эти данные сопоставимы с ранее опубликованными результатами молекулярно-эпидемиологического исследования, где частота мутаций в гене BRAF оказалась заметно выше у относительно молодых пациентов (< 50 лет – 72,9%; ≥ 50 лет – 57,1%; p = 0,00003), а также у пациентов с локализацией первичного очага на туловище (42,6% против 30,2% в области нижних конечностей, р = 0,031; 42,6% против 26,2% в области верхних конечностей, р = 0,021). Эта закономерность еще раз в большей степени характеризует популяции пациентов: по имеющимся на сегодняшней день данным, меланома с мутацией гена BRAF связана с более молодым возрастом пациента, отсутствием кумулятивного солнечного повреждения, локализацией на туловище, большим количеством невусов на теле.
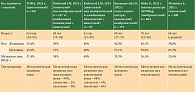
При этом если сравнить возраст пациентов, выявление мутации в гене BRAF по данным наблюдательных ретроспективных исследований других стран, то видны сопоставимые результаты в группах пациентов, получающих монотерапию анти-PD-1: средний возраст пациентов был старше 62 лет, мутация в гене BRAF V600 встречалась у 26,1–38% пациентов (табл. 3) [13–16].
Во всем мире, и Россия не исключение, наиболее распространена мутация V600E. По данным нашего исследования, подтип V600E был выявлен в 67,6%, V600K – в 7,1% случаев. Низкая частота выявления мутации типа V600E в ежедневной клинической практике обусловлена высокой частотой определения мутации в гене BRAF V600 без уточнения (23,8%), что связано с особенностями лабораторного оборудования и наборами реагентов, которые используются в лабораториях в регионах РФ. Однако важно отметить, что определение подтипа мутации является важным для пациентов с меланомой как для прогноза заболевания, так и для предиктивного значения эффективности таргетной анти-BRAF-терапии. В ранее опубликованном ретроспективном наблюдательном исследовании ADMIRE при сравнении пациентов, получающих таргетную анти-BRAF-терапию с мутацией V600E (n = 284) и другими мутациями (V600K, V600D, V600R) (n = 32) медиана общей выживаемости (ОВ) составила 20,5 месяца по сравнению с 11,9 месяца в группе редких подтипов мутации в гене BRAF соответственно. Показатель 12-месячной и 24-месячной ОВ составил 71,8% vs 46,0% и 43,0% vs 36,8% соответственно (р = 0,0268). Похожие различия были получены и в отношении выживаемости без прогрессирования (ВБП) (р = 0,0481) [17]. В рандомизированном клиническом исследовании III фазы IMSPire150 (сравнение комбинированной таргетной и иммунотерапии с комбинированной таргетной терапией: вемурафениб + кобиметиниб + атезолизумаб vs вемурафениб + кобиметиниб) были отмечены показатели более худшей ОВ среди пациентов с другими типами мутаций (V600K/D/R) vs V600E. Медиана ОВ при подтипе мутации V600E составила 42,2 месяца (30,4 – не достигнута) в группе комбинированной таргетной и иммунотерапии по сравнению с 25,1 месяца (19,3–31,6) в группе комбинированной таргетной терапии (ОР 0,76, 95% ДИ 0,58–1,00); при V600K/D/R – 28,8 месяца (10,9 – не достигнута) в группе комбинированной таргетной и иммунотерапии по сравнению с 42,4 месяца (25,8 – не достигнута) в группе комбинированной таргетной терапии (ОР 1,53, 95% ДИ 0,77–3,03). При этом комбинированная таргетная и иммунотерапия оказалась менее эффективна при редких вариантах мутации в гене BRAF [18].
К сожалению, у 11,2% (n = 71) пациентов, получающих лекарственную терапию по поводу метастатической и/или неоперабельной меланомы, мутацию в гене BRAF не определяли совсем. Данные по мутации собирались и обновлялись на протяжении всего исследования, исследователям напоминалось о важности определения мутации и внесения информации в ИРК. Последнее обновление данных было проведено в октябре 2023 г. Среди 71 пациента, которым не была определена мутация в гене BRAF, 25 (~35%) умерли, 38 (~54%) живы, в отношении восьми человек нет обновленных данных на момент написания статьи. Более 50% пациентов, которым все еще необходимо определение мутации в гене BRAF в ходе лечения, данный тест не проведен. Отчасти это можно объяснить тем, что врачи зарегистрировали эффект на фоне проводимой иммунотерапии и верят, что знания о мутации в гене BRAF у пациентов им не потребуются: из 38 пациентов, что живы на момент анализа, 29 пациентам не требуется назначение дальнейшей терапии (у одного (2,6%) пациента зарегистрирован полный ответ на фоне терапии пролголимабом, у 18 (47,4%) пациентов – частичный ответ и у десяти (26,3%) – стабилизация). Однако у шести (15,8%) пациентов зарегистрировано прогрессирование заболевания, а у трех (7,9%) – нет обновленных данных.
Таким образом, мы вновь видим «магическую» цифру порядка 20% пациентов, которым необходимо определение мутации в гене BRAF, но оно не проведено. Ранее опубликованные нами результаты опроса среди специалистов в РФ продемонстрировали, что частота определения мутации в гене BRAF у пациентов с метастатической и/или неоперабельной меланомой составляет 79,1%. Таким образом, около 20% пациентов мутация в гене BRAF не определяется.
Заключение
Примерно 90% пациентов в рутинной практике проводится определение мутации в гене BRAF, по данным многоцентрового наблюдательного исследования. Это высокий процент, который в том числе был достигнут обновлением информации в ИРК по статусу молекулярных изменений и напоминанием врачам о важности тестирования и внесения информации в ИРК. Определение мутации в гене BRAF было назначено 561 (88,8%) из 632 пациентов с меланомой кожи и без ВПО, получавших терапию пролголимабом, из них у 210 (37,4%) мутация была выявлена. У 169 (80,5%) пациентов мутация в гене BRAF была определена до начала терапии (в среднем за 11,7 месяца до начала) и у 41 – после начала терапии (19,5%) (в течение трех месяцев, в среднем за 23 дня после начала терапии). При этом частота выявления мутации в гене BRAF была выше у пациентов в возрасте до 50 лет (< 50 лет – 59,4%, ≥ 50 лет – 29,1%; р < 0,001), а также у пациентов с локализацией первичного очага на туловище (42,6% vs 30,2% в области нижних конечностей, р = 0,031). Все эти данные подтверждают сегодняшнее понимание того, что мутация в гене BRAF чаще встречается у более молодых пациентов и с локализацией на туловище.
K.V. Orlova, PhD, L.V. Demidov, PhD
N.N. Blokhin National Medical Research Center of Oncology
Contact person: Kristina V. Orlova, krisman03@gmail.com
A mutation in the BRAF gene is the most important therapeutic target and the most common genetic change in skin melanoma, occurring in 40–60% of cases. In melanoma, more than 80 somatic mutations were detected in exon 15 of the BRAF gene and in 95% of cases it is V600 (replacement of one amino acid with valine 600). The most common genotype is V600E (replacement of valine with glutamic acid), which occurs in about 80% of cases of melanomas with a mutation in the BRAF gene. At the same time, the prevalence of mutations varies and varies in different countries and regions of residence.
The aim of the work is to evaluate the frequency of assays for molecular genetic characteristics of a tumor and the detection of mutations in the BRAF gene in Russia based on the results of an observational study in comparison with available data from the medical literature in other countries.
Material and methods. In the period from October 2020 to October 2022 The FORA (FOrteca Real practice Assessment) study, a multicenter prospective observational study of the effectiveness of prolgolimab therapy in patients with metastatic melanoma in real clinical practice in Russia (NCT05120024), included 700 patients with metastatic and/or inoperable melanoma who received prolgolimab as part of real clinical practice in oncological institutions at various levels in the Russian Federation. Patient information was collected on a platform developed for this study. Along with other parameters such as gender, age at the time of diagnosis, stage of the disease, localization of the primary tumor, metastatic foci, lactate dehydrogenase level, etc., the individual registration card of the patient contained a graph about the molecular genetic characteristics of the tumor. Namely: the mutation in the BRAF gene is vs is not vs was not determined with the indication of the type of mutation vs V600 without clarification.
Conclusions. Determination of a mutation in the BRAF gene was assigned to 561 (88.8%) of 632 patients with melanoma of the skin and without an identified primary focus who received prolgolimab therapy. Of these, 210 (37.4%) had the mutation detected. The frequency of detection of mutations in the BRAF gene was higher in patients under the age of 50 (< 50 years – 59.4%, ≥ 50 years – 29.1%; p < 0.001), as well as in patients with primary melanoma localization on the trunk (42.6% vs. 30.2% in the lower extremities, p = 0.031; 42.6% versus 26.2% in the upper extremities, p = 0.021). The V600E subtype was detected in 67.6%, and V600K in 7.1% of cases. The low frequency of detection of the V600E type mutation is due to the high frequency of detection of mutations in the BRAF V600 gene without specification (23.8%), which is due to the peculiarities of laboratory equipment and reagent kits used in laboratories in the regions of the Russian Federation.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.